三种HCV RNA荧光定量PCR检测试剂的结果分析及应用比较
2016-01-18淦伟强,黄小慧,谭雷等
作者单位: 510630 广州,中山大学附属第三医院感染科(淦伟强,严颖,林潮双),肝病实验室(黄小慧),超声科(谭雷)
三种HCV RNA荧光定量PCR检测试剂的结果分析及应用比较
淦伟强黄小慧谭雷严颖林潮双
【摘要】目的比较3种丙型肝炎病毒(HCV) RNA荧光定量PCR检测试剂的临床应用性能。方法采用国产A试剂(磁珠分离法)、国产B试剂(荧光探针法)和目前国际临床广泛应用的C试剂(内标法)同时检测110例丙型肝炎患者临床血液样本及梯度稀释的强阳性标本,从试剂间的相关性、检测灵敏度、特异度等对结果进行对比分析。结果A和B、A和C、B和C试剂间的相关系数分别为0.845、0.917、0.860(P均<0.01)。在3种方法均有数值的58例标本中,3种试剂所检出的HCV RNA水平比较差异无统计学意义(P>0.05)。但在低病毒载量(<103IU/ml)组中,3种试剂灵敏度比较差异有统计学意义(P<0.01),C试剂灵敏度最高,A试剂次之,B试剂最低。当病毒载量在2.00×103~2.00×106 IU/ml时,3种试剂的定量结果与理论值均有很好的相关性与重复性,其检测浓度的平均值与理论浓度的双对数线性相关系数分别为0.9983、0.9823、0.9999(P均<0.01);当病毒载量为2.00×102 IU/ml时,C试剂的检测结果最接近,A试剂次之,B试剂未能检出。结论C试剂作为国际上广泛应用于临床HCV RNA定量检测的试剂,优势明显;国产A试剂总体性能优于B试剂,且费用较国外试剂低廉,性价比较高。
【关键词】丙型肝炎;病毒;核酸定量;试剂;检测
DOI:10.3969/g.issn.0253-9802.2015.06.007
基金项目:国家自然科学基金(31370907);广东省自然科学基金(S2012010009155);十二五国家科技重大专项(2012ZX10002007)
通讯作者,林潮双,E-mail:linchaoshuang@126.com
收稿日期:(2015-01-06)
Comparison of application of three types of HCV-RNA fluorescent quantitative PCR detection reagentsGanWeiqiang,HuangXiaohui,TanLei,YanYing,LinChaoshuang.InfectiousDiseaseDepartment,theThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China
Correspondingauthor,LinChaoshuang,E-mail:linchaoshuang@126.com
Abstract【】ObjectiveTo compare the clinical application performance of three types of hepatitis C virus (HCV)-RNA fluorescent quantitative PCR detection reagents. MethodsDomestic A reagent (magnetic bead separation method), domestic B reagent (fluorescence probe method) and C reagent currently widely used internationally (internal standard method) were adopted to detect 110 clinical blood in patients with Hepatitis and strong-positive samples with gradient dilution. The correlation, sensitivity and specificity were statistically compared among the results of three detection reagents. ResultsThe correlation coefficient of three types of reagents was 0.845, 0.917 and 0.860 (all P<0.01). In 58 samples detectable by three methods, no significant difference was found in HCV RNA level among three kinds of reagents (P>0.05). However, in the low viral load group (<1.00×103 IU/ml), the sensitivity significantly differed among three types of reagents with highest sensitivity in C reagent, followed by A and B reagents. In the viral load group (2.00×103~2.00×106 IU/ml), high levels of correlation and repeatability between the quantitative results and theoretical values were observed in all reagents. The double logarithmic linear correlation coefficient of the mean and theoretical concentration was 0.9983, 0.9823 and 0.9999 (all P<0.01). When the viral load was 2.00×102 IU/ml, the detected concentration was the most similar to the theoretical concentration in C reagent, followed by A reagent and undetected in B reagent. ConclusionsC reagent was superior to A and B reagents in the HCV-RNA fluorescent quantitative PCR detection. Compared with B reagent, A reagent exhibited better performance. A reagent was cheaper compared with C reagent. Thus, A reagent could be used as a cost-effective HCV-RNA fluorescent quantitative PCR detection.
【Key words】Hepatitis C; Virus; Nucleic acid quantification; Reagent; Detection
丙型肝炎是一个重要的公共卫生问题,是引起慢性肝炎的主要原因之一。目前世界上大约1.7亿~2亿人感染了丙型肝炎病毒(HCV),平均感染率为3%[1-2],在我国,约有3 800万人感染HCV,多数HCV感染没有症状,少数引起急性肝炎,其症状也较乙型肝炎轻[3]。一般成人感染HCV后,约50%~80%发展成慢性丙型肝炎,其中约有20%发展为肝硬化。肝硬化患者每年约有1%~4%发展为肝癌[3]。我国是肝癌的高发地区之一,发病率约为30.3例/10万,每年约有14万人死于肝癌,占全世界肝癌死亡人数的50%以上,肝癌严重威胁着人们的健康及生命[4]。因此早期诊断和及时治疗尤为重要[4]。目前国内临床上常用于检测HCV的方法主要有2类:ELISA法测定HCV抗体(抗-HCV)及PCR检测血清中HCV RNA含量[5]。近年来,抗-HCV检测方法虽然有了很大的改进, 但仍然存在一定的局限性:如窗口期过长不利于早期诊断;有约1%~3%的患者抗-HCV可持续阴性,但此类患者的HCV RNA为阳性;抗体的检出仅代表既往感染且在病毒清除后长时间存在等[5-6]。检测HCV RNA水平对于评估慢性丙型肝炎的治疗效果至关重要,应该采用检测下限较低的、灵敏度较高的检测方法[7-8]。本研究选用国内试剂厂家中的2种HCV RNA检测试剂盒和1种目前国际临床广泛应用的HCV RNA检测试剂盒,对110例慢性丙型肝炎患者血液样本进行HCV RNA定量检测,并对检测结果进行对比分析,探讨各试剂提取方法的特点、准确度、灵敏度和临床应用价值。
对象与方法
一、研究对象
110例慢性丙型肝炎患者血液样本,取自2014年1月至6月中山大学附属第三医院的门诊及住院患者,-20℃冰箱保存。其中1例HCV强阳性血清样本,经中国药品生物制品检定所的HCV核酸国家标准品定值,确定浓度为2×106IU/ml。诊断慢性丙型肝炎,主要依据具有慢性肝炎症状、体征或病理提示慢性肝炎,同时抗-HCV 和HCV RNA 阳性[9]。
二、主要试剂和仪器
1. 试剂
包括荧光定量PCR试剂盒,A试剂为湖南圣湘生物科技有限公司提供的HCV核酸定量检测试剂盒(批号2014008,磁珠法),采用了磁珠法提取病毒核酸,最低检测限为50 IU/ml;B试剂由中山大学达安基因股份有限公司提供的HCV核酸检测试剂盒(批号2014005,荧光探针法),最低检测限为103IU/ml;C试剂由罗氏公司提供的HCV核酸定量试剂盒(批号123681,内标法),最低检测限为15 IU/ml。
2. 仪器
核酸扩增仪:A、B试剂采用美国Applied Biosystem公司的ABI 7300荧光定量PCR仪、C试剂采用罗氏COBAS AmpliPrep仪及Taq Man分析仪。核酸提取仪:A试剂为圣湘公司的NatCH 64自动化核酸提取仪。
三、HCV RNA定量检测
以阴性血清将HCV强阳性血清10倍梯度稀释至2.00×105IU/ml、2.00×104IU/ml、2.00×103IU/ml、2.00×102IU/ml。分别用3种试剂对上述样本及110例临床样本进行检测,方法如下:①试剂A,取出生化专用96孔盘,按试剂盒说明加入磁珠法RNA提取溶液及200 μl待测样本或阴性对照、阳性对照、定量参考品,然后置于NatCH 64自动化核酸提取仪上,执行相应的程序,程序运行完毕后,取出96孔板,加入50 μl PCR混和反应液,再置于NatCH 64自动化核酸提取仪上进行核酸冲提,最后将已提取核酸全部转移至0.2 ml PCR反应管中,盖上管盖,在ABI 7300荧光定量PCR仪上进行检测;②试剂B,在0.5 ml离心管中按试剂盒说明书依次加入相应的RNA提取液、100 μl样本、75%乙醇,离心去上清,打开管盖,65℃干燥10 min,之后加入逆转录PCR反应液进行逆转录,将按比例配好的HCV PCR反应液分装在0.2 ml PCR反应管中,加入5 μl逆转录后的样本上清液5 μl,上机检测;③试剂C,在样品管内加入850 μl血浆标本,按照操作步骤设置程序,并把样品置于COBAS AmpliPrep仪中,结束运行后,转移至COBAS TaqMan分析仪中。
四、统计学处理
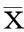
结果
一、3种HCV RNA荧光定量PCR检测试剂的相关性分析
采用A、B、C 3种试剂对110例临床血液标本进行检测,其中3种试剂对58例均有数值,其余52例为其中1种、2种或3种试剂检测为阴性的样本。A和B、A和C、B和C间的相关系数分别为0.845、0.917、0.860(P均<0.01),见图1。
二、不同HCV RNA载量对试剂检测结果的影响
A、B、C试剂对58例均阳性样本的定量结果分别为(4.14±1.88)、(4.35±1.31)、(4.26±1.79)log10IU/ml,比较差异无统计学意义(P>0.05)。但对110例血液样本的HCV RNA定量检测结果进行分组统计,在HCV高病毒载量(>106IU/ml)组中,B、C试剂检出HCV RNA病毒载量较高,A试剂则多定量在105~106IU/ml;在中等病毒载量(103~106IU/ml)组中,不同试剂间差异较少,A、B试剂与C试剂的相关系数分别为0.9248、0.8435(P均<0.01),A试剂与C试剂相关性更好;在低病毒载量(<103IU/ml)组中,不同试剂检测结果相差较大。其中C试剂检测为阴性的结果,A、B试剂检测均为阴性,表明A、B的特异性与C试剂一致,没有出现假阳性结果,特异度均为100%;C试剂检测为50~103IU/ml的29例样本中,由于A、B试剂的检测下限,B试剂检测均为阴性,灵敏度为0%,A试剂有14例样本检测结果呈阳性,灵敏度为48.3%。3种试剂的灵敏度比较差异有统计学意义(χ2=58.03,P<0.001),C试剂灵敏度最高,A试剂次之,B试剂最低,组间两两比较差异亦有统计学意义(P均<0.017)。

图1 3种HCV RNA荧光定量PCR检测试剂定量检测的相关性分析结果
A:A试剂与B试剂定量结果散点图,lgA和lgB相关系数为0.845(P<0.01);B:A试剂与C试剂定量结果散点图,lgA和lgC相关系数为0.917(P<0.01);C:B试剂与C试剂定量结果散点图,lgB和lgC相关系数为0.860(P<0.01)

表1 3种试剂对110例血清样本
三、强阳血清样本及其梯度稀释样本定量结果比较
对上述110例样本中的1例强阳性样本(经中国药品生物制品检定所的HCV核酸国家标准品定值)及其稀释样本,用3种试剂分别重复2次检测,当病毒载量在2.00×103~2.00×106IU/ml时,3种试剂的定量结果与理论值均有很好的相关性与重复性,其检测浓度的平均值与理论浓度的双对数线性相关系数分别为0.9983、0.9823、0.9999(P均<0.01);当病毒载量为2.00×102IU/ml时,C试剂的检测结果最接近,A试剂次之,B试剂未能检出,见表2。
表2 3种试剂对强阳性及其梯度
讨论
HCV RNA的检测对于区分HCV感染处于急性期、慢性期或是恢复期至关重要。HCV RNA的定性和定量检测,是判断丙型肝炎抗病毒治疗效果的重要标准。HCV RNA是病毒复制和肝炎进程的确切标志,测定HCV病毒载量可以监控HCV在体内的复制情况,可为HCV感染者的诊断和疗效评价提供重要依据[9]。
本研究中, 3种试剂检测均有数值的58例样本进行均值比较和相关性分析,总体结果比较差异无统计学意义。但是如果按病毒载量进行分组比较发现,高病毒载量组中,C试剂阳性例数较多,B试剂次之,A试剂最少,A试剂检出结果普遍低一个数量级,但就样本原始的Ct值来看,A试剂定量偏低的样本,其Ct值比B试剂的检测结果还小1~2个级别,因此,定量上的偏差,应该大部分来源于试剂各自标准品溯源和定值的问题。中等病毒载量组中,3种试剂结果差异较小,相关性最好,说明在中等病毒载量组中,3种试剂的定量相对而言最稳定,结果最准确。在低病毒载量组中,3种试剂检测结果相差较大。C试剂检测为阴性结果的样本,A、B试剂检测均为阴性,说明在病毒载量大于103IU/ml的样本中没有假阴性结果。C试剂检测为50~103IU/ml的样本中,由于A、B试剂的检测下限,B试剂检测均为阴性,A试剂有14例样本检测结果为阳性。这种假阴性的结果与核酸提取方法容易造成核酸丢失、操作步骤繁多、RNA可能会降解有关,而且病毒载量越低,出现假阴性结果的几率越高。
本研究选取的3种试剂中,A试剂采用了磁珠分离方法,检测下限为50 IU/ml。B试剂采用传统的乙醇沉淀法,检测下限为103IU/ml。C试剂采用内标法,检测下限为1.5 IU/ml。A试剂所用的磁珠分离法操作简单只需按顺序加好相应RNA提取液后直接上机,减少交叉污染及操作人员不同引起的差异,相比国外进口的磁珠分离法试剂的价格适中,相比国内采取其他提取方法的试剂检出下限较低,重复性好。B试剂采取的乙醇沉淀法,操作步骤繁琐,耗时长,过程涉及煮沸、开盖,容易造成污染及核酸丢失,最后提取的RNA上清液只取5 μl上机检测,可能会引起假阴性,重复性不高。C试剂是在COBAS AmpliPrep仪上通过普通硅基俘获技术进行自动样品制备。HCV的病毒颗粒在含有蛋白酶和离液序列高的裂解/结合缓冲剂中孵养,通过提高温度得以裂解,释放核酸并保护释放的HCV RNA不受血浆或血清中RNA酶的影响,除了第一步加样品至样品管,后续操作步骤均为仪器自动化操作,减少了人为因素和环境因素的影响,是目前国际上广泛应用于临床的检测方法。
从已知浓度的强阳性标本及其稀释样本的检测结果来看,病毒载量为2.00×103~2.00×106IU/ml时,3种试剂的定量结果与理论值均有很好的相关性与重复性。A、C试剂的定量结果与理论值有更好的相关性和重复性,而B试剂对同一标本测出的2次结果差异明显比A、C试剂大,进一步说明B试剂的提取方法、操作步骤繁琐,并且都是手工操作,可能造成的结果定值不准、重复性不佳。对于病毒载量为2.00×102IU/ml的样本,C试剂的检测灵敏度最高,A试剂次之,B试剂未能检出。从各自的检测浓度与理论浓度的双对数线性相关性比较中可以看出,C试剂最优,A次之,B试剂最差。
临床上HCV RNA定量对治疗具有重要的意义,首先有没有病毒的复制是确诊以及开始治疗的关键,在治疗过程中病毒对药物的应答如何、病毒复制是否下降、下降幅度等都涉及治疗方案的选择。因此,一个符合临床要求的试剂应该具有灵敏度高、定量准确、重复性好的优点。本研究显示,C试剂作为国际上广泛应用于临床HCV RNA定量检测的试剂,优势明显。国产A试剂总体性能优于B试剂,核酸获得率高、操作简单、兼具高灵敏度与定量准确性,相比国外进口HCV RNA定量试剂较为低廉,对普通丙型肝炎患者而言应该是一种性价比较高的选择。
参考文献
[1]Te HS, Jensen DM. Epidemiology of hepatitis B and C viruses: a global overview. Clin Liver Dis, 2010,14(1): 1-21.
[2]Pas S, Molenkamp R, Schinkel J, Rebers S, Copra C, Seven-Deniz S, Thamke D, de Knegt RJ, Haagmans BL, Schutten M. Performance evaluation of the new Roche cobas AmpliPrep/cobas TaqMan HCV test, Version 2.0, for detection and quantification of hepatitis C virus RNA. J Clin Microbiol,2013, 51(1):238-242.
[3]European Association for Study of Liver. EASL Clinical Practice Guidelines: management of hepatitis C virus infection. J Hepatol,2014, 60(2):392-420.
[4]刘惠媛,陈志敏,曾健伟,黄宝国,刘晋新,石裕明. 415例原发性肝癌患者的临床特点分析. 新医学,2013,44(2):123-126.
[5]Ghany MG, Nelson DR, Strader DB, Thomas DL, Seeff LB; American Association for Study of Liver Diseases. An update on treatment of genotype 1 chronic hepatitis C virus infection: 2011 practice guideline by the American Association for the Study of Liver Diseases. Hepatology, 2011, 54(4):1433-1444.
[6]Beinhardt S, Rutter K, Stattermayer AF, Ferenci P. Revisiting the predictors of a sustained virology response in the era of direct-acting antiviral therapy for hepatitis C virus. Clin Infect Dis, 2013, 56(1):118-122.
[7]Harrington PR, Zeng W, Naeger LK. Clinical relevance of detectable but not quantifiable hepatitis C virus RNA during boceprevir or telaprevir treatment. Hepatology, 2012, 55(4):1048-1057.
[8]Ghany MG, Liang TJ. Current and future therapies for hepatitis C virus infection. N Engl J Med, 2013, 369(7):679-680.
[9]中华医学会肝病学分会,中华医学会传染病与寄生虫病学分会. 丙型肝炎防治指南.中华肝脏病杂志,2004,12(4):194-198.
(本文编辑:林燕薇)

临床研究论著
