BDNF通过AKT/mTOR/70S6K途径影响Aβ25-35诱导的HT22细胞自噬的研究
2016-01-18范胜诺,张蓓,谷贝贝等
作者单位:510120 广州,中山大学孙逸仙纪念医院神经科(范胜诺,廖旺,刘军),麻醉科(谷贝贝);510080 广州,广东药学院附属第一医院神经科(张蓓);510080 广州,中山大学中山医学院在读硕士研究生(范胜诺)
BDNF通过AKT/mTOR/70S6K途径影响Aβ25-35诱导的HT22细胞自噬的研究
范胜诺张蓓谷贝贝廖旺刘军
【摘 要】目的探讨脑源性神经生长因子(BDNF)对抗β-淀粉样蛋白25-35的神经毒性作用是否与自噬有关,以及该自噬过程是否通过蛋白激酶B(AKT)/哺乳动物雷帕霉素靶蛋白(mTOR)/核糖体蛋白S6激酶(70S6K)途径调控。 方法将Aβ25-35加入不同浓度BDNF预处理后的HT22细胞共孵育24 h,采用CCK8法测细胞活力;将Aβ25-35及加或不加BDNF、Rapamycin、LY294002处理HT22细胞24 h,采用蛋白免疫印迹法检测LC3、p-AKT、p-70S6K的表达;采用免疫荧光法检测细胞核周自噬斑点变化情况。结果BDNF能改善细胞活力,以100 ng/ml时最为显著(P<0.05);Aβ25-35升高LC3-Ⅱ/Ⅰ比值,降低p-AKT、p-70S6K的表达,并增加细胞自噬斑点数量(P均<0.05);BDNF能增强Aβ25-35诱导的自噬活动,该增强作用可被LY294002抑制(P均<0.05)。结论BDNF能对抗Aβ25-35的神经毒性,与通过AKT/mTOR/70S6K途径增强Aβ25-35诱导的HT22细胞自噬相关。
【关键词】脑源性神经营养因子;β-淀粉样蛋白25-35;HT22细胞;自噬
DOI:10.3969/g.issn.0253-9802.2015.06.004
基金项目:国家自然科学基金(81372919);广东省自然科学基金(S2013010013964)
通讯作者,刘军, E-mail:docliujun@126.com
收稿日期:(2014-12-31)
Effect of BDNF on Aβ25-35-induced autophagy via AKT/mTOR/70S6K pathway in HT22 cellsFanShengnuo,ZhangBei,GuBeibei,LiaoWang,LiuJun.SunYat-senMemorialHospitalofSunYat-senUniversity,Guangzhou510120,China
CorrespondingAuthor,LiuJun,E-mail:docliujun@126.com
Abstract【】ObjectiveTo investigate the correlation between neuroprotective effect of brain-derived neurotrophic factor (BDNF) against Amyloid β-proiein25-35 neurotoxicity, and validate whether the autophagy was regulated by protein kinase B (AKT)/ mammalian target of rapamycin (mTOR)/ ribosomal protein S6 kinase (70S6K) signaling pathway. MethodsAβ25-35 was supplemented and co-cultured with the HT22 cells pretreated with different concentrations of BDNF for 24 h. The viability of HT22 cells was evaluated by cell counting kit-8 (CCK8). The expression levels of microtubule-associated protein light chain 3 (LC3), p-AKT, p-70S6K in HT22 cells were detected by Western blot after treated with Aβ25-35 in the presence or absence of BDNF, rapamycin, LY294002 for 24 h. Immunofluorescence assay was performed to observe the changes in the LC3 puncta in the perinuclear region of HT22 cells. ResultsBDNF could improve HT22 cell viability, especially at the concentration of 100 ng/ml (P<0.05). Aβ25-35 elevated the LC3-Ⅱ/Ⅰ ratio, down-regulated the expression of p-AKT and p-70S6K and increased the number of LC3 puncta in HT22 cells (all P<0.05). BDNF enhanced the autophagy induced by Aβ25-35, which could be inhibited by LY294002 (both P<0.05). ConclusionsBDNF is able to alleviate the neurotoxicity of Aβ25-35 by promoting the Aβ25-35-induced HT22 autophagy via AKT/mTOR/70S6K signaling pathway.
【Key words】Brain derived neurotrophic factor; Amyloid β-protein25-35; HT22 cells; Autophagy
阿尔茨海默病(AD)是常见的的中枢神经系统退行性疾病,以广泛的神经元丢失、神经纤维缠结(NFTs)及脑内大量β-淀粉样蛋白(Aβ)沉积形成为典型病理改变。在脑内异常形成并堆积的Aβ产生的神经毒性是AD形成和发展的重要因素[1-2]。有学者发现,在AD患者大脑中,肿胀的发生营养障碍的神经突中含有大量的自噬泡,Aβ累积在自噬泡中,提示自噬系统与AD的发病机制密切相关,AD患者的细胞自噬功能有不同程度的损伤[1]。脑源性神经生长因子(BDNF)在神经元的存活中起重要作用,有研究表明部分BDNF是通过调控磷脂酰肌醇3激酶(PI3K)及下游蛋白激酶B (PKB/AKT)、哺乳动物雷帕霉素靶蛋白(mTOR)、核糖体蛋白S6激酶(70S6K),即AKT/mTOR/70S6K途径参与完成自噬等活动[3-4]。我们既往使用Aβ25-35处理HT22细胞以模拟AD时发现,Aβ25-35可诱导HT22发生自噬[5]。但是该自噬活动的机制尚未明确,因此本课题旨在观察BDNF对Aβ25-35处理的HT22细胞有无保护作用,并探讨该保护作用是否与自噬活动相关以及AKT/mTOR/70S6K途径在其中的作用,以期为AD的治疗提供新思路。
材料与方法
一、仪器与试剂
主要仪器包括Thermo恒温培养箱、奥林巴斯BX51WI研究级正置荧光显微镜、Spectramax M5多功能酶标仪、BIO-RAD电泳仪及电转仪;CCK-8购自日本同仁公司;胰蛋白酶、DMEM培养基、FBS胎牛血清、Neurobasal培养基和N2添加剂均购自Gibco公司;自噬激活剂Rapamycin、自噬抑制剂LY294002 购于美国Sigma-Aldrich公司; 重组人型BDNF购自BioVision公司;抗LC3抗体购自MBL公司,其余一抗(p-AKT、p-70S6K、Tublin)及二抗均购自CST公司,所有一抗均为兔抗小鼠抗体,二抗为羊抗兔抗体;Aβ25-35由上海生工生物工程股份有限公司合成;ECL发光液购自Millipore公司,BCA法蛋白浓度测定试剂盒及其余试剂购自武汉博士德公司。
二、细胞培养及药物处理
HT22细胞株,是1种永生化的小鼠海马神经元细胞,其培养及分化参照文献[6],由本实验组冻存。Aβ25-35老化处理及合适工作浓度(10 μM、40 μM)由本课题前期工作确定[5]。根据分组需要分别加入以下试剂,于Aβ25-35处理前2 h加入不同浓度的BDNF,于Aβ25-35处理前0.5 h加入Rapamycin(1 μM)、LY294002(20 μM)。
三、CCK8法测细胞活力
将HT22细胞以5×104/ml的密度种植于96孔细胞培养板中,分4组、每组设5个复孔,重复做3次,并设立对照组。各组分化后加入不同浓度的BDNF(10 ng/ml、50 ng/ml、100 ng/ml、500 ng/ml)处理2 h后加入Aβ25-35共培养24 h,对照组不加任何药物。每孔加入10 L的CCK-8试剂于37 ℃、5%二氧化碳培养箱内温育1.5 h,用酶标仪于450 nm波长处测定各孔的吸光度并计算细胞活力。
四、蛋白免疫印迹法检测LC3等蛋白的表达
根据CCK8法得出BDNF合适浓度为100 ng/ml,分别以Aβ25-35及加或不加BDNF、Rapamycin(1 μM)、LY294002(20 μM)处理HT22细胞24 h,裂解后用BCA法测定蛋白浓度,各组蛋白浓度统一为30 μg/ml,加上样缓冲液、变性后用12 %分离胶电泳分离蛋白后湿转到硝酸纤维素膜上,5 %脱脂奶粉室温封闭1 h, 加入一抗(LC3、p-AKT、p-70S6K,Tublin均为1∶1 000),4 ℃过夜,TBST洗膜15 min×3次,二抗(1∶3 000)室温1 h ,TBST洗膜15 min×3次后用ECL法曝光。
五、免疫荧光法测定自噬小体
参考文献[5-6]前期基础研究方法,取对数生长的HT22细胞种于24孔细胞培养板的细胞爬片上,贴壁后以Aβ25-35及加或不加BDNF、Rapamycin(1 μM)、LY294002(20 μM)处理HT22细胞24 h,用4%多聚甲醛溶液固定15 min,透膜封闭后加入一抗Anti-LC3于4 ℃孵育过夜,加入二抗常温孵育1 h,DAPI染核5 min后封片,并于正置荧光显微镜下拍照。
六、统计学处理
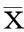
结果
一、BDNF和Aβ25-35对细胞活力的影响
单独使用BDNF处理浓度为10 ng/ml、50 ng/ml、100 ng/ml时,细胞活力与对照组比较差异无统计学意义,当BDNF处理浓度为500 ng/ml时细胞活力明显降低(图1A);单独予Aβ25-3540 μM时,细胞活力降低,与我们前期研究结果一致,而预先使用不同浓度BDNF与Aβ25-35共处理时,我们发现,BDNF浓度为50 ng/ml、100 ng/ml时均能改善细胞活力,其中以100 ng/ml时最为显著,提示了BDNF有对抗Aβ25-35细胞毒性作用,我们以100 ng/ml BDNF浓度为后续工作浓度(图1B)。
图1 BDNF处理及BDNF预处理后加入Aβ 25-35 24 h对细胞活力的影响
A:经不同浓度BDNF处理后结果,可见单独使用BDNF时,当浓度为500 ng/ml时细胞活力出现降低[活力为(76.217±5.832)%],与对照组比较,*为t=7.113,P<0.001;B:经Aβ25-3540μM 与不同浓度BDNF处理时,BDNF浓度为50 ng/ml[活力为(85.600±4.615)%]、100 ng/ml[活力为(94.800±3.962)%]时细胞活力均得到改善,其中以100 ng/ml时最明显;2组比较,*为t=4.437、P=0.017,**为t=7.839、P<0.001
二、Aβ25-35处理对LC3、p-AKT、p-70S6K表达强度的影响
LC3是自噬活动的标志蛋白,自噬发生时LC3-Ⅰ转变为LC3-Ⅱ,因此LC3-Ⅱ/Ⅰ比值能大致反映自噬水平的高低(参考2012年的《Guidelines for the use and interpretation of assays for monitoring autophagy》)。我们单独予Aβ25-35处理HT22细胞24 h,LC3-Ⅱ/Ⅰ比值高于对照组,而40 μM处理组较10 μM 处理组比值高(图2A);PI3K通路标志蛋白AKT、70S6K磷酸化水平的比较结果示,Aβ25-35处理抑制了p-AKT、p-70S6K的表达,较之10 μM 处理组,40 μM处理组的抑制效果更明显(图2B),这提示可能是PI3K通路参与了Aβ25-35诱导的HT22细胞自噬活动。当使用BDNF、自噬抑制剂LY294002与Aβ25-35共孵育,以及Rapamycin作为阳性对照时,与单独使用Aβ25-35比较,BDNF进一步升高了LC3-Ⅱ/Ⅰ比值,该升高效益可被LY294002抑制(图3A、B);同样的,BDNF可降低p-AKT、p-70S6K的表达,LY294002能抑制该作用(图3C、D),这提示BDNF可通过PI3K途径增强Aβ25-35诱导的HT22细胞自噬活动。

图2 Aβ 25-35处理24 h后LC3、p-AKT、p-70S6K表达强度
A:蛋白免疫印迹图 。B:定量分析图,可见Aβ25-35处理HT22细胞24 h,LC3-Ⅱ/Ⅰ比值高于对照组(与对照组比较,*为P<0.05),40 μM处理组较10 μM 处理组升高(2组比较,# 为P<0.05);各组LC3-Ⅱ/Ⅰ比值如下,对照组为0.400±0.079,10 μM组为1.580±0.192,40 μM组为4.510±0.361;各组比较的t值及P值如下,对照组vs. 10 μM组t=7.804,P<0.001;对照组vs. 40 μM组t=34.778,P<0.001;10 μM组vs. 40 μM组t=19.312,P<0.001。Aβ25-35处理抑制了p-AKT、p-70S6K的表达(与对照组比较,*为P<0.05),较之10 μM 处理组,40 μM处理组抑制效果更明显(#为P<0.05),各组p-AKT/Tublin表达如下,对照组为0.810±0.152,10 μM组为0.300±0.037,40 μM组为0.137±0.019;各组比较的t值及P值如下,对照组vs.10 μM组t=8.883,P<0.001;对照组vs. 40 μM组t=11.531,P<0.001;10 μM组vs. 40 μM组t=2.648,P=0.044。各组pS6K/Tublin表达如下,对照组为1.580±0.202;10 μM组为0.800±0.158;40 μM组为0.360±0.065;各组比较的P值及t值如下, 对照组vs.10 μM组t=8.074,P<0.001;对照组vs. 40 μM组t=12.628,P<0.001;10 μM组vs. 40 μM组t=4.554,P=0.002

图3 BDNF对LC3、p-AKT、p-70S6K表达的影响
A:蛋白免疫印迹图。B:定量分析,比起单独使用Aβ25-35,BDNF进一步升高了LC3-Ⅱ/Ⅰ比值(与对照组比较,*为P<0.05;2组间比较,#为P<0.05),各组LC3-Ⅱ/Ⅰ比值如下,Aβ25-35组为2.500±0.292,Aβ25-35+BDNF组为6.520±0.581,Aβ25-35+BDNF+LY组为2.040±0.336,Aβ25-35+Rapa组为4.440±0.365;各组比较的t值与P值如下,Aβ25-35组vs. Aβ25-35+BDNF组为t=16.75、P<0.001,Aβ25-35+BDNF组vs. Aβ25-35+BDNF+LY组 为t=18.667、P<0.001,Aβ25-35组vs. Aβ25-35+Rapa组为t=8.083、P<0.001。C、D:定量分析,对比单独使用Aβ25-35,BDNF能进一步降低p-AKT、p-70S6K的表达,LY294002能抑制BDNF上述作用,各组p-AKT/Tublin表达如下,Aβ25-35组为1.010±0.297,Aβ25-35+BDNF组为 0.470±0.079,Aβ25-35+BDNF+LY组为1.360±0.297,Aβ25-35+Rapa组为0.634±0.117;各组比较的t值与P值如下,Aβ25-35组vs. Aβ25-35+BDNF组t=3.333、P=0.033;Aβ25-35+BDNF组vs. Aβ25-35+BDNF+LY组为t=5.494、P<0.001;Aβ25-35组vs. Aβ25-35+Rapa组 为t=2.321、P= 0.031。各组p-70S6K/Tublin表达如下,Aβ25-35组为0.600±0.127,Aβ25-35+BDNF组为 0.216±0.048,Aβ25-35+BDNF+LY组为0.601±0.091,Aβ25-35+Rapa组为0.402±0.042;各组比较的t值与P值如下,Aβ25-35组vs. Aβ25-35+BDNF组t=7.385、P<0.001 ,Aβ25-35+BDNF组vs. Aβ25-35+BDNF+LY组t=0.737、P<0.001,Aβ25-35组vs. Aβ25-35+Rapa组t=3.799、P= 0.011
三、不同处理组HT22细胞内免疫荧光斑点及定量分析结果
使用LC3抗体对各处理组进行染色,发现经Aβ25-35处理后的HT22细胞核周出现明显斑点状结构,预先使用BDNF后,细胞中高亮的斑点更多,甚至成斑块状,LY294002能减少BDNF导致的大量斑点形成(图4)。

图4 不同处理组HT22细胞内免疫荧光斑点及定量分析
Aβ组结果示经Aβ25-35处理后的HT22细胞核周出现明显斑点状结构(箭头所示为荧光斑点);Aβ+BDNF组结果示合用BDNF后的细胞斑点更多,甚至成斑块状;Aβ+BDNF+LY 组结果示LY294002能抑制BDNF的作用;Rapa组为阳性对照组。对照组斑点定量为(4.100±1.581) Dots/Unit,Aβ25-35组为(44.020±7.778) Dots/Unit,Rapa组为(45.715±4.527)Dots/Unit,Aβ25-35+BDNF组为(65.200±10.986)Dots/Unit,Aβ25-35+BDNF+LY组为(30.060±7.021)Dots/Unit。各组比较的t值与P值如下,对照组vs.Aβ25-35组t=8.889、P<0.001,对照组vs.Rapat=9.111、P<0.001,对照组vs. Aβ25-35+BDNF组t=13.556、P<0.001,对照组vs.Aβ25-35+BDNF+LY组t=5.911、P<0.001,Aβ25-35组vs. Aβ25-35+BDNF组t=4.711、P=0.001,Aβ25-35+BDNF组vs.Aβ25-35+BDNF+LY组t=7.689、P<0.001。柱状图所示,与对照组比较,*为P<0.05;2组间比较,#为P<0.05
讨论
AD病理机制的研究和药物的开发已成为医学界关注的老年病热点问题,目前针对AD的基础研究主要集中在抑制Aβ异常聚集,AD患者大脑中过度聚集的Aβ主要由清除障碍引起,因此,清除AD患者大脑中过度聚集的Aβ是治疗的关键点[7]。
自噬作为细胞在不利环境下的1种存活机制,可通过将细胞内的长寿命蛋白、可溶性蛋白、受损细胞器等胞内物质转运到溶酶体进行降解,重新利用以满足细胞所需,从而降低毒性物质对细胞的伤害,这其中就包括Aβ这种难以降解的蛋白[8-9]。自噬过程中形成自噬泡,为包裹废弃的细胞质和细胞器的双层膜结构,它和溶酶体融合形成成熟的自噬溶酶体,更好地对胞内成分如衰老受损的细胞器、无生物功能的大分子进行降解,还能解除蛋白质异常折叠,起细胞清道夫的作用。自噬功能障碍与各种神经变性疾病,如AD、帕金森病、亨廷顿病等关系密切[10]。研究表明,AD患者大脑神经元中含有大量的自噬泡,Aβ积聚在自噬泡中,且自噬功能有不同程度的障碍。我们既往在使用海马神经元细胞系HT22接受Aβ25-35干预以体外模拟AD时发现,高浓度Aβ25-35对HT22细胞有明显的毒性作用,且与细胞自噬功能密切相关[5]。本研究再次证实了Aβ25-35能诱导HT22细胞发生自噬,且该自噬与处理浓度相关。
BDNF与原肌球蛋白受体激酶(TrkB)结合后可激活丝裂原激活蛋白激酶/细胞外信号调节激酶(MAPK/ERK)、磷脂酶Cg(PLCg)和磷脂酰肌醇3激酶(PI3K)通路,其中PI3K通路对神经元细胞发育、分化、再生、存活、突触可塑性、轴突逆向运输等有着重要作用[11]。研究表明,BDNF能有效对抗缺氧、自由基损伤、Aβ等导致的神经毒性[3-4, 12]。本研究也观察到BDNF能改善Aβ25-35导致的细胞活力降低。哺乳动物mTOR是自噬的负调控因子,是1种丝氨酸/苏氨酸激酶,在细胞的增殖和生长中发挥重要作用。mTOR在神经元轴突的伸展方向、树突的发育和树突棘的形状过程中都至关重要[13-14]。PI3K通过AKT/mTOR/70S6K调控自噬活性是一重要的信号级联,研究表明,激活的PI3K/AKT信号通路作用于mTOR抑制神经元凋亡;磷酸化的AKT能激活下游的 TSC1/2,进一步磷酸化mTOR、mTOR通过抑制下游分子ULK1复合体来调控自噬,因此AKT、p70S6K磷酸化水平与自噬水平成反比[15]。我们使用Aβ25-35诱导HT22细胞发生自噬时,p-AKT、p-70S6K表达降低,荧光图显示自噬斑点增多,而加用BDNF后p-AKT、p-70S6K表达进一步降低,自噬斑点进一步增多,且自噬抑制剂LY294002在一定程度上能抵消BDNF的作用,提示BDNF在此自噬活动中对Aβ25-35有同向增强的效果。结合使用BDNF后能缓解Aβ25-35导致的细胞活力降低,我们认为BDNF能对抗Aβ25-35的神经毒性,与增强神经元自噬及调控AKT/mTOR/70S6K通路相关。
在一些神经疾病中,自噬活性的高水平对神经元的存活极其不利,但在AD的研究中,较多研究者倾向于自噬对神经元变性有明显的改善作用[16-18]。本研究发现BDNF通过AKT/mTOR/70S6K途径增强Aβ25-35诱导的神经元自噬,这种自噬的发生伴随着HT22细胞活力的改善。也有学者认为通过激活mTOR,可在一定情况下阻止细胞发生自噬从而加速细胞死亡,而抑制 mTOR则能加强自噬以消化胞内异常聚集的蛋白以使细胞存活[19]。自噬作为一把双刃剑,活性过高或过低均不利于细胞功能的稳定,AKT/mTOR/70S6K通路调控自噬可能存在一“平衡点”,但目前我们对这个“平衡点”仍处于未知阶段。BDNF是如何增强神经元自噬的调控机制需要我们作进一步探讨。
参考文献
[1]Nixon RA. Autophagy, amyloidogenesis and Alzheimer disease. J Cell Sci,2007,120(Pt 23):4081-4091.
[2]Lewczuk P, Mroczko B, Fagan A, Kornhuber J. Biomarkers of Alzheimer’s disease and mild cognitive impairment: A current perspective. Adv Med Sci,2014,60(1):76-82.
[3]Kim JH. Brain-derived neurotrophic factor exerts neuroprotective actions against amyloid beta-induced apoptosis in neuroblastoma cells. Exp Ther Med,2014,8(6):1891-1895.
[4]Chen A, Xiong LJ, Tong Y, Mao M. Neuroprotective effect of brain-derived neurotrophic factor mediated by autophagy through the PI3K/Akt/mTOR pathway. Mol Med Rep,2013,8(4):1011-1016.
[5]张蓓,谷贝贝,范胜诺,赵嘉,赵仲艳,刘军. β-淀粉样蛋白Aβ25-35诱导HT22细胞自噬及其对V-ATPase表达的影响. 中山大学学报:医学科学版,2013,34(1):1-5.
[6]Zhao ZY, Luan P, Huang SX, Xiao SH, Zhao J, Zhang B, Gu BB, Pi RB, Liu J. Edaravone protects HT22 neurons from H2O2-induced apoptosis by inhibiting the MAPK signaling pathway. CNS Neurosci Ther,2013,19(3):163-169.
[7]李家林,王金环. 阿尔茨海默病免疫治疗的研究进展. 新医学,2012,43(1):1-3.
[8]Jiang P, Mizushima N. Autophagy and human diseases. Cell Res,2014,24(1):69-79.
[9]Zhu XC, Yu JT, Jiang T, Tan L. Autophagy modulation for Alzheimer’s disease therapy. Mol Neurobiol,2013,48(3):702-714.
[10]Wong E, Cuervo AM. Autophagy gone awry in neurodegenerative diseases. Nat Neurosci,2010,13(7):805-811.
[11]Numakawa T, Suzuki S, Kumamaru E, Adachi N, Richards M, Kunugi H. BDNF function and intracellular signaling in neurons. Histol Histopathol,2010,25(2):237-258.
[12]Xia Y, Wang CZ, Liu J, Anastasio NC, Johnson K M. Brain-derived neurotrophic factor prevents phencyclidine-induced apoptosis in developing brain by parallel activation of both the ERK and PI-3K/Akt pathways. Neuropharmacology,2010,58(2):330-336.
[13]Child ND, Benarroch EE. mTOR: its role in the nervous system and involvement in neurologic disease. Neurology,2014,83(17):1562-1572.
[14]Lee DH, Luo X, Yungher BJ, Bray E, Lee J K, Park KK. Mammalian target of rapamycin’s distinct roles and effectiveness in promoting compensatory axonal sprouting in the injured CNS. J Neurosci,2014,34(46):15347-15355.
[15]Jung CH, Ro SH, Cao J, Otto NM, Kim DH. mTOR regulation of autophagy. FEBS Lett,2010,584(7):1287-1295.
[16]Yang Y, Coleman M, Zhang L, Zheng X, Yue Z. Autophagy in axonal and dendritic degeneration. Trends Neurosci,2013,36(7):418-428.
[17]Wang S, Zhou SL, Min FY, Ma JJ, Shi XJ, Bereczki E, Wu J. mTOR-mediated hyperphosphorylation of tau in the hippocampus is involved in cognitive deficits in streptozotocin-induced diabetic mice. Metab Brain Dis,2014,29(3):729-736.
[18]Caccamo A, Majumder S, Richardson A, Strong R, Oddo S. Molecular interplay between mammalian target of rapamycin (mTOR), amyloid-beta, and Tau: effects on cognitive impairments. J Biol Chem,2010,285(17):13107-13120.
[19]Heras-Sandoval D, Perez-Rojas JM, Hernandez-Damian J, Pedraza-Chaverri J. The role of PI3K/AKT/mTOR pathway in the modulation of autophagy and the clearance of protein aggregates in neurodegeneration. Cell Signal,2014,26(12):2694-2701.
(本文编辑:洪悦民)

基础研究论著
