β-synuclein对SH-SY5Y细胞酪氨酸羟化酶表达的影响
2016-01-18倪明,杨璐,樊秀双等
作者单位:261053 潍坊,潍坊医学院病理生理学教研室
β-synuclein对SH-SY5Y细胞酪氨酸羟化酶表达的影响
倪明杨璐樊秀双满建梅郭军堂
【摘要】目的探讨β-synuclein对酪氨酸羟化酶(TH)表达的影响。方法采用流式细胞技术检测稳定表达β-synuclein神经母细胞瘤SH-SY5Y细胞(实验组)与神经母细胞瘤 SH-SY5Y 细胞(对照组)内活性氧类物质(ROS)的含量。采用原位免疫荧光法、免疫组织化学染色法及蛋白免疫印迹法检测实验组与对照组细胞内TH的表达情况。结果流式细胞仪显示实验组的ROS峰值较对照组左移。原位免疫荧光法、免疫组织化学染色法及蛋白免疫印迹法检测结果显示TH在实验组中的表达水平较对照组低(P均<0.05)。结论β-synuclein可能抑制TH的表达。
【关键词】β-synuclein;帕金森病;酪氨酸羟化酶;活性氧类物质
DOI:10.3969/g.issn.0253-9802.2015.06.006
基金项目:山东省自然科学基金( ZR2011HM014)
通讯作者,郭军堂,E-mail:guojuntang@163.com
收稿日期:(2014-12-29)
Effect of β-synuclein on the expression of tyrosine hydroxylase in SH-SY5Y cellsNiMing,YangLu,FanXiushuang,ManJianmei,GuoJuntang.DepartmentofPathophysiology,WeifangMedicalUniversity,Weifang261053,China
Correspondingauthor,GuoJuntang,E-mail:guojuntang@163.com
Abstract【】ObjectiveTo investigate the effect of β-synuclein upon the expression of tyrosine hydroxylase (TH). MethodsThe intracellular reactive oxygen species (ROS) was measured by flow cytometry in the human neuroblastoma cell line SH-SY5Y stably expressing β-synuclein (experimental group) and normal SH-SY5Y cells (control group). The levels of TH in SH-SY5Y cells of experimental group and control group were detected by in situ immunofluorescence, immunohistochemical staining and western blot. Results The ROS peak in the experimental group was shifted to the left compared with that in the control group revealed by flow cytometry. The expression level of TH in the experimental group was significantly lower than that in the control group (P<0.05) detected by in situ immunofluorescence, immunohistochemistry and western blot. Conclusionβ-synuclein might be able to suppress the expression of TH.
【Key words】β-synuclein; Parkinson’s disease; Tyrosine hydroxylase; Reactive oxygen species
帕金森病是目前威胁老年人健康的重大疾病之一。其病理特征主要是多巴胺能神经元逐渐丧失和路易小体的形成。α-synuclein 是路易小体的主要组成成分,有研究发现,在小鼠单一的纹状体内注射合成的错误折叠的α-synuclein可引起小鼠神经细胞内一系列的退行性病理改变,如黑质多巴胺神经元选择性损失、运动协调障碍,因此α-synuclein的异常状态足以导致帕金森病的基本病理及行为改变[1]。同时α-synuclein还可通过调节酪氨酸羟化酶(TH)的活性等途径来影响多巴胺的合成及代谢,进而促进帕金森病的发生和发展[2]。β-synuclein与α-synuclein是同族异构体,但是β-synuclein能通过分子间的相互作用阻止α-synuclein蛋白的异常聚集,进而对神经元起保护作用,但其具体机制尚未明确[3]。本研究主要探讨β-synuclein对TH表达的影响,探讨其在帕金森病发病过程中的作用。
材料与方法
一、材料
神经母细胞瘤 SH-SY5Y 细胞株购自中国医学科学院基础所;稳定表达β-synuclein神经母细胞瘤细胞株SH-SY5Y 由本课题组构建; ECL化学发光剂购自碧云天生物技术研究所; β-synuclein兔抗人多克隆抗体及鼠抗人β-actin 单克隆抗体购自Santa Cruz公司; 异硫氰酸荧光素(FITC) 标记山羊抗兔IgG、辣根酶标记山羊抗兔IgG、辣根酶标记山羊抗小鼠IgG及 DAB 显色试剂盒购自北京中杉金桥生物技术有限公司;胎牛血清购自杭州四季青公司;2’-7’-二氯荧光素双醋酸盐(DCFH-DA)购自Sigma公司。
二、方法
采用流式细胞技术检测细胞内活性氧类物质水平。采用原位免疫荧光法、免疫组织化学(免疫组化)染色法及蛋白免疫印迹法检测TH的表达情况。
1.细胞培养
将细胞接种于含10%胎牛血清的DMEM培养基,于37 ℃、5%二氧化碳孵育箱中传代培养。
2.流式细胞技术
用胰酶消化细胞后,加入DMEM培养基将其吹打成细胞悬液,用细胞计数板计数,取1×106个细胞,1 000 rpm/min离心5 min,用磷酸盐缓冲液(PBS)洗涤细胞沉淀并重悬离心2次。洗涤后的细胞沉淀加入1 ml的PBS重悬,将细胞悬液用细胞筛过滤成单层细胞悬液,再加入荧光探针DCFH-DA染色液,使终浓度为10 μmol/L,室温避光孵育10 min,每隔2 min颠倒混匀1次,使荧光探针DCFH-DA与细胞充分接触进入细胞内。每个样本孵育到第10 min时,用流式细胞仪以激发波长为488 nm、发射波长为525 nm来检测细胞内活性氧类物质(ROS)变化水平。以稳定表达β-synuclein神经母细胞瘤 SH-SY5Y 细胞为实验组,神经母细胞瘤 SH-SY5Y 细胞为对照组。
3.原位免疫荧光法
取出培养72 h 的细胞盖玻片,用PBS漂洗,以甲醇与丙酮比例为3∶1的固定液固定细胞15 min, 0.5%的聚乙二醇辛基苯基醚(TritonX-100)通透细胞20 min。用5%山羊血清室温封闭30 min,加入PBS稀释的TH抗体(1∶100) 于4℃ 过夜;避光加入PBS稀释的FITC标记的山羊抗兔IgG二抗(1∶200)于37℃孵育2 h。用50%甘油封片。以稳定表达β-synuclein细胞为实验组,神经母细胞瘤SH-SY5Y细胞为对照组,于荧光倒置显微镜下观察,有绿色荧光为TH蛋白表达阳性。
4.免疫组化染色法
将细胞接种于载玻片上培养48 h,用4%多聚甲醛固定30 min,PBS洗5 min × 3 次,抗原修复及封闭后,加入PBS稀释的TH抗体(1∶100)于4℃ 过夜;PBS洗涤,加入辣根过氧化物酶标记山羊抗兔IgG二抗(1∶200)于37℃孵育2 h,用PBS洗涤,进行DAB显色。以稳定表达β-synuclein细胞为实验组,神经母细胞瘤SH-SY5Y细胞为对照组。苏木素复染、脱水、透明、封片,镜下观察,以上实验重复3次。
5.蛋白免疫印迹法
当细胞密度达到约85%时,用细胞裂解液裂解细胞,用BCA试剂盒进行核蛋白定量,取蛋白样品约30 μg经12% SDS-PAGE凝胶电泳,将蛋白条带转移到0.45 μm 硝酸纤维素膜上,置于5%的脱脂奶粉封闭液中,加一抗TH(1∶500)于4℃ 过夜;TBST洗膜3次各10 min,加入辣根过氧化物酶标记山羊抗兔IgG二抗(1∶5 000)于室温孵育2 h,TBST洗膜3次各10 min,将膜置于ECL化学发光剂中,用X线胶片曝光、显影及定影。β-actin 作为内参。重复实验3次。
三、统计学处理
采用SPSS 17.0软件处理数据。计量资料的比较行t检验,以P<0.05为差异有统计学意义。
结果
一、流式细胞技术检测结果
在SH-SY5Y多巴胺能神经元细胞中,多巴胺代谢是ROS产生的主要原因。通过流式细胞技术检测ROS峰值变化可精确反应SH-SY5Y细胞内的ROS含量的变化。当峰值左移时提示其抑制ROS的表达,当峰值右移时提示其促进ROS的表达。实验组的ROS峰值较对照组明显左移,提示β-synuclein抑制细胞内ROS的表达(图1A、B)。
二、原位免疫荧光法检测结果
实验组与对照组细胞内均可见绿色荧光,提示稳定表达β-synuclein 的神经细胞与SH-SY5Y细胞内TH表达均阳性,经IPP图像分析系统分析(重复3次实验后取均值),对照组的灰度值为4.452±0.03、实验组为1.223±0.02,两者比较差异有统计学意义(t=44.7,P<0.05),提示β-synuclein抑制TH的表达(图1C、D)。
三、免疫组化染色法检测结果
于显微镜下观察实验组与对照组细胞背景清晰, 细胞核和细胞质区别明显,2种细胞的胞质中均见被染色的棕黄色颗粒,但实验组与对照组相比颜色较浅(图1E、F)。
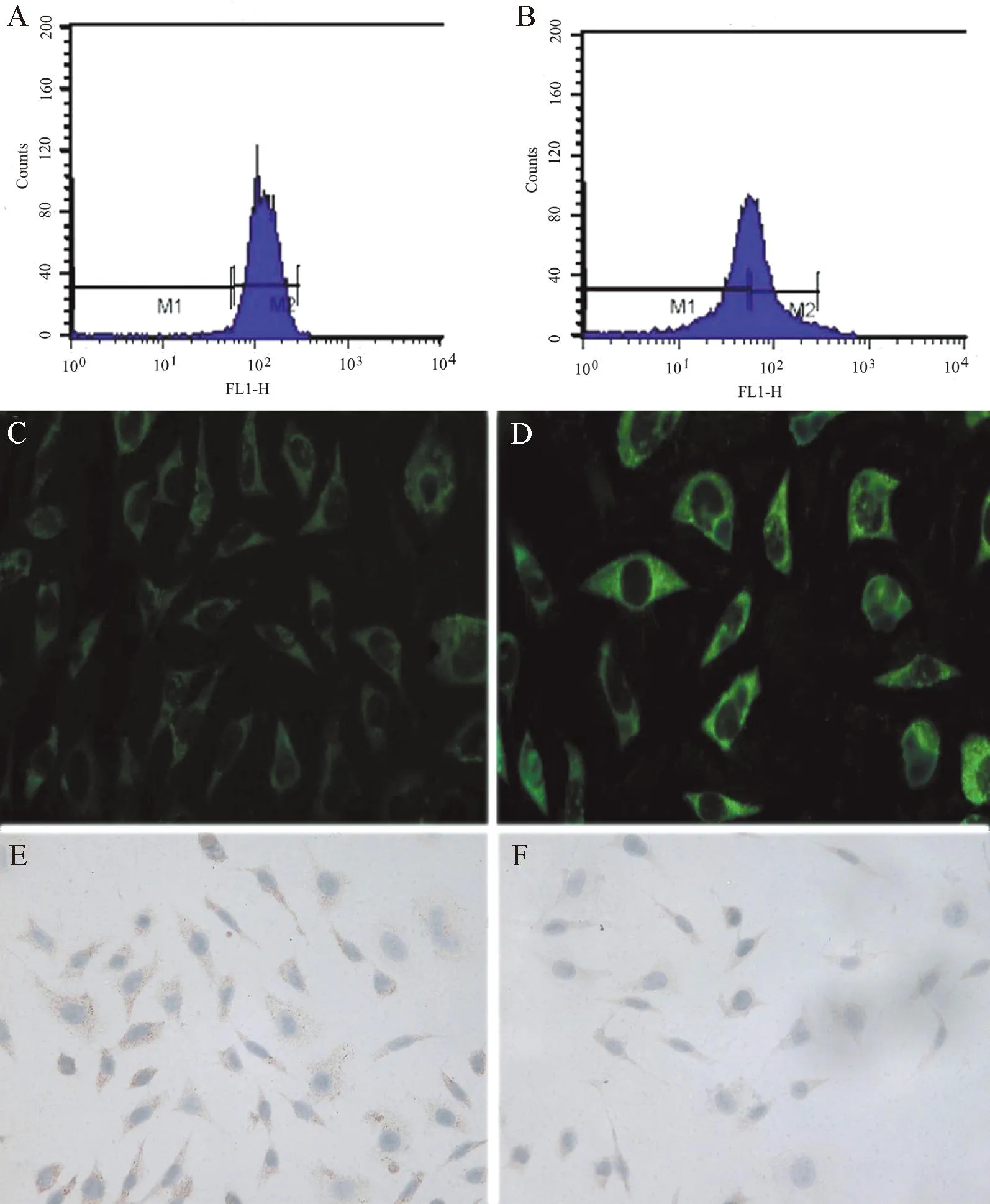
图1 流式细胞技术、原位免疫荧光法及免疫组化染色法检测结果
A:流式细胞技术检测图,可见对照组的ROS峰值在102处;B:流式细胞技术检测图,可见实验组的ROS峰值在102左侧,出现了左移;C:原位免疫荧光检测图,实验组细胞内可见绿色荧光,强度较弱;D:原位免疫荧光检测图,对照组细胞内可见较亮绿色荧光,强度较强;E:免疫组化染色法检测图,可见对照组胞质中有多量棕黄色颗粒,且颜色较深;F: 免疫组化染色法检测图,可见实验组胞质中有少量被染色的棕黄色颗粒
四、蛋白免疫印迹法检测结果
实验组与对照组内参β-actin蛋白条带亮度大致相同,提示实验组与对照组均存在TH蛋白的表达,但实验组泳道出现的蛋白条带与对照组相比颜色较浅。经IPP图像分析系统分析(重复3次实验后取均值),实验组、对照组与β-actin的灰度值之比分别为1.692±0.02、0.553±0.03,两者比较差异有统计学意义(t=126.6,P<0.05),提示β-synuclein抑制TH的表达(图2)。
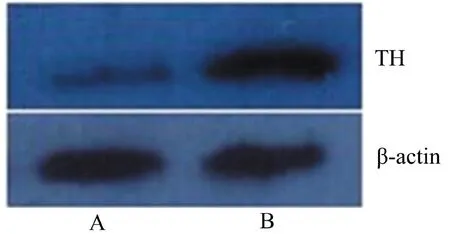
图2 蛋白免疫印迹法检测结果
A:可见实验组TH条带和内参β-actin相比颜色较浅;B:可见对照组TH条带和内参β-actin相比亮度几乎无异
讨论
帕金森病是常见的神经退行性疾病,临床表现为静止性震颤、肌强直、运动迟缓和姿势不稳等。帕金森病的特点是中脑黑质致密部多巴胺能神经元逐渐丧失和细胞内存在包涵体,即路易小体。α-synuclein是一种前突触蛋白,大脑含量丰富。α-synuclein可能通过不同作用机制引起氧化应激损伤, 同时氧化应激条件也能影响α-synuclein的代谢, α-synuclein在帕金森病的发病过程中起重要作用[4]。有研究表明,α-synuclein的表达在某种程度上会影响多巴胺的合成,而α-synuclein与多巴胺合成途径中蛋白产生异常相互作用可能会干扰细胞[5]。另有动物实验表明,帕金森病基因α-synuclein的过表达对秀丽线虫具有明显的毒性作用, α-synuclein转基因线虫的寿命明显缩短、运动能力显著下降,于热休克条件下其存活能力减弱[6]。显然α-synuclein在帕金森病以及其他神经退行性疾病的发病过程中扮演了重要的角色。
TH是多巴胺生物合成途径的关键酶,酪氨酸在TH催化下生成左旋多巴,再经芳香族氨基酸脱羧酶作用生成多巴胺。在多巴胺合成循环过程中发挥了关键调控作用。该酶在生物体内,尤其是在人脑黑质纹状体系统中,其质和量的变化会直接影响多巴胺的生物合成。有研究表明,TH表达的衰减和α-synuclein表达的升高是与帕金森病发病密切相关的生化事件[7]。另有研究提出α-synuclein作为一种反式作用因子,可能具有影响TH基因启动子的功能,对多巴胺代谢有负性调控作用[8]。β-synuclein作为synucleins的家族成员之一,同样主要分布在中枢神经系统突触前末梢,与α-synuclein存在很高的序列同源性。有学者发现,共同培养α-synuclein和β-synuclein,由这2种蛋白直接结合成的另一种蛋白,能降低α-synuclein原纤维的聚集,并改善α-synuclein引起的的神经组织退化,因此其推断β-synuclein可能对神经元细胞具有保护作用[9]。
本研究结果显示,流式细胞技术检测到实验组的ROS峰值较对照组左移,提示β-synuclein能抑制细胞内ROS的表达,说明β-synuclein具有神经保护作用。原位免疫荧光、免疫组化染色法及蛋白免疫印迹法检测结果均显示:TH在实验组中的表达水平较对照组低,提示β-synuclein可能与TH存在直接相互作用并抑制该蛋白的表达。鉴于以上结果,我们提出假设,β-synuclein可能通过调节TH的表达,参与中枢神经系统多巴胺的代谢过程,抑制多巴胺的合成,进而减少ROS对神经细胞的损害,起神经保护作用。
参考文献
[1]Luk KC, Kehm V, Carroll J, Zhang B, O’Brien P, Trojanowski JQ, Lee VM. Pathological α-synuclein? Transmission initiates?Parkinson-like neurodegeneration in nontransgenic mice. Science,2012,338(6109):949-953.
[2]Yu S, Zuo X, Li Y, Zhang C, Zhou M, Zhang YA, Uéda K, Chan P. Inhibition of tyrosine hydroxylase expression in alpha-synuclein-transfected dopaminergic neuronalcells. Neurosci Lett, 2004, 367(1): 34-39.
[3]Lee D, Paik SR, Choi KY. Beta-synuclein exhibits chaperone activity more efficiently than alpha-synuclein.FEBS Letters,2004,576(1-2):256-260.
[4]沈原,赵永波,刘功禄,赵圣杰. α-突触核蛋白的表达与氧化应激水平的相互影响.中国神经免疫学和神经病学杂志, 2011,18(3):177.
[5]Ozansoy M, Basak AN. The central theme of Parkinson’s disease: α-synuclein. Mol Neurobiol, 2013,47(2):460-465.
[6]孙亚奇,卢锡林,苏凤娟,龙思梅,梁凤银,郭文苑,孙喜翠,黄颐,裴中,钟翎. 帕金森病基因α-Synuclein过表达对秀丽隐杆线虫毒性作用的研究.新医学,2013, 44(4): 273-277.
[7]Marwarha G, Rhen T, Schommer T, Ghribi O. The oxysterol 27-hydroxycholesterol regulates α-synuclein and tyrosine hydroxylase expression levels in human neuroblastoma cells through modulation of liver X receptors and estrogen receptors-Relevance to Parkinson’s disease. J Neurochem, 2011, 119(5): 1119-1136.
[8]Gao N, Li YH, Li X, Yu S, Fu GL, Chen B. Effect of α-synuclein on the promoter activity of tyrosine hydroxylase gene. Neuroscience Bulletin, 2007, 23(1): 53-57.
[9]Vigneswara V, Cass S, Wayne D, Bolt EL, Ray DE, Carter WG. Molecular Ageing of Alpha- and Beta-Synucleins: Protein Damage and Repair Mechanisms. PloS One,2013,8(4):e61442.
(本文编辑:洪悦民)
临床研究论著
