甲磺酸达比加群酯杂质的合成*
2016-01-17宗新杰陈会慧刘长鹰王松会徐为人天津医科大学研究生院天津00070天津中医药大学研究生院天津0019天津药物研究院有限公司天津市新药设计与发现重点实验室天津0019
高 航,宗新杰,陈会慧,刘长鹰,王松会,李 川,徐为人(1.天津医科大学研究生院,天津 00070; 2.天津中医药大学研究生院,天津 0019; .天津药物研究院有限公司天津市新药设计与发现重点实验室,天津 0019)
甲磺酸达比加群酯杂质的合成*
高航1,3,宗新杰2,3,陈会慧3,刘长鹰3,王松会3,李川3,徐为人3
(1.天津医科大学研究生院,天津300070; 2.天津中医药大学研究生院,天津300193; 3.天津药物研究院有限公司天津市新药设计与发现重点实验室,天津300193)
摘要:根据甲磺酸达比加群酯工艺,合成了甲磺酸达比加群酯的7个杂质:3-【【【2-{[(4-氰基苯基)氨基]甲基}-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸(A),3-【【【2-【{[4-(乙氧基)叔胺基]苯基}氨基】甲基】-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸乙酯盐酸盐(B),3-【【【2-【{[(4-甲脒基)苯基]氨基}甲基】-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸乙酯盐酸盐(C),3-【【【2-【【【4-{[(己氧基)羰基]氨基亚甲胺基}苯基】氨基】甲基】-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸甲酯盐酸盐(D),3-【【【2-【【【4-【{[(己氧基)羰基]氨基}羰基】苯基】氨基】甲基】-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸乙酯(E),3-【【【2-【【【4-【{[(己氧基)羰基]氨基}亚氨甲基】苯基】氨基】甲基】-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸(F),(Z)-3-【【【2-【【【4-【{[(N,N'-二己氧基)羰基]脒基}亚氨甲基】苯基】氨基】甲基】-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸乙酯(G),其结构经1H NMR和ESI-MS确证。
关键词:甲磺酸达比加群酯;杂质;合成;质量控制
甲磺酸达比加群酯,商品名为泰毕全,化学名为3-【【【2-【【【4-【{[(己氧基)羰基]氨基}亚氨甲基】苯基】氨基】甲基】-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸乙酯甲磺酸盐,是由德国勃林格殷格翰公司研发的新型凝血酶抑制剂。首先于2008年4月在英国和德国上市,美国食品药品监督局(FDA)在2010年批准其用于非瓣膜性房颤患者的全身栓塞和卒中预防。2013 年3月获中国食品药品监督管理局(CFDA)注册证,现已成为中国房颤患者在预防全身性栓塞和卒中的新选择[1-3]。
文献[4-6]用{[(3-氨基-4-甲胺基)苯基]羰基}(吡啶-2-基)氨基]-丙酸乙酯(2)与N-(4-氰基苯基)氨基乙酸(3)反应制得制得3-【【【2-{[(4-氰基苯基)氨基]甲基}-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸乙酯(4); 4在ZnCl2催化下与盐酸-乙醇溶液(由乙酰氯和乙醇制得)反应制得3-【【【2-【{[4-(乙氧基亚胺基)苯基]氨基}甲基】-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸乙酯(5); 5与NH3·H2O/HCl溶液反应制得3-【【【2-{[(4-脒基苯基)氨基]甲基}-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸乙酯盐酸盐(6);以K2CO3为缚酸剂,6与氯甲酸正己酯反应合成达比加群酯(1),再与甲磺酸成盐制得终产物达比加群酯甲磺酸盐(1·MeSO3H,Scheme 1)。
根据1·MeSO3H的结构和合成工艺,推测该路线合成的产品中可能含有如下几种杂质:3-【【【2-{[(4-氰基苯基)氨基]甲基}-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸(A),3-【【【2-【{[4-(乙氧基)叔胺基]苯基}氨基】甲基】-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸乙酯盐酸盐(B),3-【【【2-【{[(4-甲脒基)苯基]氨基}甲基】-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸乙酯盐酸盐(C),3-【【【2-【【【4-{[(己氧基)羰基]氨基亚甲胺基}苯基】氨基】甲基】-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸甲酯盐酸盐(D),3-【【【2-【【【4-{[(己氧基)羰基]氨基}羰基】苯基】氨基】甲基】-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸乙酯(E),3-【【【2-【【【4-【{[(己氧基)羰基]氨基}亚氨甲基】苯基】氨基】甲基】-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸(F),(Z)-3-【【【2-【【【4-【{[(N,N'-二己氧基)羰基]脒基}亚氨甲基】苯基】氨基】甲基】-1-甲基-1H-苯并咪唑-5-基】羰基】(吡啶-2-基)氨基】丙酸乙酯(G)。本文根据甲磺酸达比加群酯工艺合成了A~G,其结构经1H NMR和ESI-MS确证。
A来源:由2和3经闭环反应后处理过程中水解脱去乙基生成,并参与后续反应。使用纯度较低的起始原料4也可能带来杂质A。合成方法:以4水解制得(Scheme 2)。
B和C来源:在亚胺酯中间体5生成6时乙醇过量引起亚氨酯分解,生成乙酸酯杂质B;以及氨水中残存甲胺生成杂质C。合成方法:以4为起始原料,生成亚胺酯中间体5后,分别用碳酸铵和甲胺水溶液制得B和C(Scheme 2)。
D来源:由4合成6时所用乙醇中残留的甲醇或起始原料4中的残存。在反应时过程中,与主结构的乙酯基发生酯交换所产生。合成方法:4在氯化锌催化下与氯化氢甲醇溶液(由乙酰氯和甲醇反应制备)反应生成相应的亚胺酯化合物,并进一步转化成脒化合物,最后酯化制得(Scheme 2)。
E和F来源:1的降解产物和水解产物,其中,前者在1制备甲磺酸盐的酸性环境下产生,后者于6制备1的碱性环境中产生。合成方法[7-8]:6与甲磺酸盐成盐后在水中50℃反应72 h得到E; 1在强碱中水解制得F(Scheme 3)。
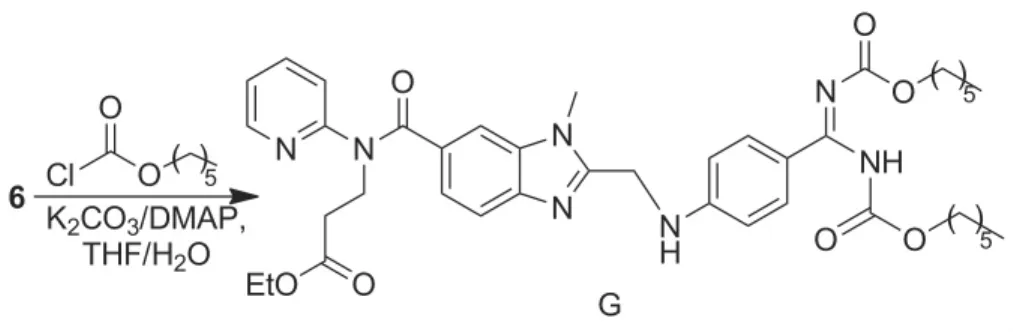
G来源:1和过量氯甲酸正己酯反应的产物。合成方法:氯甲酸正己酯在缚酸剂DMAP的作用下与1反应制得(Scheme 4)。
1 实验部分
1.1仪器与试剂

Scheme 1

Scheme 2

Scheme 3
Scheme 4
YRT-3型熔点仪(温度未校正); Bruker-AVANCE 400MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标); Finnigan LCQ Advantage Max型质谱仪; Waters e2695-2998型高效液相色谱仪(PDA检测器,色谱柱Symmetry C185 μm,检测波长220 nm,流速1.0 mL·min-1)。
4(99.65%)和氯甲酸正己酯(99.25%),上海同昌生物医药科技有限公司;其余所用试剂均为分析纯。
1.2合成
(1)A的合成
在反应瓶中加入4 5.0 g(10.4 mmol)及THF 80 mL,于30℃搅拌使其溶解;缓慢滴加0.16 mol·L-1氢氧化钠溶液(100 mL),滴毕,于室温反应3 h。减压蒸除溶剂,加水50 mL,用1 mol·L-1盐酸中和至pH 5,于室温搅拌2 h,抽滤得淡黄色固体,用二氯甲烷(40 mL)与甲醇(40 mL)溶解,搅拌0.5 h,过滤,滤液减压蒸除溶剂,用丙酮(40 mL)重结晶得白色固体A 2.8 g,收率59.5%,纯度99.1%,m.p.155℃~156℃;1H NMR δ:2.61(t,J=7.2 Hz,3H,CH2),3.74(s,3H,NCH3),4.17(t,J=8.0 Hz,2H,NCH2),4.59(d,J=5.6 Hz,2H,NHCH2),6.82(d,J=8.8 Hz,2H,ArH),6.95(d,J=8.0 Hz,1H,ArH),7.12(m,1H,PyH),7.15~7.18(m,1H,PyH),7.24(t,J=5.2 Hz,1H,PyH),7.39(d,J=8.4 Hz,1H,ArH),7.46(d,J=8.8 Hz,3H,ArH),7.56~7.58(m,1H,PyH),8.36~8.38(m,1H,NH),12.24(br s,1H,CO2H); ESI-MS m/z:455{[M + H]+}。
(2)B的合成
向反应瓶中加入无水乙醇34.3 mL,于0℃~10℃搅拌下缓慢滴加乙酰氯24.0 mL(0.3 mol),滴毕,反应2 h;加入4 2.0 g(4.1 mmol),加毕,加入无水氯化锌0.2 g(1.7 mmol),加毕,于20℃~30℃反应12 h。减压蒸除溶剂,加入无水乙醇26 mL,搅拌至均匀,加入碳酸铵5.9 g(62.1 mmol),加毕,于室温搅拌10 h,减压蒸除溶剂,加入乙酸乙酯(20 mL)和蒸馏水(20 mL),搅拌均匀后加入1 mol·L-1盐酸(50 mL),继续于室温搅拌4 h,抽滤,滤饼干燥得白色固体B 1.5 g,收率68.4%,纯度98.3%,m.p.202℃~203℃;1H NMR δ:1.12(t,J=7.2 Hz,3H,CH3),1.45(t,J=7.2 Hz,3H,CH3),2.68(t,J=7.2 Hz,3H,CH2),3.76(s,3H,NCH3),3.97~3.99(m,2H,CH2),4.22(t,J=6.8 Hz,2H,CH2),4.51~4.53(m,2H,CH2),4.70(d,J=4.4 Hz,2H,CH2),5.71(s,1H,CH),6.88~6.90(m,3H,ArH),7.05(s,1H,PyH),7.10(t,J=7.2 Hz,1H,NH),7.14~7.16(m,1H,PyH),7.35~7.36(m,1H,ArH),7.45~7.48(m,1H,ArH),7.51(s,1H,HCl),7.52~7.54(m,1H,PyH),7.61(d,J=8.5 Hz,2H,ArH),7.86(t, J=3.2 Hz,1H,ArH),8.36(d,J=3.2 Hz,1H,PyH),10.33(br s,1H,NH2),10.98(br s,1H,NH2); ESI-MS m/z:531{[M + H]+}。
(3)C的合成
在反应瓶中加入无水乙醇34.3 mL(0.6 mol),搅拌下于0℃~10℃缓慢滴加乙酰氯24.0 mL(0.3 mol),滴毕,反应2 h。于室温(20℃~30 ℃)加入4 2.0 g(4.1 mmol),加入无水氯化锌0.2 g(1.7 mmol),加毕,于20℃~30℃反应12 h。减压蒸除溶剂。加入无水乙醇26 mL,搅拌至均匀,加入40%甲胺水溶液9 mL,于室温搅拌10 h。减压蒸除溶剂,加入乙酸乙酯20 mL和蒸馏水20 mL,搅拌至均匀,加入1 mol·L-1盐酸15 mL,于室温反应4 h。抽滤,滤饼干燥得白色固体C 1.6 g,收率70.5%,纯度98.0%,m.p.204.5℃~205.5℃;1H NMR δ:1.11(t,J=7.2 Hz,3H,CH3),2.66(t,J=7.2 Hz,2H,CH2),2.93(d,J=7.2 Hz,3H,CH3),3.75(s,3H,NCH3),3.96(dd,J=8.6 Hz,7.2 Hz,2H,NCH2),4.21(t,J=7.2 Hz,2H,OCH2),4.63(d,J=8.4 Hz,2H,NCH2),6.87(d,J=8.5 Hz,2H,ArH),6.87~6.89(m,1H,ArH),7.09~7.15(m,1H,PyH),7.14~7.16(m,1H,PyH),7.35~7.37(m,1H,ArH),7.45~7.47(m,1H,ArH),7.51(s,1H,HCl),7.52~7.54(m,1H,PyH),7.61(d,J=8.5 Hz,2H,ArH),8.36(d,J=3.2 Hz,1H,PyH),8.48(br s,1H,PyH),9.00(br s,1H,NH),9.30(br s,1H,NH); ESIMS m/z:514{[M + H]+}。
(4)D的合成
在反应瓶中加入无水甲醇34.3 mL,搅拌下于0℃~10℃缓慢滴加乙酰氯24.0 mL(0.3 mol),加毕,反应2 h;于室温加入4 2.0 g(4.1 mmol),加入无水氯化锌0.2 g(1.7 mmol),加毕,继续于20℃~30℃反应搅拌12 h。减压蒸除溶剂,加入无水甲醇26 mL,搅拌至均匀,加入氨水9 mL,于室温反应10 h。减压蒸除溶剂,加入乙酸乙酯20 mL和蒸馏水20 mL,搅拌至均匀,用1 mol·L-1盐酸调至pH 5,反应8 h。抽滤,滤饼干燥得白色固体1.5 g。加至THF(30 mL)和去离子水(6 mL)混合溶剂中,加入碳酸钾2.4 g(1.8 mmol),搅拌15 min,于室温缓慢滴加氯甲酸正己酯0.6 g(3.6 mmol),滴毕,反应1 h。加入水24mL,搅拌至均匀,减压蒸除THF,加入乙酸乙酯(15 mL),于室温反应24 h。抽滤,滤饼干燥白色固体,加入乙酸乙酯30 mL,搅拌2 h,抽滤,滤饼干燥得白色固体D 1.0 g,收率39.5%,纯度98.0%,m.p.111℃~112℃;1H NMR δ:0.86(t,J=9.0 Hz,3H,CH3),1.09(t,J=8.5 Hz,3H,CH3),1.27~1.38(m,8H,CH2),2.67(t,J=14.5 Hz,2H,CH2CO),3.75(s,3H,CH3N),3.93~3.99(m,2H,CH2O),4.21(t,J=14.0 Hz,2H,CH2),4.58(d,2H,J=5.5 Hz,CH2N),6.75(d,J=8.5 Hz,2H,ArH),6.87(d,J=7.5 Hz,1H,ArH),6.93(t,1H,NH),7.09~7.16(m,2H,PyH),7.38(d,J=8.5 Hz,1H,ArH),7.46(d,J=1.5 Hz,1H,ArH),7.52~7.55(m,1H,PyH),7.78(d,J=8.5 Hz,2H,ArH),8.37~8.38(m,1H,PyH),8.90(br s,2H,NH2); ESI-MS m/z:614{[M +H]+}。
(5)E的合成
向反应瓶中加入1·MeSO3H 2.0 g(2.8 mmol),去离子水(15 mL),60℃加热搅拌72 h,冷却至室温,抽滤得白色固体。将所得固体烘干后经层析柱纯化(洗脱剂:二氯甲烷/甲醇=30/1),得白色固体1.1 g,收率61.3%,纯度99.5%,m.p.110℃~111℃;1H NMR δ:0.85(t,J=9.0 Hz,3H,CH3),1.11(t,J=8.5 Hz,3H,CH3),1.27~1.38(m,8H,CH2),2.67(t,J=14.5 Hz,2H,CH2CO),3.75(s,3H,CH3N),3.93~3.99(m,4H,CH2O),4.21(t,J=14.0 Hz,2H,CH2),4.58(d,J=5.5 Hz,2H,CH2N),6.75(d,J=8.5 Hz,2H,ArH),6.86(d,J=7.5 Hz,1H,ArH),6.9(t,1H,NH),7.09~7.16(m,2H,PyH),7.37(d,J=8.5 Hz,1H,ArH),7.46(d,J=1.5 Hz,1H,ArH),7.52~7.55(m,1H,PyH),7.77(d,J=8.5 Hz,2H,ArH),8.37~8.38(m,1H,PyH); ESI-MS m/z:629{[M +H]+}。
(6)F的合成
将1 10 g(15.9 mmol)溶于四氢呋喃(320 mL)中,搅拌下滴加0.14 mol·L-1氢氧化钠溶液(400 mL),常温搅拌4 h,减压浓缩反应液,加入蒸馏水(200 mL),搅拌下用1 mol·L-1HCl溶液调溶液pH 6,搅拌1 h后抽滤,得白色固体。将白色固体溶于二氯甲烷(140 mL)和甲醇(140 mL)的混合溶剂中,抽滤去除不溶物得澄清滤液,将滤液减压蒸除溶剂并后加入丙酮(200 mL)结晶,抽滤得淡黄色固体8.6 g,收率90.0%,纯度99.4%,m.p.189℃~190℃;1H NMR δ:0.84(t,J=9.0 Hz,3H,CH3),1.28~1.38(m,8H,CH2),2.65(t,J=14.5 Hz,2H,CH2CO),3.75(s,3H,CH3N),3.93(t,J=7.2 Hz,2H,CH2O),4.19(t,J=14.0 Hz,2H,CH2),4.57(d,J=5.5 Hz,2H,CH2N),6.74(d,J=8.5 Hz,2H,ArH),6.86(d,J=7.5 Hz,1H,ArH),6.91(t,1H,NH),7.09~7.16(m,2H,PyH),7.37(d,J=8.5 Hz,1H,ArH),7.46(d,J=1.5 Hz,1H,ArH),7.52~7.55(m,1H,PyH),7.77(d,J=8.5 Hz,2H,ArH),8.37~8.38(m,1H,PyH),8.90(br s,2H,NH2),12.35(br s,1H,CO2H); ESI-MS m/z:600{[M + H]+}。
(7)G的合成
向反应瓶中加入1 5.0 g(8.0 mmol)和二氯甲烷(100 mL),搅拌至固体溶解后加入DMAP 2.0 g(16.3 mmol),搅拌10 min,滴加氯甲酸正己酯2 g(12.2 mmol),滴毕,于40℃反应5 h。加入0.2 mol·L-1HCl溶液(30 mL),分液,有机相用二氯甲烷(3×100 mL)萃取,合并萃取液,减压浓缩得红色油状物,用甲基叔丁基醚(30 mL)重结晶得黄色固体2.8 g,收率39.7%,纯度98.2%,m.p.102.1℃~102.4℃;1H NMR δ:0.82~0.87(m,6H,CH3),1.09(t,J=8.5 Hz,3H,CH3),1.24~1.32(m,12H,CH2),1.51~1.58(m,4H,CH2),2.65(t,J=14.5 Hz,2H,CH2CO),3.75(s,3H,NCH3),3.93~3.99(m,4H,CH2O),4.19(t,J=14.0 Hz,2H,CH2),4.57(d,J=5.5 Hz,2H,CH2N),6.74(d,J=8.5 Hz,2H,ArH),6.86(d,J=7.5 Hz,1H,ArH),6.91(t,J=14.5 Hz,1H,NH),7.09~7.16(m,2H,PyH),7.37(d,J=8.5 Hz,1H,ArH),7.46(d,J=1.5 Hz,1H,ArH),7.52~7.55(m,1H,PyH),7.77(d,J=8.5 Hz,2H,ArH),8.37~8.38(m,1H,PyH),8.90(br s,2H,NH2); ESI-MS m/z:756{[M + H]+}。
2 结果与讨论
探讨了甲磺酸达比加群酯7种杂质产生的原因,并以市售4为主要原料,经水解、脒化及酰化等反应合成了上述杂质。其中杂质D采用自制HCl-MeOH溶液制备,避免文献[8]中采用向甲醇中通入HCl及NH3气体的繁杂操作,经济环保;杂质E和F改进了后处理及纯化方式,使得纯度进一步提高;杂质A,B,C和G为首次报道并成功合成。所有杂质纯度均在98%以上,可作为质量研究的对照品使用,为甲磺酸达比加群酯生产工艺和储存条件的改进提供了重要依据。
参考文献
[1]Blech S,Ebner T,Ludwing-Schwellinger E,et al.
The metabolism and disposition of the oral direct
thrombin inhibitor,dabigatran,in hunman[J].Drug
Metabolism and Disposition,2008,36(2):386-399.
[2]魏永燕,汤日波.达比加群酯在心房颤动抗凝治疗中的研究进展[J].实用医学杂志,2013,29(5):683-685.
[3]宫平,贾薇.新型口服抗凝血药物达比加群酯[J].世界临床药物,2009,29(9):544-547.
[4]朱津津,樊士勇,仲伯华.达比加群酯的合成[J].中国药物化学,2012,22(3):204-208.
[5]程青芳,王启发,陆微,等.达比加群酯的合成[J].中国医药工业,2012,43(12):961-964.
[6]高航,宗新杰,刘长鹰,等.达比加群酯的合成工艺研究[J].现代药物与临床,2014,29(12):1331-1333.
[7]Serra M J,Duran L E,Rao L.Dabigatran etexilate and related substances,processes and compositons and use of the substances as reference standards and markers[P].WO 2 012 152 855,2012.
[8]顾红蕾,吴泰志,金林勇,等.达比加群酯有关物质的合成[J].中国医药工业杂志,2015,46(4):
·综合评述·
Synthesis of the Impurities of Dabigatran Etexilate Mesylate
GAO Hang1,3,ZONG Xin-jie2,3,CHEN Hui-hui3,
LIU Chang-ying3,WANG Song-hui3,LI Chuan3,XU Wei-ren3
(1.Graduate school,Tianjin Medical University,Tianjin 300070,China; 2.Graduate school,
Tianjin University of Chinese Traditional Medicine,Tianjin 300193,China; 3.Tianjin Key Laboratory of Molecular
Design and Drug Discovery,Tianjin Institute of Pharmaceutical Research Co.,Ltd,Tianjin 300193,China)
Abstract:According to the synthetic route of dabigatran exetilate mesylate,seven kinds of impurities were synthesized:3-【【【2-{[(4-cyanophenyl)amino]methyl}-1-methyl-1H-benzimidazol-5-yl】carbonyl】pyridin-2-ylamino】propionic acid(A),ethyl 3-【【【2-【{[4-(ethoxy)tertiary amine]phenyl} amino】methyl】-1-methyl-1H-benzimidazol-5-yl]carbonyl】pyridin-2-ylamino】propanoate hydrochlorid(B),ethyl 3-【【【2-【{[(4-N'-methylcarbamimidoyl)phenyl]amino} methyl】-1-methyl-1H-benzimidazol-5-yl】carbonyl】pyridin-2-ylamino】propanoate hydrochlorid(C),methyl 3-【【【2-【【【4-{[(hexyloxy)carbonyl]carbamimidoyl} phenyl】amino】methyl】-1-methyl-1H-benzimidazol-5-yl】carbonyl】(pyridin-2-yl)amino】propanoate hydrochlorid(D),ethyl 3-【【【2-【【【4-【{[(hexyloxy)carbonyl]amino} carbonyl】phenyl】amino】methyl】-1-methyl-1H-benzimidazol-5-yl】carbonyl】(pyridin-2-yl)amino】propanoate(E),3-【【【2-【【【4-{[(hexyloxy)carbonyl]carbamimidoyl} phenyl】amino】
methyl】-1-methyl-1H-benzimidazol-5-yl】-carbonyl】(pyridin-2-yl)amino】propanoic acid(F),ethyl(Z)-3-【【【2-【【【4-{[(N,N'-bishexyloxy)carbonyl]carbamimidoyl} phenyl】amino】methyl】-1-methyl-1H-benzimidazol-5-yl】carbonyl】(pyridin-2-yl)amino】propanoate(G).The structures were confirmed by1H NMR and ESI-MS.
Keywords:dabigatran etexilate mesylate; impurity; synthesis; quality control
作者简介:高航(1990-),男,汉族,河北石家庄人,硕士研究生,主要从事药物合成研发。Tel.022-23006905,E-mail:albertgh@ sina.com
收稿日期:2015-06-24
DOI:10.15952/j.cnki.cjsc.1005-1511.2015.11.1068 *
文献标识码:A
中图分类号:O621.3; R914.5
通信联系人:刘长鹰,工程师,Tel.022-23006870,E-mail:liucy@ tjipr.com
