新型含游离羟基鱼藤素衍生物的合成及其抗肿瘤活性*
2016-01-17姜志辉周杏子吴新荣华南理工大学轻工与食品学院广东广州510641广州军区广州总医院药学部广东广州510010
何 海,姜志辉,周杏子,贺 胜,吴新荣(1.华南理工大学轻工与食品学院,广东广州 510641; .广州军区广州总医院药学部,广东广州 510010)
新型含游离羟基鱼藤素衍生物的合成及其抗肿瘤活性*
何海1,2,姜志辉2,周杏子1,2,贺胜2,吴新荣2
(1.华南理工大学轻工与食品学院,广东广州510641; 2.广州军区广州总医院药学部,广东广州510010)
摘要:以鱼藤酮为原料经3步反应合成鱼藤素;鱼藤素分别经三溴化硼脱甲基和硼氢化钠还原合成了4个新型含游离羟基的鱼藤素衍生物(3a~3c和4),其结构经1H NMR,13C NMR和LC-MS表征。初步的抗肿瘤活性测定结果表明,12-羟基鱼藤素(4)对人乳腺癌细胞MCF-7和人肺癌细胞H299的抑制活性较好,其IC50分别为0.11 μmol·L-1和0.01 μmol·L-1,优于阳性对照药Deguelin。
关键词:鱼藤酮;鱼藤素衍生物;合成;抗肿瘤活性
hotmail.com
通信联系人:吴新荣,主任药师,Tel.020-36653476,E-mail:gzwxrong@ yahoo.com
鱼藤素(Deguelin)是一类鱼藤酮类化合物,是从三叶鱼藤龙眼属或绢毛萌豆(豆科)中分离出来的天然化合物[1],为黄色结晶体。Deguelin已被研究作为延缓癌症发作的潜在化学预防和化疗药物[2-3],研究表明其在体内外能明显抑制几种类型的肿瘤,包括肺癌、胃癌、乳腺癌、结肠癌和直肠癌等[4-8]。由于其天然、高效及低毒的优点,一直受到研究人员的青睐,其分子本身含有抗菌、抗肿瘤、抗病毒及抗氧化等活性的苯并呋喃和苯并吡喃结构,是一种很有开发潜力的先导化合物。但从分子结构来看,Deguelin没有游离的可连接其它化合物的基团,故无法在后期的研究中连接上其他具有活性的化合物,例如具有杀虫、杀菌、抗真菌、抗病毒等生物活性的肟醚和腙类化合物,以及多肽和生物素等,阻碍了对Deguelin的进一步研究。

Scheme 1
鉴于此,本文拟设计并合成保留Deguelin母体结构的含有游离羟基的衍生物。因Deguelin价格昂贵,故以价格低廉的(-)-鱼藤酮为原料,经三步反应合成(-)-Deguelin[9-10]; Deguelin经三溴化硼脱甲基化合成了新型含游离羟基的Deguelin衍生物——2-羟基-Deguelin(3a),3-羟基-Deguelin(3b)和2,3-二羟基-Deguelin(3c)[11];用硼氢化钠将Deguelin中的酮羰基还原为羟基合成了新的Deguelin衍生物——12-羟基-Deguelin(4)[12](Scheme 1),其结构经1H NMR,13C NMR 和LC-MS表征。并初步研究了其抗肿瘤活性。
1 实验部分
1.1仪器与试剂
AVANCEⅢHD 600型核磁共振仪(CDCl3为溶剂,TMS为内标); Agilent HPLC-6400系列三级四极杆液质联用仪; ELX800型酶标仪。
薄层色谱用硅胶GF254(60型),山东烟台江友硅胶开发有限公司;柱色谱用硅胶(200目~300目),青岛海洋化工集团公司;其余所用试剂均为分析纯,上海Aladdin公司。
1.2合成
(1)1的合成
在反应瓶中依次加入二氯甲烷10.0 mL和鱼藤酮4.0 g(10.2 mmol),搅拌使其溶解;于-5℃缓慢滴加BBr32.6 g(10.2 mmol)的二氯甲烷(10.2 mL)溶液,滴毕,于-5℃反应10 min(TLC检测),减压蒸除溶剂,用甲醇(20 mL)洗涤,过滤,滤饼干燥得棕色固体1 3.1 g,收率64%,直接进行下步反应。
(2)2的合成
在反应瓶中加入六甲基膦酰三胺(HMPA)32 mL和1 3.0 g(6.3 mmol),搅拌使其溶解;加入NaBH3CN 1.60 g(25.4 mmol),于80℃反应3 h。加入冰水,用混合溶剂[V(乙醚)∶V(正己烷)=3∶1]萃取,合并萃取液,依次用饱和食盐水洗涤,无水NaSO4干燥,减压浓缩得黄色粉末,经硅胶柱层析[洗脱剂:A=V(乙酸乙酯)∶V(石油醚)=1∶3]纯化得淡黄色固体2 1.6 g,收率60%,m.p.193℃~195℃;1H NMR δ:7.74(d,J=8.7 Hz,1H),6.76(s,1H),6.50(d,J=8.7 Hz,1H),6.41(s,1H),6.00(s,1H),5.19(m,1H),4.87(t,J=3.0 Hz,1H),4.60(dd,J=11.9 Hz,3.1 Hz,1H),4.14(d,J=11.9 Hz,1H),3.80(m,1H),3.75(s,3H),3.70(s,3H),3.34(m 2H),1.74(s,3H),1.65(s,3H);13C NMR δ:190.4,162.1,160.1,149.3,147.5,143.6,134.0,126.9,121.1,114.8,112.5,110.7,110.5,108.5,104.7,100.8,72.0,66.2,56.2,55.7,44.1,25.7,22.0,17.7; LC(tR=1.80 min~2.00 min)-MS m/z:397.1{[M + H]+}。
(3)Deguelin的合成
在反应瓶中依次加入二氯甲烷45 mL和2 1.5 g(3.8 mmol),搅拌使其溶解;于-30℃加入PhSeCl 0.79 g(4.1 mmol),反应2 h;于室温反应1 h。减压蒸除溶剂,残留物溶于45 mL THF,于0℃加入30% H2O20.75 mL,加毕,反应过夜。加入乙酸乙酯50 mL,依次用5% NaHCO3溶液和饱和食盐水洗涤,无水Na2SO4干燥,减压浓缩,残余物经快速硅胶柱层析[洗脱剂:A=V(乙酸乙酯)∶V(石油醚)=1∶2]纯化得淡黄色固体Deguelin 0.8 g,收率50%,m.p.85℃~87℃;1H NMR δ:7.72(d,J=8.7 Hz,1H),6.77(s,1H),6.62(d,J=10.0 Hz,1H),6.43(s,1H),6.43(d,J=8.7 Hz,1H),5.53(d,J=10.0 Hz,1H),4.89(m,1H),4.61(dd,J=12.0 Hz,3.1 Hz,1H),4.17(d,J=12.0 Hz,1H),3.82(d,J=4.1 Hz,1H),3.78(s,3H),3.75(s,3H),1.43(s,3H),1.36(s,3H);13C NMR δ:189.2,160.0,156.9,149.4,147.4,143.8,128.6,128.5,115.7,112.7,111.4,110.4,109.1,104.7,100.9,77.6,72.4,66.2,56.3,55.8,44.3,28.4,28.1; LC(tR=1.80 min~3.50 min)-MS m/z:395.1{[M + H]+}。
(4)3a~3c的合成(以3a为例)
在反应瓶中依次加入二氯甲烷7.0 mL和Deguelin 100 mg(0.25 mmol),搅拌使其溶解;于-78℃缓慢滴加BBr30.06 g(0.25 mmol)的二氯甲烷(0.25 mL)溶液,滴毕,反应1 h;于0℃反应30 min。加水5.0 mL终止反应,用二氯甲烷萃取,合并萃取液,依次用饱和食盐水洗涤,无水NaSO4干燥,减压浓缩,残余物经快速硅胶柱层析[梯度洗脱剂:V(乙酸乙酯)∶V(石油醚)∶V(二氯甲烷)=1∶3∶1~1∶2∶1]纯化得淡黄色固体3a 16 mg。
用类似方法合成淡黄色固体3b~3c。
3a:收率16%,m.p.94℃~96℃;1H NMR δ:7.74(d,J=8.7 Hz,1H),6.76(s,1H),6.64(d,J=10.1 Hz,1H),6.50(s,1H),6.45(d,J=8.7 Hz,1H),5.60(d,1H),5.55(d,J=10.1 Hz,1H),4.90(dd,J=3.1 Hz,3.1 Hz,1H),4.62(dd,J=12.1 Hz,3.1 Hz,1H),4.17(d,J=12.1 Hz,1H),3.82(d,J=4.1 Hz,1H),3.77(s,3H),1.45(s,3H),1.38(s,3H);13C NMR δ:189.4,160.1,157.0,147.8,146.1,141.6,128.6,128.5,115.7,112.7,111.4,109.8,109.1,104.6,103.5,77.7,72.4,66.1,56.4,44.4,28.5,28.1; LC(tR=1.70 min~2.00 min)-MS m/z:381.1{[M +H]+}。
3b:收率14%,m.p.116℃~118℃;
1H NMR δ:7.73(d,J=8.7 Hz,1H),6.83(s, 1H),6.63(d,J=10.1 Hz,1H),6.43(d,J=8.7 Hz,1H),6.42(s,1H),5.54(d,J=10.1 Hz,1H),5.29(s,1H),4.89(dd,J=3.0 Hz,3.0 Hz,1H),4.61(dd,J=12.0 Hz,3.1 Hz,1H),4.17(d,J=12.0 Hz,1H),3.80(d,J=6.1 Hz,1H),3.79(s,3H),1.44(s,3H),1.37(s,3H);13C NMR δ:189.0,159.9,156.8,146.9,146.7,140.1,128.6,128.5,115.7,113.1,112.7,111.4,109.0,105.8,100.1,77.6,72.3,66.2,55.8,44.3,28.4,28.1; LC(tR=1.70 min~2.00 min)-MS m/z:381.1{[M + H]+}。
3c:收率33%,m.p.203℃~205℃;
1H NMR δ:7.75(s,1H),7.63(d,J=8.7 Hz,1H),7.38(s,1H),6.59(s,1H),6.58(d,J=10.1 Hz,1H),6.39(d,J=8.7 Hz,1H),6.29(s,1H),5.65(d,J=10.1 Hz,1H),5.03(m,1H),4.55(dd,J=12.2 Hz,2.9 Hz,1H),4.20(d,J=12.2 Hz,1H),3.79(d,J=4.0 Hz,1H),1.38(s,3H),1.30(s,3H);13C NMR δ:190.1,160.8,158.2,148.4,146.9,140.7,130.4,129.3,116.6,114.9,114.2,112.1,110.3,106.2,105.1,78.8,74.0,67.2,45.4,29.0,28.6; LC(tR=1.70 min~2.00 min)-MS m/z:367.1{[M + H]+}。
(5)4的合成
在反应瓶中依次加入甲醇10.0 mL和Deguelin 300 mg(0.76 mmol),搅拌使其溶解;于0℃加入NaBH443 mg(1.13 mmol),反应30 min。用水终止反应,用乙酸乙酯萃取,合并萃取液,依次用饱和食盐水洗涤,无水NaSO4干燥,减压浓缩,残余物经快速硅胶柱层析(洗脱剂:A=1∶1)纯化得白色固体4 300 mg。
4:收率100%,m.p.142℃~144℃;
1H NMR δ:6.99(d,J=8.2 Hz,1H),6.68(s,1H),6.64(d,J=10.0 Hz,1H),6.47(s,1H),6.41(d,J=8.2Hz,1H),5.56(d,J=10.0 Hz,1H),4.80(m,2H),4.57(d,J=10.0 Hz,1H),4.21(m,1H),3.84(s,3H),3.82(s,3H),3.36(t,J=4.9 Hz,1H),1.41(s,3H),1.39(s,3H);13C NMR δ:154.3,149.6,149.4,147.9,143.8,130.0,129.1,116.4,113.6,111.3,109.8,109.5,108.7,100.7,76.0,69.1,66.3,65.0,56.5,55.8,37.9,27.8,27.7; LC(tR=1.30 min~2.00 min)-MS m/z:397.2{[M + H]+}。
1.3抗肿瘤活性测定
采用MTT法测定化合物的抗肿瘤活性。参照文献[13],以Deguelin为对照药,将乳腺癌细胞MCF-7(5×104个/mL)和肺癌细胞H1299(5×104个/mL)培养液接种于96孔板上,在5% CO2,37℃细胞培养箱中培养24 h,加入不同浓度[(0.01,0.1,1,10,100)μmol·L-1]待测化合物,培养72 h。弃去上清液,加入MTT(10 μL/孔,5 mg·mL-1磷酸缓冲盐溶液),培养4 h,加入DMSO 150 μL/孔,以酶标分析仪于570 nm测定各孔OD值。实验重复3次,计算IC50值。
[9]Unai T,Yamamoto I.Synthesis of the stereoisomers of natural rotenone[J].Agric Biol Chem,1973,37:897-901.
[10]Anzeveno P B.Rotenoid interconversion.Synthesis of deguelin from rotenone[J].J Org Chem,1979,44:2578-2580.
[11]José Garcia,Sofia Barluenga,Katarzyna Gorska,et al.Synthesis of deguelin-biotin conjugates and investigation into deguelin's interactions[J].Bioorganic&Medicinal Chemistry,2011,20(2012):672-680.
[12]Chang D J,An H,Kim K S,et al.Design,synthesis,and biological evaluation of novel deguelin-based heat shock protein 90(HSP90)inhibitorstargeting proliferation and angiogenesis[J].J Med Chem,2012,55(24):10863-10884.
[13]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J].J Immunol Methods,1983,65:55-65.
·研究论文·
2 结果与讨论
2.1合成
在Deguelin的合成中,以鱼藤酮为原料于-5℃用BBr3断开,形成溴化合物1; 1在NaBH3CN作用下脱去溴,然后再在PhSeCl和H2O2作用下闭环制得Deguelin。
Deguelin在三溴化硼作用下于-78℃经脱甲基化合成3a~3c; Deguelin于0℃经硼氢化钠作用将酮羰基还原为羟基合成4。
2.2抗肿瘤活性
3和4的抗肿瘤活性筛选结果见表1。
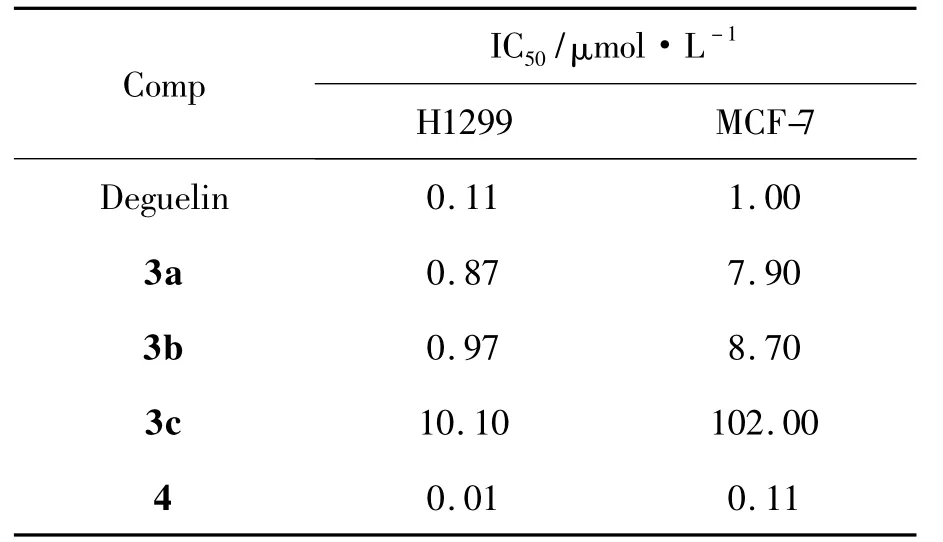
表1 化合物对H1299和MCF-7细胞的IC50Table 1 IC50of target compoundsagainst H1299 and MCF-7 tumor cells
由表1可见,3和4对肿瘤细胞MCF-7和H1299均有一定的增殖抑制活性。与Deguelin相比,4对两种肿瘤细胞抑制活性最为突出,IC50值分别为0.01 μmol·L-1和0.11 μmol·L-1。由此推断Deguelin的活性部位可能在12-位碳上,其构效关系有待进一步研究。
3 结论
设计并合成了四种新型含游离羟基的鱼藤素衍生物,对肿瘤细胞有不同程度的增殖抑制活性,其中,以12-羟基鱼藤素活性最为突出,对肿瘤细胞MCF-7和H1299具有较好的抑制作用,呈现潜在的抗肿瘤活性,可考虑在12-位游离的羟基上加上其他的活性基团,进一步结构优化与深入研究十分必要。
参考文献
[1]Caboni P,Sherer T B,Zhang N.Rotenone,deguelin,their metabolites and the rat model of Parkinson’s disease[J].Chem Res Toxicol,2004,17:1540-1548.
[2]Aggarwal B B,Takada Y,Oommen O V.From chemoprevention to chemotherapy:Common targets and common goals[J].Expert Opin Investig Drugs,2004,13:1327-1338.
[3]Kim W Y,Chang D J,Hennessy B,et al.A novel derivative of the natural agent deguelin for cancer chemoprevention and therapy[J].Cancer Prev Res,2008,7:577-587.
[4]Mehta R,Katta H,Alimirah F,et al.Deguelin action involves c-Met and EGFR signaling pathways in triple negative breast cancer cells[J].PLoS One,2013,8:e65113.
[5]Kang H W,Kim J M,Cha M Y,et al.Deguelin,an Akt inhibitor,down-regulates NF-kappaB signaling and induces apoptosis in colon cancer cells and inhibits tumor growth in mice[J].Dig Dis Sci,2012,57:2873-2882.
[6]Ji B C,Yu C C,Yang S T,et al.Induction of DNA damage by deguelin is mediated through reducing DNA repair genes in human non-small cell lung cancer NCIH460 cells[J].Oncol Rep,2012,27:959-964.
[7]Lee H,Lee J H,Jung K H,et al.Deguelin promotes apoptosis and inhibits angiogenesis of gastric cancer [J].Oncol Rep,2010,24:957-963.
[8]Murillo G,Salti G I,Nd K J,et al.Deguelin inhibits the growth of colon cancer cells through the induction of apoptosis and cell cycle arrest[J].Eur J Cancer,2002,38:2446-2454.
·研究论文·
Synthesis and Antitumor Activities of
Novel Free Hydroxyl-containing Deguelin Derivatives
HE Hai1,2,JIANG Zhi-hui2,ZHOU Xing-zi1,2,HE Sheng2,WU Xin-rong2
(1.School of Light Industry and Food,South China University of Technology,Guangzhou 510641,China;
2.Department of Pharmacy,Genenral Hospital of Guangzhou Military Command of PLA,Guangzhou 510010,China)
Abstract:Deguelin was prepared by three-step reaction from Rotenone.Novel deguelin derivatives containing free hydroxyl groups(3a~3c and 4)were synthesized by boron tribromide demethylation or reduction with sodium cyanoborohydride from deguelin.The structures were characterized by1H NMR,13C NMR and LC-MS.The antitumor activities were investigated.The results showed that 12-hydroxyl deguelin(4)showed the best inhibition activities against MCF-7 and H1299 with IC50of 0.11 μmol·L-1and 0.01 μmol·L-1,respectively,which was better than deguelin.
Keywords:rotenone; deguelin derivative; synthesis; antitumor activity
作者简介:何海(1988-),男,汉族,湖北武汉人,硕士研究生,主要从事糖类药物的合成及生物利用研究。E-mail:scuthehai@
基金项目:广东省重大科技专项[广东医院制剂研究开发技术平台建设(2011A080300004)]
收稿日期:2015-05-27
DOI:10.15952/j.cnki.cjsc.1005-1511.2015.11.1013 *
文献标识码:A
中图分类号:O626.4; O621.3
