3-氯-2-羟基丙磺酸钠的合成工艺研究*
2016-01-17葛丽娟刘白玲李晨英陈华林中国科学院大学北京100049中国科学院成都有机化学有限公司四川成都610041四川花语精细化工有限公司四川自贡6411
葛丽娟,刘白玲,张 涌,李晨英,罗 荣,陈华林(1.中国科学院大学,北京 100049; .中国科学院成都有机化学有限公司,四川成都 610041; .四川花语精细化工有限公司,四川自贡 6411)
3-氯-2-羟基丙磺酸钠的合成工艺研究*
葛丽娟1,2,刘白玲2,张涌3,李晨英1,2,罗荣2,陈华林2
(1.中国科学院大学,北京100049; 2.中国科学院成都有机化学有限公司,
四川成都610041; 3.四川花语精细化工有限公司,四川自贡643113)
摘要:以环氧氯丙烷(1)和NaHSO3为原料,Na2SO3为引发剂,乙二胺四乙酸二钠(EDTA-2Na)为络合增效剂,经酸催化开环反应合成了磺酸型两性表面活性剂中间体——3-氯-2-羟基丙磺酸钠(2),其结构经1H NMR,IR 和ESI-MS确证。在最佳反应条件[1 0.55 mol,n(NaHSO3)∶n(Na2SO3)∶n(EDTA-2Na)∶n(H2O)=1.00∶0.04∶0.01∶9.50,1的滴加时间15 min,在适宜的转速(前期100 rpm,后期300 rpm)下,于70℃(浴温)反应1.25 h]下合成的2,收率81.55%。并对反应机理进行了推测。
关键词:环氧氯丙烷; 3-氯-2-羟基丙磺酸钠;表面活性剂;合成;反应机理
3-氯-2-羟基丙磺酸钠(2)是一种含羟基和磺酸钠基的氯代烷,与咪唑啉发生烷基化反应可以制得含磺酸基的两性表面活性剂[1],其产率和纯度对表面活性剂的性能影响极大。
2的合成已有文献[2-5]报道,但均未涉及合成工艺研究,尤其缺乏对体系pH变化趋势的关注,且产率偏低(约40%)。如果采取冷却、有机溶剂或减压蒸馏可以获得较高产率(约90%),但操作不够简便。对其进行全面的合成工艺研究,具有一定的现实意义。

Scheme 1
为此,本文以环氧氯丙烷(1)和NaHSO3为原料,Na2SO3为引发剂,乙二胺四乙酸二钠(EDTA-2Na)为络合增效剂,经酸催化开环反应合成了磺酸型两性表面活性剂中间体2(Scheme 1),其结构经1H NMR,IR和ESI-MS确证。对反应条件进行了全面的研究;对反应机理进行了推测。
1 实验部分
1.1仪器与试剂
Perkin-Elmer DSC7型熔点仪(温度未校正); PHS-3C型pH计(玻璃电极); Brucker 300 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标); Nicolet MX-1E FT-IR型红外光谱仪(KBr压片); Thermo Finnigan LCQ DECA型电喷雾离子阱质谱仪。
1,分析纯,山东海力化工有限公司;亚硫酸钠和亚硫酸氢钠,化学纯,北京润泽康生物科技有限公司;酸性品红,分析纯,天津博迪化工有限公司;其余所用试剂均为化学纯。
1.22的合成[6-14]
在四颈反应瓶中加入NaHSO352 g(500 mmol),Na2SO32.52 g(20 mmol),EDTA-2Na 1.69 g(5 mmol)及水85.5 mL(4 750 mmol),加热搅拌使其溶解[取约30%溶液(简称溶液A)待用];控制pH<6.5,依次滴加1 50.9 g(0.55 mol)和溶液A,滴毕,于70℃(浴温)反应至终点(品红溶液不褪色)。降至室温,结晶,真空抽滤,滤饼于105℃真空干燥得白色固体2;1H NMR δ:2.74(dd,J=13.5 Hz,5.6 Hz,1H,CH2Cl),2.61(dd,J=13.4 Hz,6.7 Hz,1H,CH2Cl),3.61(dd,J=11.0 Hz,6.0 Hz,1H,CH2SO3),3.81(dd,J=11.0 Hz,3.8 Hz,1H,CH2SO3),4.13~3.95(m,1H,CHOH),5.27(d,J=3.3 Hz,1H,OH); IR ν:3 357(OH),1 630(SO3Na),1 422(OH),1 149(CH2OH),728(CH2Cl)cm-1; ESI-MS m/z:Calcd for C3H6O4SClNa{[M + Na]+} 219.6,found 218.98。
2 结果与讨论
2.1反应机理的推测及副反应的控制
反应体系中pH值的变化是反应进程的体现,同时对副反应的发生影响较大。实验中,用pH计跟踪测定反应过程中pH值的变化,推测出反应机理并验证了Na2SO3的引发作用,对控制副反应的发生起到了指导作用。
(1)反应机理的推测
在2的合成中,随着NaHSO3的消耗,pH应逐渐上升。然而,通过对反应体系进程中pH值的检测(图1),发现随着反应时间的延长,pH值呈先上升后下降的趋势。
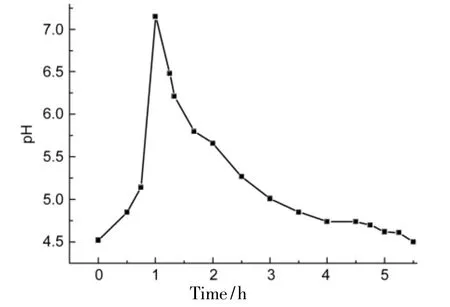
图1 pH值随反应时间的变化曲线Figure 1 Variation curve of pH values with reaction time
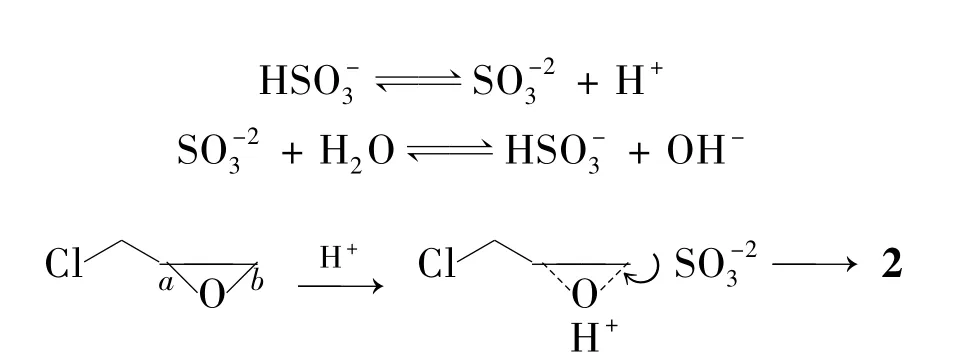
Scheme 2
在反应体系中存在HSO3-和SO23-的电离和水解平衡,推测其反应机理如Scheme 2。首先体系中的H+与环氧基团中的氧结合使环氧基团带正电,从而削弱了C-O键,有利于亲核试剂SO23-的进攻。位阻效应的存在限制了对a处的进攻,SO23-在b处更易发生亲核取代得到2。根据体系pH变化趋势,推测H+与环氧基的结合速度比SO23-对环氧基的进攻要快,所以反应体系的pH呈上升趋势。而随着后期SO23-的逐渐消耗,使得反应体系的pH下降。
田志茗等[5]研究表明:Na2SO3在反应中起着离子引发剂的作用,但并未进行试验验证。根据Na2SO3加入前后反应体系pH的变化(见图2),本文对此进行了证实:未加Na2SO3前,反应体系pH基本保持不变甚至略有下降,说明体系中没有消耗NaHSO3,反应未开始。反应40 min时加入少量Na2SO3,体系pH迅速大幅度上升,表明反应开始。由此可以推断,Na2SO3起着引发反应的重要作用。

图2 Na2SO3加入前后对pH的影响Figure 2 Effect of before and after adding Na2SO3on pH value

图3 不同pH条件下Cl-的定性检测Figure 3 Qualitative detection of Cl-under different pH conditions
(2)水解副反应的控制
1和2中的有机氯在碱性条件下会发生水解反应,产生Cl-,反应结束后可以通过检测体系中Cl-含量判定水解副产物的多少。通过跟踪测定反应体系pH并取样检测溶液中是否有Cl-生成(图3),即可判断水解副反应发生的程度。从图3可见,反应15 min和30 min时,Cl-均不存在;反应45 min时,产生Cl-,此时对应的pH约6.5。推测当pH>6.5时,1和2会发生水解反应,促成副产物的生成,从而影响2的产率和纯度。
通过预先取出部分原料NaHSO3或(NaHSO3+ Na2SO3+ EDTA)混合溶液,当体系pH接近6.5时补加入体系,可有效控制pH值变化,使pH波动幅度降低。通过对三种方案,即空白,补加30% NaHSO3和溶液A,对体系Cl-含量[Cl-/%=n(Cl测-定)/n(1)]进行检测,结果显示三种方案的Cl-含量分别为5.42%,4.32%和3.92%。由此可见,补加溶液A的措施可明显降低Cl-的含量,说明控制了水解副反应的发生,提高了2的产率和纯度。
2.2合成2的反应条件优化
(1)1的滴加时间
1 0.55 mol,其余反应条件同1.2,考察1的滴加时间对2收率和纯度的影响,结果见表1。从表1可见,滴加15 min和30 min,反应到达终点所需时间相差不大;滴加60 min明显减缓了反应进程,虽产率稍有提高,但所得产物纯度不好(熔程较宽)。由此可可见,1的滴加时间越短,反应进程越快,所得产物的产率高,且纯度好。但在滴定过程中要注意温度的变化,控制温度在90℃以下,避免1发生自聚反应[7]。综合考虑,1的最佳滴加时间以30 min为宜。

表1 1的滴加时间对反应时间,2的产率及纯度的影响*Table 1 Effect of 1 dropping time on the reaction time,yield and purity of 2
(2)转速
探究转速对反应的影响是因为1微溶于水,与NaHSO3溶液组成非均相反应体系,属于界面反应,且该反应为放热反应,转速的大小对体系界面及散热都影响很大。预期随着转速的增大,增加界面接触,有利于反应进程及产率的提高。

表2 转速对反应时间,2的产率及纯度的影响*Table 2 Effect of rotating speed on the reaction time,yield and purity of 2
1的滴加时间为30 min,其余反应条件同2.2(1),考察转速对2产率和纯度的影响,结果见表2。由表2可见,转速过大(500 rpm)反而延长了反应时间,结果与与预期相悖。推测原因,我们认为,对于转速的选择,应综合考虑散热和界面反应两个因素,并根据体系温度的变化灵活掌握。例如,在上述低浓度的反应体系,应选择中等转速以兼顾界面接触和利用反应放热;在高浓度反应体系,前期应选择低转速以避免过多的界面接触,防止体系温度过高引起环氧氯丙烷自聚;反应中后期体系温度趋于稳定时,则应提高转速,增大界面接触,使反应更快地到达反应终点(后文通过限制溶剂量来增加产率的试验中,证明了我们这一推测的正确性)。从反应时间和产物纯度的角度考虑,最佳的转速应为:反应前期100 rpm,中后期300 rpm。
(3)反应温度和溶剂用量
1滴加时间30 min,反应前期转速100 rpm,中后期转速300 rpm,其余反应条件同2.2(1),考察反应温度和溶剂用量对2产率和纯度的影响,结果见表3。
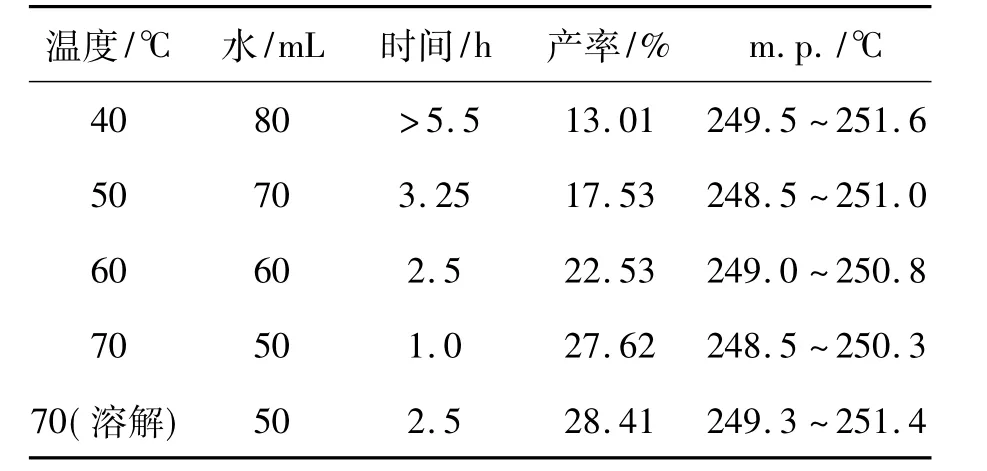
表3 反应温度和溶剂用量对反应时间,2的产率及纯度的影响*Table 3 Effect of temperature and solvent amounton the reaction time,yield and purity of 2

表4 r对反应时间,2的产率及纯度的影响*Table 4 Effect of r on the reaction time,yield and purity of 2
从表3可见,随着反应温度的提高,NaHSO3在水中的溶解度增大,相应所需的溶剂(水)量减少;溶剂量的降低可明显缩短反应时间,提高产率。即提高反应温度、减少溶剂量的协同作用,可促使反应速率提高,缩短反应时间,并带来较高的收率。最佳反应温度为70℃,水用量50 mL。
(4)r[n(NaHSO3)∶n(Na2SO3)]
Na2SO3在体系中起着引发反应的重要作用。1滴加时间30 min,反应前期转速100 rpm,中后期转速300 rpm,反应温度70℃,水50 mL,其余反应条件表2.2(1),考察Na2SO3用量对2产率和纯度的影响,结果见表4。由表4可见,随着Na2SO3用量的增加,反应速率增快,反应时间缩短,产率提高。但Na2SO3用量的增大,会相应提高体系中氯离子的含量,即增加了水解副产物的发生,还会使产物熔点有所降低,影响其纯度。另一方面,少量Na2SO3和EDTA-2Na的加入可明显增大NaHSO3的溶解度,将溶剂水的用量限制在最少,这样既可缩短反应时间,又能明显提高产物的产率。最佳的r=1.0∶0.4。
通过大量的实验研究,综合考虑反应速率、产物纯度及产率,将溶剂量限制在最少,最佳的物料配比为:n(NaHSO3)∶n(Na2SO3)∶n(EDTA-2Na)∶n(H2O)=1.00∶0.04∶0.01∶9.50。在此条件下,进一步对y=n(NaHSO3)∶n(1)进行探讨,结果见表5。由表5可见,NaHSO3或1任一过量,都将使反应较快达到反应终点。若NaHSO3过量,产率较大但产品熔点偏低,纯度不高;且通过滴定判定反应终点操作繁琐。基于对反应终点判定的方便和产物纯度的考虑,应选择1过量。最佳的y=1.0∶0.04。

表5 y对反应时间,2的产率及纯度的影响*Table 5 Effect of y on the reaction time,yield and purity of 2
由表5还可见,室温条件下结晶所得产率较表1~表4冰水浴结晶所得产率有了明显的提高,而且结晶条件更温和、更便捷。
综上所述,合成2的最佳反应条件为:1 0.55 mol,n(NaHSO3)∶n(Na2SO3)∶n(EDTA-2Na)∶n(H2O)=1.00∶0.04∶0.01∶9.50,1的滴加时间15 min,在适宜的转速(前期100 rpm,后期300 rpm)下,于70℃(浴温)反应1.25 h。
2.3回收母液套用
为进一步提高2的产率,减少废液的排放,为实际生产提供参考,对最佳反应条件进行了放大(1 kg)和母液回收利用,结果见表6。从表6可见,常温结晶所得产率高达81.55%。母液中还残留有部分产物,通过母液回收,循环两次,常温下结晶所得平均产率可达98%(平均产率=三次所得目标产物总质量/目标产物理论质量)。但随着循环次数的增加,产物熔点下降,熔程变宽,纯度有所下降。

表6 母液循环使用对2产率的影响*Table 6 Effect of reuse of mother liquid on yield of 2
3 结论
通过对3-氯-2-羟基丙磺酸钠(2)合成过程中所涉及反应机理及各影响因素的全面探讨,可得到以下结论:(1)反应体系的pH呈现升高-下降的趋势,当pH>6.5,环氧氯丙烷(1)和2会发生水解副反应。(2)根据反应机理的推断,该反应为酸催化开环反应,所以应将1滴加到NaHSO3酸性环境中。(3)Na2SO3可以增加NaHSO3的溶解度,引发反应且加速反应进程。温度是影响反应的最主要因素,温度的升高可缩短反应时间,为避免1自聚,应将体系温度控制在90℃以下。(4)合成2的较佳反应条件为:1 0.55 mol,n(NaHSO3)∶n(Na2SO3)∶n(EDTA)∶n(H2O)=1.00∶0.04∶0.01∶9.50,1的滴加时间15 min,在适宜的转速(前期100 rpm,后期300 rpm)下,于70℃(浴温)反应1.25 h。(5)在放大试验中,母液回用两次,平均产率可达98%。
参考文献
[1]徐克勋主编.精细有机化工原料及中间体手册[M].北京:化学工业出版社,1988.
[2]申云霞,毕彩丰,赵宇,等.2-羟基-3-氯丙磺酸钠的合成及结构表征[J].化工进展,2009,(12):2218-2220.
[3]陈正国,钱勇,高庆,等.3-氯-2-羟基丙磺酸钠的合成研究[J].胶体与聚合物,2003,21(2):17-18.
[4]左海丽,吴晓青,崔璐娟,等.合成工艺对3-氯-2-羟基丙磺酸钠产率及时间的影响[J].胶体与聚合物,2006,24(4):33-34.
[5]田志茗,邓启刚,孙宏,等.3-氯-2-羟基丙基磺酸钠的合成研究[J].齐齐哈尔大学学报,2008,24(1):1-3.
[6]四川花语精细化工有限公司.一种生产3-氯-2-羟基丙磺酸钠的方法[P].CN 20 071 005 047.1,2008.
[7]孙继,胡兴刚,靳晓霞.3-氯-2-羟基丙磺酸钠的合成[J].天津化工,2007,12(5):37-38.
[8]王伟.微波场中3-氯-2-羟基丙磺酸钠的合成及其表征[D].湘潭:湘潭大学,2012.
[9]李树安,张铸勇.咪唑啉磺酸盐两性表面活性剂的合成[J].精细化工,1990,7(5):75-78.
[10]胡建奎.品红溶液的浓度该多大[J].化学教学,1996,10:43-44.
[11]郝玉兰,王雪,刘爱庆.硬脂酸-2-羟基-3-丙磺酸钠的合成[J].大庆石油学院学报,2008,32(6):76-78.
[12]Nicholas P,Carl P,Warner M L.Soap based detergent formulation:XXIV.Sulfobetaine derivatives of fatty amides[J].Journal of the American Oil Chemists’Society,1977,54(7):294-296.
[13]Dong S J,Li Y L,Song Y B,et al.Synthesis,characterization and performance of unsaturated long-chain carboxybetaine and hydroxy sulfobetaine[J].J Surfact Deterg,2013,16:523-529.[14]Hao Y L,Cheng Y Z,Wang X.Synthesis and properties of palmitic acid-2-hydroxy-3-sulfonic sodium propyl ester[J].Key Engineering Materials,2011,480-481:11-16.
·研究简报·
·研究简报·
通信联系人:陈华林,研究员,博士生导师,Tel.028-85260436,E-mail:aofly@163.com
Research of Synthetic Process of
Sodium3-Chloro-2-hydroxy Propanesulfate
GE Li-juan1,2,LIU Bai-ling2,ZHANG Yong3,LI Chen-ying1,2,LUO Rong2,CHEN Hua-lin2
(1.The Graduate School of Chinese Academy of Sciences,Beijing 100049,China;
2.Chengdu Organic Chemicals Co.,Ltd.,Chinese Academy of Sciences,Chengdu 610041,China;
3.Sichuan Flower’s Song Fine Chemical Co.,Ltd.,Zigong 643113,China)
Abstract:A important intermediate of sulfonate amphoteric surfactant,sodium 3-chloro-2-hydroxy propanesulfate(2),was synthesized by acid-catalyted ring-opening reaction,using epichlorohydrin(1)and NaHSO3as material,Na2SO3as initiator,EDTA-2Na as complexing synergist.The structure was confirmed by1H NMR,IR and ESI-MS.The yield of 2 was 81.55% under the optimum reaction conditions[1 0.55 mol,n(NaHSO3)∶n(Na2SO3)∶n(EDTA-2Na)∶H2O)=1.00∶0.04∶0.01∶9.50,dropping time of 1 was 15 min,rotating speed is varied from 100 rpm to 300 rpm,at 70℃for 1.25 h].Keywords:epichlorohydrin; sodium 3-chloro-2-hydroxy propanesulfate; surfactant; synthesis; reaction mechanism
作者简介:葛丽娟(1989-),女,汉族,山东聊城人,硕士研究生,主要从事咪唑啉表面活性剂的研究。E-mail:momo1225@126.com
基金项目:四川花语精细化工有限公司“科技创新基金”资助项目
收稿日期:2015-01-29
DOI:10.15952/j.cnki.cjsc.1005-1511.2015.12.1153 *
文献标识码:A
中图分类号:O623.84; O621.3
