新型6-(4-氨基苯基)-4,5-二氢-3(2H)-哒嗪酮α-氨基膦酸酯衍生物的合成*
2016-01-17鞠志宇牛亮峰李富源李公春吴长增许昌学院化学化工学院河南许昌461000
鞠志宇,牛亮峰,李富源,李公春,吴长增(许昌学院化学化工学院,河南许昌 461000)
新型6-(4-氨基苯基)-4,5-二氢-3(2H)-哒嗪酮α-氨基膦酸酯衍生物的合成*
鞠志宇,牛亮峰,李富源,李公春,吴长增
(许昌学院化学化工学院,河南许昌461000)
摘要:以乙酰苯胺与丁二酸酐为原料,经Friedel-Crafts酰化反应、水解脱乙酰基和水合肼缩合制得中间体6-(4-氨基苯基)-4,5-二氢-3(2H)-哒嗪酮(3); 3与芳醛和亚磷酸二乙酯经类Mannich-type反应合成了5个新型的6-(4-氨基苯基)-4,5-二氢-3(2H)-哒嗪酮α-氨基膦酸酯衍生物,其结构经1H NMR,13C NMR,31P NMR,IR 和ESI-MS表征。
关键词:6-(4-氨基苯基)-4,5-二氢-3(2H)-哒嗪酮;α-氨基膦酸酯;合成
6-取代苯基-4,5-二氢-3(2H)-哒嗪酮类化合物有较强的抑制血小板聚集、降压和强心作用,具有较为理想的治疗学意义。其作用机理可能是由于这类化合物在化学结构和电性效应方面与cAMP相似,可以选择性地抑制磷酸二酯酶,抑制cAMP的水解、提高细胞内cAMP水平、降低ADP浓度,从而产生强心和血小板聚集抑制作用[1-2]。
目前疗效较好的药物有MCI-154[3-4],CCI-17810[5],CI-914[6],Amipizone[7]等。代表药MCI-154{ 6-[4(4'-吡啶基)氨基苯基]-4,5-二氢-3(2H)-哒嗪酮(Chart 1)}是一种具有Ca(Ⅱ)增敏活性的哒嗪酮类衍生物,在给药浓度大于1.0× 10-4mol·L-1时,才能提高cAMP水平[3]。由于α-氨基膦酸酯与天然的氨基酸极为相似,α-氨基膦酸酯具有多种生物活性和药理活性[8-9]

Chart 1
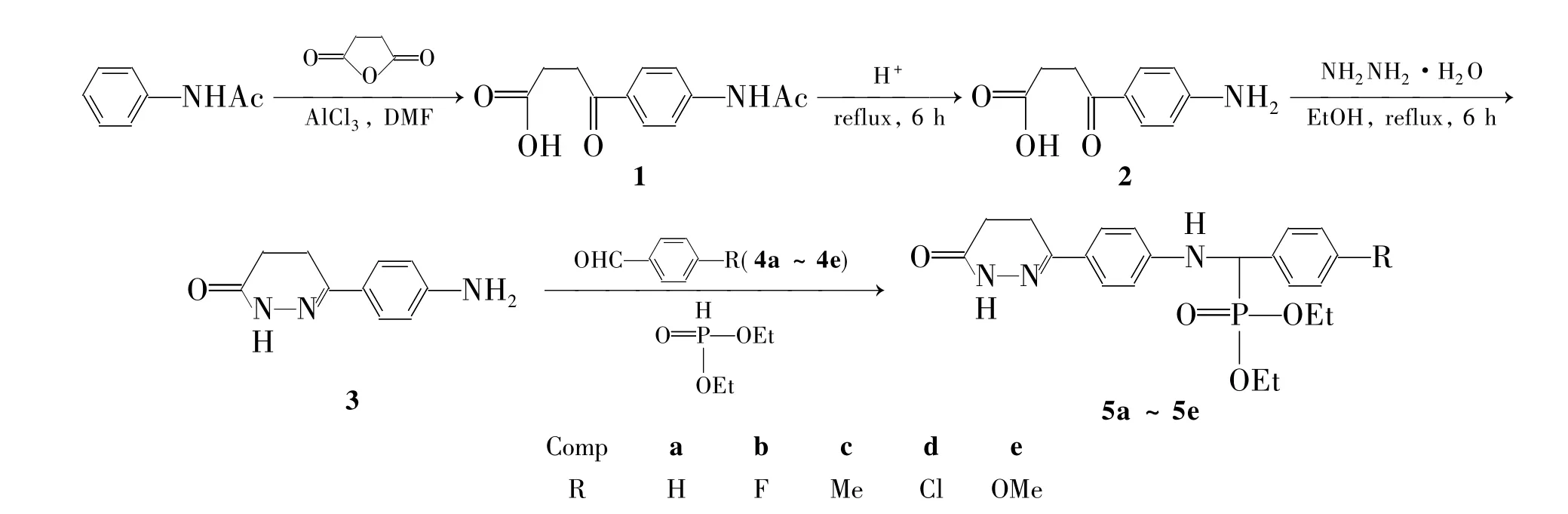
Scheme 1
为了得到疗效更高,毒副作用更小的抑制血小板聚集的药物,根据药物拼合原理,本文将α-氨基膦酸酯引入6-(4-氨基苯基)-4,5-二氢-3(2H)-哒嗪酮(3)分子中,设计并合成了5个新型的含6-(4-氨基苯基)-4,5-二氢-3(2H)-哒嗪酮α-氨基膦酸酯(5a~5e)。以乙酰苯胺与丁二酸酐为原料,经Friedel-Crafts酰化反应、水解脱乙酰基和水合肼缩合制得中间体3; 3与芳醛(4a~4e)和亚磷酸二乙酯经类Mannich-type反应合成了5a~5e(Scheme 1),其结构经1H NMR,13C NMR,31P NMR,IR和ESI-MS表征。
5a~5e的合成,有可能在强心和血小板聚集抑制作用以及心血管疾病预防方面具有潜在的应用价值,有待进一步研究。
1 实验部分
1.1仪器与试剂
Brucker AvanceⅢ400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标); Thermo Nicoler IR 200型红外光谱仪(KBr压片); Bruker Esquire 3000型质谱仪。
1~3参考文献[10]方法合成【3:灰色固体,ESI-MS m/z:190.2{[M + H]+}】;柱层析硅胶(200目~300目),青岛海洋化工厂分厂;其余所用试剂均为分析纯,其中甲苯用无水硫酸镁干燥除水。
1.2 5a~5e的合成通法
在反应瓶中依次加入4 4 mmol,3 4 mmol,亚磷酸二乙酯4 mmol和甲苯40 mL,搅拌下回流反应至终点[TLC跟踪,展开剂:V(乙酸乙酯)∶V(石油醚)=3∶1]。蒸除甲苯,残余物经硅胶柱层析[洗脱剂:V(乙酸乙酯)∶V(石油醚)=3∶1]纯化得5a~5e。
5a:灰色固体,收率77%;1H NMR δ:8.75(s,1H,NH),6.60~7.48(m,9H,ArH),5.24(d,J=6.4 Hz,1H,NH),4.80(d,J=24.0 Hz,1H,PCH),4.14(m,2H,OCH2),3.92(m,1H,OCH2),3.66(m,1H,OCH2),2.86(t,J=8.0 Hz,2H,CH2),2.52(t,J=8.0 Hz,2H,CH2),1.30(t,J=7.2 Hz,3H,CH3),1.11(t,J=7.2 Hz,3H,CH3);13C NMR δ:167.5,150.8,147.8,135.4,128.7,127.8,127.1,125.3,113.5,63.5,56.5,54.9,26.4,22.3,16.4;31P NMR δ:22.2; IR ν:3 287(N-H),1 236(P=O),1 050(P-OC)cm-1; ESI-MS m/z:416.2{[M +H]+}。
5b:灰褐色固体,收率57%;1H NMR δ:9.12(s,1H,NH),7.70~6.60(m,8H,ArH),5.20(d,J=6.4 Hz,1H,NH),4.72(d,J=24.0 Hz,1H,PCH),4.25(m,2H,OCH2),3.94(m,1H,OCH2),3.66(m,1H,OCH2),2.92(t,J=8.0 Hz,2H,CH2),2.58(t,J=8.0 Hz,2H,CH2),1.31(t,J=7.2 Hz,3H,CH3),1.10(t,J=7.2 Hz,3H,CH3);13C NMR δ:167.5,159.2,150.8,147.8,135.4,128.7,127.1,116.6,113.5,63.5,56.5,54.9,26.4,22.3,16.4;31P NMR δ:20.6; IR ν:3 292(N-H),1 237(P=O),1 030(P-O-C)cm-1; ESI-MS m/z:434.2{[M + H]+}。
5c:灰色固体,收率57%;1H NMR δ:8.20(s,1H,NH),7.33~6.60(m,8H,ArH),5.15(s,1H,NH),4.92(d,J=24.0 Hz,1H,PCH),4.05(m,2H,OCH2),3.88(m,1H,OCH2),3.60(m,1H,OCH2),2.88(t,J=8.0 Hz,2H,CH2),2.56(t,J=8.0 Hz,2H,CH2),2.44(s,3H,ArCH3),1.30(t,J=7.2 Hz,3H,CH3),1.11(t,J=7.2 Hz,3H,CH3);13C NMR δ:166.6,150.7,147.5,137.6,135.4,128.7,127.8,127.1,113.5,63.5,56.5,54.9,26.4,23.4,22.3,16.4;31P NMR δ:23.1; IR ν:3 280(N-H),1 230(P=O),1 055(P-O-C)cm-1; ESI-MS m/z:430.2{[M + H]+}。
5d:灰褐色固体,收率62%;1H NMR δ:8.95(s,1H,NH),7.52~6.60(m,8H,ArH),5.20(s,1H,NH),4.84(d,J=24.0 Hz,1H,PCH),4.20(m,2H,OCH2),3.98(m,1H,OCH2),3.72(m,1H,OCH2),2.92(t,J=8.0 Hz,2H,CH2),2.58(t,J=8.0 Hz,2H,CH2),1.31(t,J=7.2 Hz,3H,CH3),1.10(t,J=7.2 Hz,3H,CH3);13C NMR δ:167.2,150.6,147.5,135.1,129.2,128.6,127.8,127.1,113.5,63.5,56.5,54.9,26.4,22.3,16.4;31P NMR δ:21.4; IR ν:3 295(N-H),1 236(P=O),1 050(P-OC)cm-1; ESI-MS m/z:450.7{[M +H]+}。
5e:灰色固体,收率63%;1H NMR δ:8.10(s,1H,NH),7.32~6.60(m,8H,ArH),5.08(s,1H,NH),4.90(d,J=24.0 Hz,1H,PCH),4.05(m,2H,OCH2),3.88(m,1H,OCH2),3.81(m,3H,OCH3),3.60(m,1H,OCH2),2.88(t,J=8.0 Hz,2H,CH2),2.56(t,J=8.0 Hz,2H,CH2),1.30(t,J=7.2 Hz,3H,CH3),1.11(t,J=7.2 Hz,3H,CH3);13C NMR δ:166.5,150.8,147.8,137.4,135.4,128.7,127.8,127.1,113.5,63.5,56.5,55.5,54.9,26.4,22.3,16.4;31P NMR δ:23.6; IR ν:3 288(NH),1 230(P=O),1 057(P-O-C)cm-1; ESIMS m/z:446.2{[M + H]+}。
2 结果与讨论
2.1合成
目前由醛、胺和亚磷酸酯三组分制备α-氨基膦酸酯的方法有两种:一是采用亚胺加成法,即先使醛和胺反应生成亚胺,再和亚磷酸酯反应生成目标产物[11]。另一种方法是由醛、胺和亚磷酸酯三组分“一锅煮”法反应直接得到目标产物。采用第二种方法大多需添加金属催化剂,对于含有强钝化基团的芳香胺,生成α-氨基膦酸酯的收率较高,对于其它芳香胺,收率则较低,即没有明显提高[12-15]。本研究使用的芳香胺虽然有钝化基团,但不是强钝化基团,使用金属催化剂效果不明显。因此,本研究以甲苯为溶剂,采用了“一锅煮”合成的方法,运用平衡移动原理,采用分离生成物中的水,使反应向正反应移动,不需要使用催化剂,操作步骤简便。
以合成5a为模板反应,考察反应溶剂对其收率的影响,结果见表1。由表1可见,没有使用分水器时,溶剂对收率影响较小。当使用分水器时,以甲苯和苯作溶剂,回流反应10 h时,收率分别为75%和62%,甲苯优于苯。说明使用分水器对收率有很大影响。甲苯为该反应较理想的溶剂。
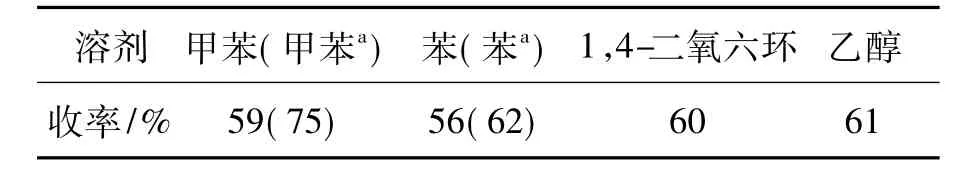
表1 溶剂对5a收率的影响*Table 1 Effect of solvent on yield of 5a
2.2表征
由1H NMR谱图(略)可以看出,与P相连的两个乙酯基是核磁不等价的;两个甲基中有有个甲基峰出现在δ 1.30左右,另一个甲基峰出现在δ 1.10左右;乙基上的两个亚甲基也在不同的位置,裂分为多重峰。由31P NMR谱图(略)可以看出,P峰出现在δ 20~24。
参考文献
[1]Mochizuki N,Uchida S,Miyata H.Cardiovascular effects of NSP-804 and NSP-805,novel cardiotonic agents with vasodilator properties[J].Journal of Cardiovascular Pharmacology,1993,21(6):983-995.
[2]要芬梅,孙常晟.6-取代二氢哒嗪酮类化合物的合成及血小板聚集抑制作用[J].药学学报,1993,28(7):548-552.
[3]Liao R,Gwathmey J K.Effects of MCI-154 and caffeine on Ca(Ⅱ)-regulated interactions between troponin subunits from bovine heart[J].J Pharmaeol Exp Ther,1994,270(2):831-839.
[4]Kitada Y,Narimatsu A,Matsumura N,et al.Contractile proteins:Possible targets for the cardiotonic action of MCI-154,a novel cardiotonic agent[J].Eur J Pharmacol,1987,134:229-231.
[5]Griffett E M,Kinnon S M,Kumar A,et al.Effects of 6-[p-(4-phenylacetylpiperazin-1-yl)phenyl]-4,5-dihydro-3(2H)pyridazinone(CCI-17810)and aspirin on platelet aggregation and adhesiveness[J].Br J Pharmacol,1981,72(4):697-705.
[6]蒋勤,孙常晟.6-(4-取代苯基)-4,5-二氢-3(2H)哒嗪酮类化合物的合成及其抑制血小板的作用[J].药学学报,1990,25(8):598-603.
[7]Thyes M,Lehmann H D,Gries J,et al.6-Aryl-4,5-dihydro-3(2H)-pyridazinones.A new class of compounds with platelet aggregate ion inhibiting and hypotensive activeties[J].J Med Chem,1983,26(6):800-807.
[8]Chimirri A,Grasso S,Monforte P,et al.Compounds with potential anti-tumor activity VII.Synthesis and anti-tumor activity of 1-aryl-N,N'-di(1,3,4-thiadiazol-2-yl)methylenediamines[J].Eur J Med Chem,1989,24:131-135.
[9]李在国,黄润秋,杨昭,等.含苯并噻唑杂环的α-氨基膦酸二苯酯的合成及生物活性[J].应用化学,1999,16(2):90-92.
[10]刘超美,张志强,陆波,等.二氢哒嗪酮类化合物的合成及其对血小板聚集的抑制作用[J].中国药物化学杂志,1998,8(4):254-259.
[11]Arsanious M H N,Isaac Y A,Boulos L S.Reactions of phosphite esters and trisdialkylaminophosphines with 5-substituted 1,3,4-thiadiazol derivatives[J].Heteroatom Chemistry,200l,12(7):594-601.
[12]Wu J,Sun W,Xia HG,et al.A facile and highly efficient route to α-amino phosphonates via three-component reactions catalyzed by Mg(ClO4)2or molecular iodine[J].Org Biomol Chem,2006,4:1663-1666.
[13]Kumar A S,Taneja S C,Hundal M S,et al.One-pot synthesis of α-aminophosphonates catalyzed by antimony trichloride adsorbed on alumina[J].Tetrahedron Lett,2008,49(14):2208-2212.
[14]Lee S,Park J H,Kang J,et al.Lanthanide triflate-catalyzed three component synthesis of α-amino phosphonates in ionic liquids.A catalyst reactivity and reusability study[J].Chem Commun,2001,(17):1698-1699.
[15]Das B,Damodar K,Bhunia N.A simple and efficient access to alpha-amino phosphonates from N-benzyloxycarbonylamino sulfones using indium(III)chloride [J].J Org Chem,2009,74(15):
Synthesis of Novel α-Aminophosohonate Derivatives
Containing 6-(4-Aminophenyl)-4,5-dihydro-3(2H)pyridazinone
JU Zhi-yu,NIU Liang-feng,LI Fu-yuan,LI Gong-chun,WU Chang-zheng
(College of Chemistry and Chemical Engineering,Xuchang University,Xuchang 461000,China)
Abstract:Five novel α-aminophosohonate derivatives containing 6-(4-aminophenyl)-4,5-dihydro-3(2H)pyridazinone were synthesized by Mannich-type reaction of aromatic aldehyde,diethyl phosphite and 6-(4-aminophenyl)-4,5-dihydro-3(2H)-pyridazinone,which was prepared by Friedel-Crafts acylation,amide hydrolysis and condensation,using acetylaniline and succinic anhydride as starting materials.The structures were characterized by1H NMR,13C NMR,31P NMR,IR and ESI-MS.
Keywords:6-(4-aminophenyl)-4,5-dihydro-3(2H)-pyridazinone;α-aminophosohonate; synthesis
作者简介:鞠志宇(1974-),男,汉族,河南潢川人,博士,副教授,主要从事有机合成的研究。E-mail:juz1696@163.com
基金项目:河南省科技攻关项目(122102210426);河南省教育厅科学技术研究重点项目(14B150060)
收稿日期:2015-06-24
DOI:10.15952/j.cnki.cjsc.1005-1511.2015.12.1140 *
文献标识码:A
中图分类号:O626.4
