7种不同药剂对番茄种子除害处理效果评价与研究
2016-01-16王溪桥李春雷左佳妮文朝慧王军平
王溪桥, 李春雷, 尤 佳, 左佳妮, 文朝慧, 王军平
(甘肃出入境检验检疫局检验检疫综合技术中心, 兰州730010)
番茄细菌性斑点病 (Tomato bacterial speck),由丁香假单胞杆菌番茄致病变种(Pseudomonas syringae pv.tomato,PST)所引起。PST危害番茄的果实、叶、茎和花,且其危害时间可从苗期至收获期之久[1]。番茄细菌性叶斑病菌不但影响番茄的产量,而且会在一定程度上降低番茄的品质。我国大面积种植番茄,番茄的种植面积在我国商业蔬菜面积和设施农业中都占有较大比例,其产量的高低直接影响农民的经济收入。自1933年以来,番茄细菌性叶斑病菌危害到美国、前苏联、加拿大等20多个国家,最严重的造成番茄产量减产75%[2]。此外,在国内,继台湾发现该病后,吉林省(1998—1999年)长春市、黑龙江省和辽宁省(1999年)的番茄产区以及甘肃、山西等省有些番茄品种也受到该病菌的危害[1]。
种传病害是90%左右的食用作物的重要初染源之一[3]。H.Yunis等[2]研究证明,PST 病菌在干燥的种子上可存活20年之久。一些地区新病害的出现且连年发生的根本原因就是其播种的种子携带致病菌[4-6]。Okechukwu 等[7]对 豇 豆 细 菌 疫 病 病 菌Xanthomonas campestris pv.vignicola 诱发豇豆发病的研究发现,无论是使种子表面带菌的浸种接种还是直接接种的方法,病菌Xanthomonas campestris pv.vignicola都能够从种子向植株传播,引发种子萌发力降低,部分萌发幼苗死亡和成株发病。在田间,附着在种子表面的病菌会随着雨水等浸入土壤,使土壤中携带该病菌,导致农作物的产量降低,甚至影响次年播种的农作物的产量与品质。因此,防止致病菌在种子上的初染是目前亟待解决的问题。降低种子表面带菌率可有效控制番茄产量的下降,从而减轻农民经济上的损失。
目前,种传病害的研究与防治已成为热点。关于带菌种子除害技术的研究很多,研究者们利用酸、碱以及抗生素对带菌种子进行浸泡处理;或者干燥处理带菌种子,以期去除种子表面的有害微生物。宋顺华等[8]研究发现,经盐酸浸泡过的种子,其种子表面的病原细菌的繁殖速度下降,病原细菌量明显减少;翁晓梅等[9]比较了盐酸、硫酸、甲醛(100倍)以及次氯酸钙4种药剂对甜瓜种子的除害效果,结果表明,4种药剂对甜瓜种子表面细菌的抑制效果较链霉素、氯霉素的好,其中,盐酸的除害效果最稳定;吴国平等[10]发现,福尔马林(300倍液)不但可有效降低葫芦的种传病害,而且不影响种子活力;张成虎等[11]研究结果表明,5%的磷酸三钠可控制甘蓝种子种传黑斑病菌。此外,在西瓜[12-14]、哈密瓜[15]、红花[16]、甘草[17]等种子除害研究中也得到相似的结果。
本研究选择磷酸三钠、次氯酸钙、苏纳米、甲醛、盐酸、高锰酸钾与二氯异氰尿酸钠作为除害处理药剂,比较这7种药剂对PST的除害效果。同时,种子的发芽率也是影响产量的重要因素,在种子除害的同时要考虑除害药剂对种子的发芽率是否有影响。要选择除害效果优良,同时还不影响种子发芽率的药剂作为最终应用于生产实践中的最优药剂。
近年来,番茄细菌性叶斑病菌在甘肃省的番茄发病率有所上升,降低番茄种子的带菌率成为急需解决的问题。目前基层针对番茄种子的除害处理方法混杂多样,还没有一种统一高效的处理方法。前人对种子除害处理的相关研究所选择的药剂比较单一。本研究选择了7种药剂,系统地比较了这些药剂的除害效果,意在筛选出一种实用高效的种子处理药剂。为制定控制番茄细菌性叶斑病菌种传病害的最佳实验方法提供了可靠的实验依据,并且为其他种传病害的除害处理提供借鉴。
1 材料与方法
1.1 实验材料与试剂
1.1.1 材料与试剂
番茄种子由东方种业公司赠予。该种子经过检测为无菌种子,可以进行除害处理模拟实验。
PCR 试 剂,如 Loading buffer、d NTP、r Taq、RNase free dd H2O均购自大连宝生物工程有限公司,引物mm 5 f和mm 5 r由大连宝生物工程有限公司合成。新型植物基因组DNA提取试剂盒购自北京天根生化科技有限公司,营养琼脂(NA)购自北京陆桥生物技术有限责任公司。
1.1.2 仪器与设备
PCR扩增仪购自ABI公司,型号为VERITI;电泳仪购自北京六一仪器厂,型号为DYY-12 C;凝胶成像分析系统购自美国UVP公司,型号为GeIDoc-It 310;人工气候箱型号为A 1000。
1.1.3 处理液的配制
7种药剂处理液现用现配,配制方法如下:
Na3PO4:40 m L的dd H2O 中加入3.2,4.0,4.8 g的磷酸三钠固体粉末,充分搅拌使其溶解,分别制得8%、10%、12%的Na3PO4处理液。
Ca(Cl O)2:40 m L的dd H2O 中加入0.4,0.6,0.8 g的次氯酸钙固体粉末,充分搅拌使其溶解,分别制得1%、1.5%、2%的Ca(ClO)2处理液。
HCl:向40 m L的dd H2O滴加浓盐酸和氢氧化钠调节p H 至1.5、2.0和2.5,配制处理液。
K2Mn O4:40 m L的dd H2O 中加入0.4,0.6,0.8 g的高锰酸钾固体粉末,充分搅拌使其溶解,分别制得1%、1.5%、2%的 K2Mn O4处理液。
甲醛:40 m L的dd H2O 中加入400,267,200μL的甲醛,充分混匀,分别制得甲醛100倍液、150倍液和200倍液。
苏纳米:40 m L的dd H2O中加入240,320,480,600μL的苏纳米溶液,充分混匀,分别制得0.6%、0.8%、1.2%和1.5%的苏纳米处理液。
二氯异氰尿酸钠:40 m L的dd H2O中加入0.1,0.08,0.067,0.057 g的二氯异氰尿酸钠固体粉末,充分搅拌使其溶解,分别制得二氯异氰尿酸钠400倍液、500倍液、600倍液和700倍液。
1.1.4 种子处理时间
1.2 实验方法
1.2.1 模拟种子带菌
1)菌液的制备:挑取活化的PST标准菌株在NA培养基上划线,28℃培养箱中培养7 d。挑取培养的单菌落进行PCR验证。将菌落从NA培养基上冲下配制菌悬液(28℃,180 r/min,过夜),测定600 nm下的吸光值。然后进行菌落计数,计算原菌液浓度。
2)浸种:选取10 000粒番茄种子,用次氯酸钠表面消毒1 min,无菌水清洗3次,阴干后浸泡于浓度为1×108cfu/m L的菌悬液中过夜,使细菌附着于番茄种子表面[18]。待种子阴干后进行PCR检测和平板检验。

表1 除害处理药剂的处理时间
3)检测:挑选300粒番茄种子,平均分成3份,作为阳性对照的3个重复;另外,挑取无菌种子100粒,作为空白对照。将种子分别浸泡于40 m L的生理盐水中,并加入40μL终浓度为100 mg/L的吐温-20,4℃浸泡过夜;次日,180 r/min摇床上处理30 min后将浸出液滤出于一个新的50 m L离心管中,10 000/min离心30 min收集沉渣;用300μL的生理盐水溶解沉渣,1 000 r/min离心3 min,收集上清;12 000 r/min离心5 min,去上清后用400μL生理盐水溶解沉淀,即为供试菌液。提取供试菌液的基因组DNA;同时,将供试菌液稀释为10-3、10-4和10-5后均匀涂布于NA平板上培养。
1.2.2 带菌种子处理
带菌种子制备完成后,用1.1.3所示的7种药剂对番茄种子进行振荡浸泡处理。处理时间如表1所示。处理结束后,用灭菌纱布过滤掉浸泡种子的处理液,无菌水冲洗,将清洗过的种子阴干以备对除害处理效果的检验。检验方法同3)。
1.2.3 菌液PCR检测
(6)在数组W=[we,r]w×r中,改变调度过程中工序在机床上的加工顺序,以生成工序在机床上的加工顺序相邻解。
应用新型植物基因组DNA提取试剂盒进行菌液基因组DNA的提取。利用特异性引物 mm 5 f:GAACGAGCTGAAGGAAGACA和 mm 5 r:CAGCCTGGTTAGTCTGGTTA进行PCR扩增。
扩增体系25μL,其中10×PCR buffer 2.5μL,d NTP(10 mmol/L)1μL,DNA模板3μL,上下游引物(10 mmol/L)各1μL,r Taq酶(5 U/μL)0.5μL,dd H2O 16μL。PCR扩增条件为:第一阶段,95℃预变性5 min;第二阶段,95℃变性30 s,57℃复性30 s,72℃延伸40 s,共35个循环;第三阶段,72℃延伸10 min。扩增产物进行2%的琼脂糖凝胶电泳分析,并利用凝胶自动成像仪检测拍照。
1.2.4 平板活菌检测
将供试菌液梯度稀释为10-1、10-2和10-3,均匀涂布于NA培养基上,28℃培养箱中培养7 d,冲洗平板,稀释菌液后,进行菌液PCR扩增。PCR扩增体系和条件同1.2.3。
1.2.5 药剂除害处理对番茄种子发芽率的影响
采用纸床法进行发芽率实验,统计各药剂(时间和浓度梯度组合)对种子发芽率的影响。首先,在洗净灭菌的培养皿里放入2层灭菌的滤纸,充分吸湿,沥去多余水分;将100粒番茄种子直接摆放于滤纸上,置于25℃、湿度80%的人工气候箱中进行发芽实验。分别在第5天和第14天进行发芽率统计,观察各药剂对种子发芽率的影响。
2 结 果
2.1 模拟种子带菌结果
将番茄种子浸泡于 OD600=1.028,浓度为1×108cfu/m L的菌悬液中过夜,待种子阴干后进行菌液DNA的PCR检测以及目标菌的分离与检测,检测结果如图1和图2所示。在基因组DNA PCR结果图和菌液PCR结果图中,阳性对照在532 bp处均有条带,空白对照均无条带出现,而3次重复实验中均出现与阳性对照相同大小的条带。证明该实验具有重复性,结果可靠,说明番茄种子已完成模拟带菌,可进行后续除害处理效果检测的实验。

图1 基因组DNA PCR检测结果

图2 菌液PCR检测结果
2.2 种子除害处理结果
本研究选择磷酸三钠、次氯酸钙、苏纳米、甲醛、盐酸、高锰酸钾和二氯异氰尿酸钠作为除害处理的药剂。根据这些药剂对种子的浸渗能力以及除害效果,分别设计了从10 min到60 min等不同的处理时间。
用这7种药剂处理带菌的番茄种子,希望筛选出最佳的处理时间和处理浓度的组合。通过PCR技术和活菌分离技术检测药剂的除害效果,并将这7种药剂除害效果总结于表2。从表2可以看出,这7种药剂的最佳除害效果的浓度和时间的组合。3次重复结果一致具有较好的重复性。

表2 携带番茄细菌性叶斑病菌的番茄种子的除害结果
从表2可以看出,磷酸三钠(8%、10%、12%)处理过的带菌种子的带菌率随着药剂浓度的升高和处理时间的延长表现为下降趋势。8%的磷酸三钠处理30 min即可达到除害的效果,10%和12%的各个处理时间也得到同样的结论。
次氯酸钙(1%、1.5%、2%)处理过的带菌种子的带菌率随着药剂浓度的升高和处理时间的延长表现为下降趋势。1%的次氯酸钙处理20 min即可得到同8%磷酸三钠处理30 min时相同的效果,这与翁晓梅等[11]的研究结果一致。
盐酸的除害结果发现,其可以抑制菌类生长或消除番茄细菌性叶斑病菌,同样,翁晓梅等也证实了这一点。但本实验的盐酸是以p H值的高低为分类标准,与翁晓梅等以浓度高低(1%、5%)为分类标准不同。带菌量随着酸度的增强而减少,但当p H=1.5时,处理30 min后,所提取的菌液DNA的PCR结果与菌落PCR结果均为阳性,而处理10 min和20 min时则是阴性。
甲醛(100倍液、150倍液、200倍液)的处理与前人的研究结果有差异。本研究发现,甲醛200倍液处理30 min即可达到除害的效果;而翁晓梅等研究结果是,当甲醛稀释100倍的时候对甜瓜叶斑病菌才具有良好的除害效果,这是因为种子种类以及染菌量存在差异。
苏纳米(0.6%、0.8%、1.2%、1.5%)处理过的带菌种子的带菌率随着药剂浓度的升高和处理时间的延长表现为下降趋势,1.5%的苏纳米处理种子20 min即可达到除害的效果。
高锰酸钾的除害效果表明,高锰酸钾(1%、1.5%、2%)处理过的带菌种子的带菌率随着药剂浓度的升高和处理时间的延长呈下降趋势。从表2中菌液DNA的PCR结果发现,1.0%的高猛酸钾处理种子30 min时为阳性,而菌落PCR结果却为阴性。说明高锰酸钾的最佳除害浓度为1.0%,时间为20 min。
二氯异氰脲酸钠的400、500倍液及600倍液处理带菌番茄种子30,40,50 min时,菌液DNA的PCR结果和菌落PCR结果均为阴性,说明二氯异氰脲酸钠具有很好的除害效果。为了找到最优的处理浓度和时间的组合,本研究又将二氯异氰脲酸钠稀释至700倍,并且降低600倍液的处理时间。结果发现,稀释至700倍的二氯异氰脲酸钠处理带菌番茄种子40 min时,2种检测结果均为阴性,即除害效果最佳,因此稀释至700倍处理种子40 min的组合为最佳处理浓度和时间。
2.3 除害处理后番茄种子的发芽率统计结果
应用纸床法对不同浓度的7种药剂处理过的番茄种子进行发芽率的统计,100粒/皿,每个处理重复3次。分别在第5天和第14天进行发芽率统计,表3中统计的发芽率均为3次重复的平均数。这63个处理的平均发芽率均在87%~99%之间,结果如表3所示。最低的是8%的磷酸三钠处理30 min时的发芽率,最高的是600倍的二氯异氰尿酸钠处理10 min、700倍的二氯异氰尿酸钠处理30,40 min时的发芽率。这63个处理的平均发芽率都高于带菌种子的平均发芽率(84%),说明这7种药剂的处理对种子的发芽率影响不大。
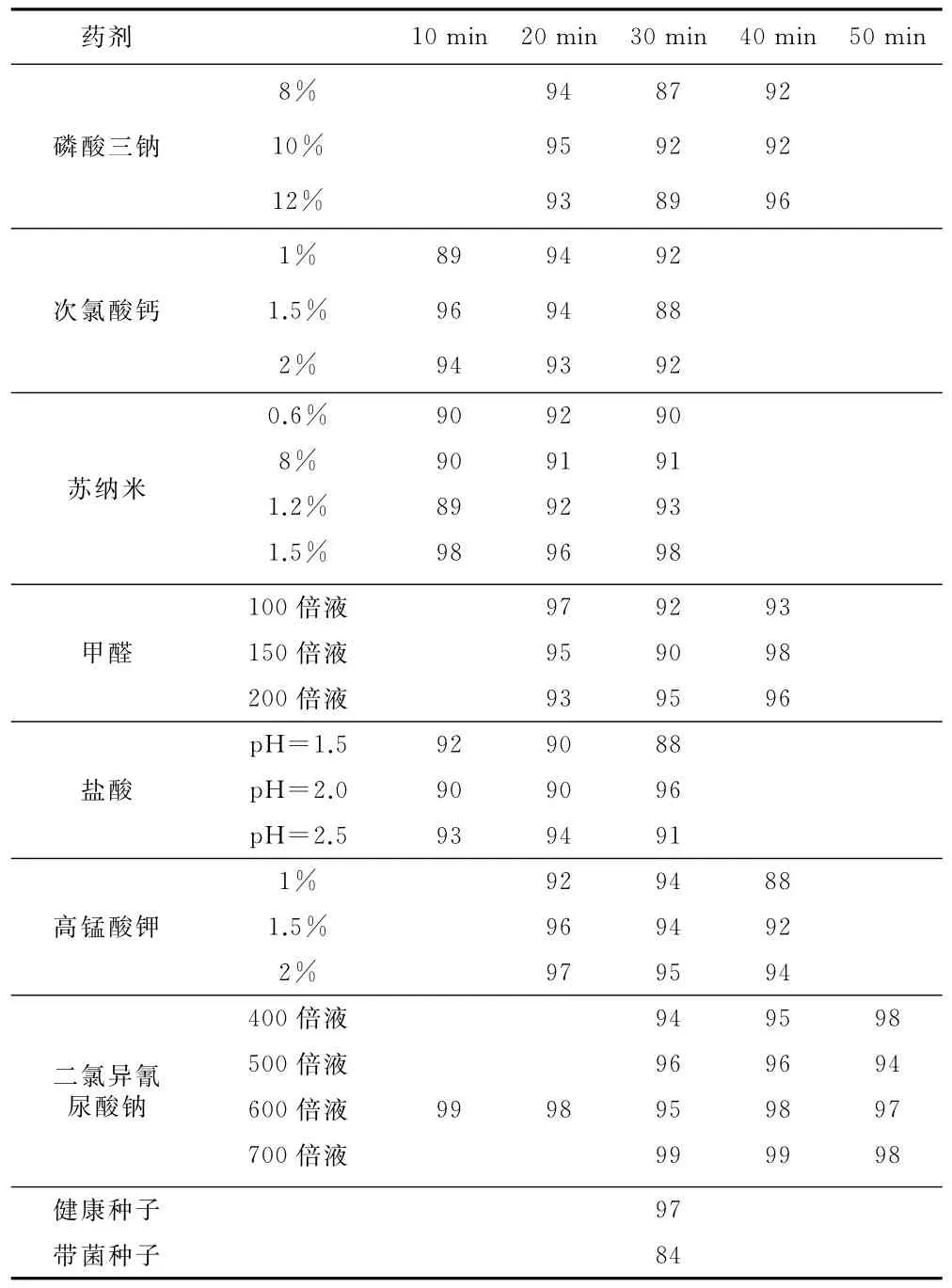
表3 不同药剂处理下番茄种子的发芽率统计(%)
如表3所示,磷酸三钠、次氯酸钙、苏纳米、甲醛、盐酸、高锰酸钾和二氯异氰尿酸钠处理过的带菌种子发芽率分别为87%~96%、88%~96%、89%~98%、90%~98%、88%~96%、88%~97%和94%~99%,每种药剂处理的平均发芽率分别是92.22%、92.44%、92.5%、94.33%、91.55%、93.55%和96.85%。其中,二氯异氰脲酸钠的发芽率最高(96.85%),而盐酸的最低(91.55%),且均在健康种子(97%)和带菌种子(84%)的发芽率之间,说明药剂处理对种子的发芽率影响属正常范围。表明这7种药剂可以应用于除害处理。
3 讨 论
与前人研究相比,本研究选择除害试剂较多,所选的7种药剂均容易获得且价格低廉;处理液的配制既方便快捷,又不会产生有害物质;而且实验过程简单易行;从实验结果看,本实验所摸索出的除害技术是合理的,结果可靠且具有可重复性。综上,本实验对番茄种子除害技术的研究为以后的相关研究奠定了一定的基础,可作为参考应用于实践。
这7种药剂应用于除害技术的研究中,基本上符合浓度越高、处理时间越长,其除害的效果越好的规律,即种子的带菌率随着浓度的增高、时间的延长呈现下降的趋势。但是也有例外,如盐酸处理的带菌种子,在p H=1.5的处理条件下,种子的带菌率并未呈现如上规律,而是随时间的延长呈现上升的趋势。本实验对苏纳米的除害研究结果与前人不同,前人一般用0.6%的苏纳米即可达到除害的效果,而本实验发现苏纳米的浓度达到1.5%时才可以有效的除害。出现这些结果的原因还需要更深层次的探讨与研究,希望本实验的结论能为今后深入的研究提供依据。
从生产实践的角度看,选择除害药剂时,药剂的效果固然重要,但其对种子发芽率的影响也是研究者应该关注的重点。要选择既具有良好的除害效果,又对种子发芽率影响小的药剂。通过发芽率统计实验,证明本研究中所选择的7种药剂对种子发芽率的影响均较小,均可作为除害的药剂应用于生产实践中。
[1]赵廷昌,于莉,孙福在,等.番茄细菌性斑点病及其防治[J].植物保护,1999,25(4):56.
[2]Yunis H,Bashna Y,Okon Y,et al.Chemical control of bacterial speck of tomato and its effect On tomato yield[J].Hassadeh,1980,60(5):1 004-1 007.
[3]陈鹤生.种子病害简明教程[M].北京:中国农业出版社,1983:56.
[4]Garwal,V.K.and Sinclair,.J.B.Principles of seed pathology[J].Boca Raton,Florida,CRC Press.1987,64(3):1 002.
[5]MeGee,D.C.World phytosanitary system:problems and solutions in D.C.McGee(Ed.)Plant pathogens and the worldwide movement of seeds[J].St Paul,Minnesota,APS Press.1997,42(6):987-992.
[6]Seattler,A.W.The need for detection assay.in A.W.Saettler,N.W.Shcaad and D.A.Roth(Eds)Detection of bacteria in seed and other planting material[J].St Pual,Minnesota,APS Press,1989,54(3):1-2.
[7]Okechukwu R U,Okechukwu O C.Seed to plant transmission of Xanthomonas campestris pv.vignicloa isolates in cowpea[J].African Journal of Agricultural Research,2010,5(6):431-435.
[8]宋顺华,吴萍,孟淑春,等.种子处理对西瓜细菌性果斑病的防治效果[J].中国瓜菜,2013,26(3):5-9.
[9]翁晓梅,张昕,李国英,等.甜瓜细菌性斑点病种子带菌及种子处理试验研究[J].石河子大学学报(自然科学版),2004,22(5):95-97.
[10]吴国平,毛忠良,姚悦梅,等.福尔马林浸种对葫芦种传病害和种子活力的影响[J].江西农业学报,2009,21(8):101-102.
[11]孙成虎,尚庆茂,李平兰,等.甘蓝种带真菌检测及浸种处理效果研究[J].长江蔬菜,2006,8(2):53-54.
[12]宋顺华,吴萍,孟淑春,等.种子处理对西瓜细菌性果斑病的防治效果[J].中国瓜菜,2013,26(3):5-9.
[13]赵秋菊,寇明明,罗付青,等.种子处理对西瓜细菌性果腐病种子带菌的影响[J].中国种业,2008,12(5):56-57.
[14]吴学宏,刘西莉,刘鹏飞,等.西瓜种子带菌检测及杀菌剂消毒处理效果[J].农药学学报,2003,5(3):39-44.
[15]任毓忠,李晖,李国英,等.哈密瓜细菌性果斑病种子带菌的PCR检测[J].新疆农业科学,2004,41(5):329-332.
[16]刘西莉,牧丽丹,王红梅,等.红花种子带菌检测及药剂消毒处理[J].植物保护,2003,29(6):49-51.
[17]杨力钢,黄中乔,刘鹏飞,等.甘草种子带菌检测及药剂消毒处理效果[J].植物保护,2006,32(5):84-87.
[18]Hebbar K P,Davey A G,Merrin J,et al.Pseudomonas cepacia,a potential suppressor of maize soil-borne diseasesseed inoculation and maize root colonization[J].Soil Biology and Biochemistry,1992,24(10):999-1 007.
