PEG-6000模拟干旱胁迫对雪菊种子的影响
2016-01-16王琪琪陈安新
王琪琪, 秦 勇, 陈安新
(1.新疆农业大学 林学与园艺学院, 乌鲁木齐830052;2.新疆生命核力高科股份有限公司, 乌鲁木齐830000)
雪菊(Coreopsis tinctoria Nutt.)是一年生草本植物,属于菊科金鸡菊属的两色金鸡菊,生长在海拔3 000 m左右的昆仑山系,原产北美,目前在新疆和田地区得到广泛栽培[1]。雪菊具有清热解毒、活血化瘀、健脾养胃等功效,花可当茶饮用,对治疗燥热、高血压、心慌、肠胃不适、食欲不振、痢疾等疾病有一定效果,是维吾尔族常用药材之一[2]。随着雪菊医疗保健作用的逐步发现,其需求量剧增。为了满足市场需求,扩大种植面积提高产量,进行规模化引种栽培是一条必行之路。
新疆位于中国西北边陲,面积1.66×106km2。阿尔泰山、昆仑山、阿尔金山等山脉组成的包围结构致使海洋气流很难到达深居内陆的新疆,形成明显的温带大陆性气候。新疆昼夜温差较大,降水量少,年平均降水量150 mm左右,气候比较干燥。新疆大部分地区属于干旱半干旱气候,所以研究干旱胁迫对雪菊生长的影响是必不可少的。
PEG是一种比较好的渗透调节剂,已经有很多关于PEG模拟植物干旱逆境来研究植物抗旱机制的成果,尤其是种子渗透调节是目前种子生理学研究的热点之一[3],研究结果表明,PEG模拟植物干旱逆境是可行的[4-6]。国内外关于通过用PEG处理种子来探究其抗旱能力方面的研究有很多[7-9],据统计,目前人们共用PEG渗透调节处理过70多种植物种子[10],但对于雪菊种子的干旱胁迫处理还未曾涉及。本试验旨在通过研究不同干旱逆境对雪菊种子萌发指标、幼苗生长指标的影响,更好地了解雪菊种子萌发和幼苗生理特性与干旱胁迫之间的关系,为今后探究雪菊种子的抗旱机制提供参考。
1 材料与方法
1.1 实验材料
实验材料为雪菊种子,于2014年10月采自新疆和田地区皮山县克里阳乡,装入纸袋常温保存。
1.2 实验方法
取成熟、饱满、无破损的雪菊种子,30粒为1单元,3个单元为1组,种子用1%的次氯酸钠溶液消毒10 min后用蒸馏水冲洗干净,放在直径9 cm、垫有2层滤纸的培养皿中,用不同浓度(0%、5%、10%、15%、20%、25%)的PEG-6000处理种子,每个培养皿对应的不同浓度PEG-6000处理溶液各加5 m L,用封口膜密封防止水分蒸发,然后放在人工智能培养箱内进行培养,温度25℃,光照12 h/d。每3 d换1次液体,以露白作为种子发芽标准,每天观察种子的发芽数(霉烂种子记为无活力的种子),观察种子发芽生长情况,连续培养14 d。连续4 d不萌发记为实验结束。每一重复中随机各取10株,以便每天定时记录测定其胚根和胚芽长度,并计算平均值,以其平均值作为胚根、胚芽长度指标。实验进行到14 d时称其鲜重,先用蒸馏水冲洗干净,经吸水纸吸干表面水分后,称取10株幼苗鲜重。
配制PEG-6000的系列溶液,根据 Miche等[11]的公式配制 PEG-6000溶液(0%、5%、10%、15%、20%、25% ),渗 透 压 依 次 为0,-0.2 5,-0.5 1,-0.7 7,-1.02,-1.28 MPa;
Ψs=-(1.18×10-2)C- (1.18×10-4)C2+(2.6 7×10-4)CT+(8.39×10-7)C2T;
式中 Ψs是溶液的渗透势(bar);1 bar=0.1 MPa;C 是PEG-6000溶液的浓度(g/kg H2O);T 是溶液的温度(25℃)。
萌发抗旱指数参考王赞等[12]的方法计算。公式如下:
萌发抗旱指数(GDRI)=渗透胁迫下的萌发指数/对照萌发指数;
萌发指数=(1.00)nd 2+(0.75)nd 4+(0.50)nd 6+(0.25)nd 8;式中nd 2,nd 4,nd 6,nd 8分别为第2、4、6、8天的种子发芽率,1.00,0.75,0.50,0.25分别为与其对应的相关抗旱系数。
相关公式:
发芽势(%)=规定时间内(3 d)正常发芽的种子/供试种子总数×100%;
发芽率(%)=发芽终期全部正常发芽的种子数/供试种子总数×100%;
发芽指数(GI)=∑G t/D t;
活力指数(VI)=GI×S;
式中:G t为浸种后t日的发芽数;D t为相应的发芽日数;S为10株幼苗鲜重(mg)。
1.3 数据处理
采用SPSS统计软件和Excel对所得数据进行统计分析。
2 结果与分析
2.1 PEG-6000对雪菊种子萌发的影响

图1 不同PEG-6000浓度下雪菊种子的日相对萌发率
如图1所示,PEG浓度影响雪菊种子萌发时间及萌发高峰峰值的大小。在发芽实验第2天,ck和5%PEG-6000处理的雪菊种子开始萌发,在第3天达到最大日相对萌发率,分别为66.67%和64.44%,为种子萌发曲线的高峰期;10%和15%PEG-6000处理的种子在第3天开始萌发,且在当天也分别达到了43.33%和32.22%的日相对萌发率;20%PEG-6000处理的种子在第4天开始萌发,并在当天达到了15.55%的日相对萌发率。与ck相比,随着PEG-6000浓度的增加,雪菊种子延迟了露白的时间,同时也降低最大萌发高峰峰值。实验观察到第14天时,25%PEG-6000处理的种子未见萌发。
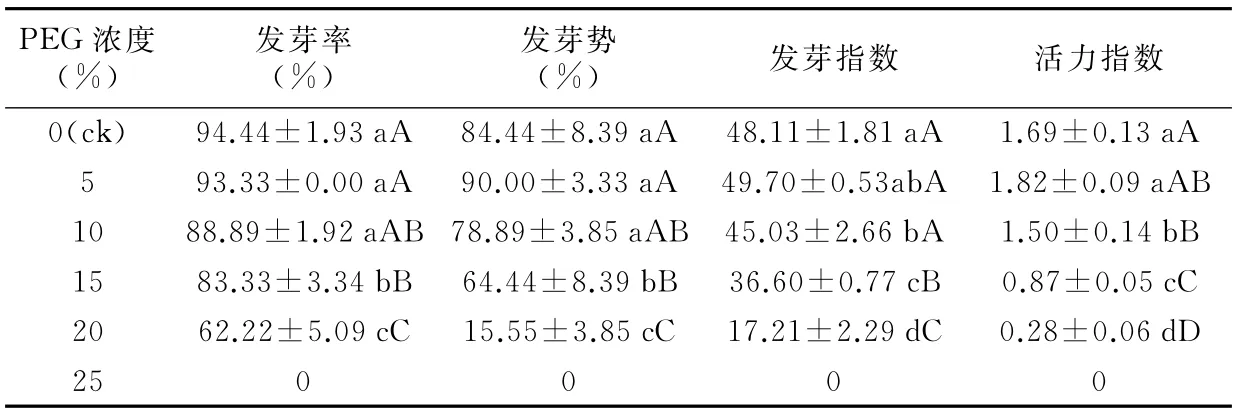
表1 不同PEG-6000浓度处理下雪菊种子的萌发指标
2.2 PEG-6000对雪菊种子发芽率和发芽势的影响
发芽率和发芽势是衡量种子发芽能力的主要指标,而种子的发芽能力在不同胁迫条件下会发生变化。如表1所示,雪菊种子的发芽率随着PEG-6000浓度的增加呈下降的趋势,而种子的发芽势则是随着PEG-6000浓度的增加呈先升高后下降的趋势,5%浓度的PEG-6000处理下达到最大值。分析表明,发芽率和发芽势在不同浓度PEG-6000处理下均存在差异,与ck相比,5%和10%浓度的PEG-6000处理下的雪菊种子的发芽率和发芽势差异不显著(p<0.05);而15%和20%浓度的PEG-6000处理雪菊种子的发芽率和发芽势显著或极显著低于ck。25%浓度的PEG-6000处理雪菊种子完全不萌发。由此可见,PEG-6000模拟干旱胁迫不仅抑制了雪菊种子萌发,而且降低了种子的萌发力,并且PEG-6000浓度越高,其抑制能力越大。
2.3 PEG-6000对雪菊种子发芽指数和活力指数的影响
发芽指数和活力指数分别反映了幼苗生长情况和种子活力水平。由表1可知,雪菊种子的发芽指数和活力指数随着PEG浓度的增加都呈先升高后下降的趋势,均在5%浓度的PEG-6000处理下达到最大。雪菊种子在不同浓度PEG-6000处理下,其发芽指数和活力指数存在显著或极显著差异。雪菊种子发芽指数在5%与10%浓度PEG-6000处理之间差异不显著(p<0.05);而在15%与20%浓度PEG-6000处理之间差异显著(p<0.05)。雪菊种子活力指数在5%与10%浓度PEG-6000处理之间差异显著(p<0.05);而在15%与20%浓度PEG-6000处理之间差异极显著(p<0.01)。在5%浓度处理下的发芽指数和活力指数最高,说明5%PEG-6000浓度下雪菊种子的活力能够有效的提高,轻度的干旱胁迫有利于雪菊种子的萌发生长,中度及重度的干旱胁迫不利于雪菊种子的萌发生长。
2.4 PEG-6000对雪菊幼苗生长和抗旱指数的影响
不同干旱胁迫不仅对种子萌发有一定的影响,而且对其幼苗生长也有一定的影响。由表2可知,与ck相比,不同浓度的PEG-6000处理对雪菊种子萌发和幼苗生长影响的变化趋势基本相似。由图2可看出,随着时间的增加,雪菊种子胚根的生长速度由快变慢,随着PEG-6000浓度的增加,雪菊种子胚根的生长量先升高后降低,在种子萌发到第6、7天时,5%浓度PEG-6000处理的胚根长度大于ck,之后的生长速度与ck相似。从10%浓度PEG-6000处理开始,雪菊的各项生理指标均与ck呈极显著差异。随着PEG-6000浓度的增加,干旱胁迫的加剧,雪菊种子的萌发抗旱指数呈先升高后下降的趋势,在5%PEG处理条件下,抗旱指数达到最高,为1.18%,然后呈直线下降的走势(图3)。由此可见,高浓度的PEG-6000处理可以延缓雪菊幼苗的生长,且随着浓度的升高,抑制作用越大;低浓度的PEG-6000处理能促进雪菊幼苗生长。
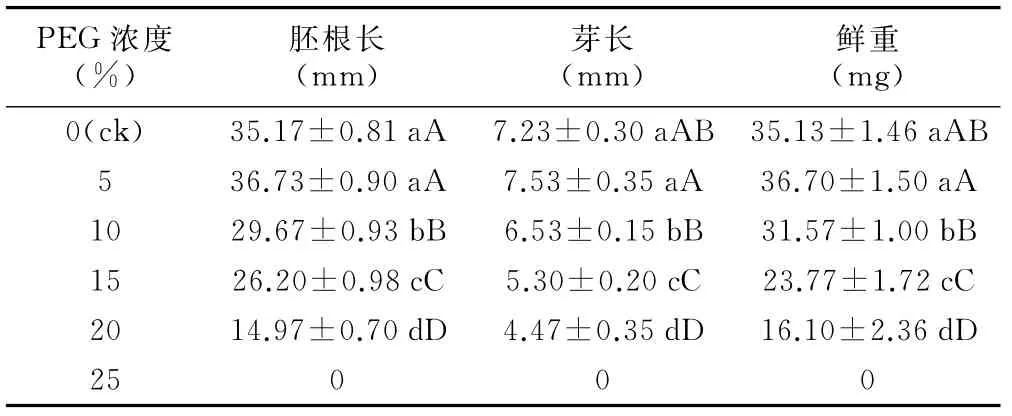
表2 不同PEG-6000浓度对雪菊幼苗生长的影响
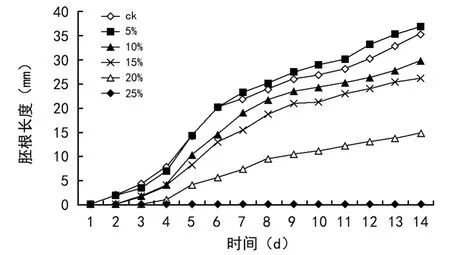
图2 不同PEG-6000浓度对雪菊胚根生长的影响
2.5 雪菊种子打破逆境后的复萌发
25%浓度PEG-6000处理的雪菊种子在观察到第14天时也未见萌发。25%浓度处理的种子用蒸馏水冲洗后用ck处理的方法进行复萌发试验。由图4可看出,胁迫解除后第2天,雪菊种子开始萌发,且首次达到其最大日相对萌发率(70%);胁迫解除后的第4天,雪菊种子的萌发数达到最大值,其最终萌发率为86.67%。由此可以看出,胁迫解除后雪菊种子遇到充足的水分便恢复了萌发,且种子萌发整齐,这是雪菊种子打破干旱条件后的一种适应环境的表现,也是雪菊种子生活在高海拔地区的生存策略之一。

图3 干旱胁迫下雪菊的萌发抗旱指数

图4 25%浓度PEG-6000处理复萌发后雪菊种子日萌发数和日相对萌发率
PEG-6000模拟干旱条件用作种子渗透调节处理是当前生理学研究的一个热点[3]。本实验用PEG-6000模拟干旱条件,研究干旱胁迫对雪菊种子萌发和幼苗生长的影响,结果表明,PEG-6000模拟干旱逆境不仅延迟了雪菊种子露白的时间,同时也降低最大萌发高峰峰值;雪菊种子的发芽率、发芽势、发芽指数和活力指数曲线均是随着PEG-6000浓度增加而出现先升高后降低的变化;雪菊种子的胚根长度、胚芽长度、鲜重和抗旱指标也随着PEG-6000浓度的升高而降低,轻度干旱有利于雪菊种子的萌发和幼苗的生长;当PEG浓度达25%时,雪菊种子不发芽,且种子复萌发恢复性较强、整齐度较高,这一现象的生态学意义在于雪菊可在干旱地区生存。这一结果与李文鹤等[13]对野菊种子和张凤银等[14]对宿根天人菊种子的研究结果“轻度干旱有利于种子的萌发生长,中度或重度干旱不利于种子的萌发生长”相似。
[1]新疆植物志编辑委员会.新疆植物志(第5卷)[M].乌鲁木齐:新疆科技卫生出版社,1999:93.
[2]中国科学院中国植物志编辑委员会.中国植物志(第75卷)[M].北京:科学出版社,1979:365.
[3]郑光华.种子生理研究[M].北京:科学出版社,2004:405-414.
[4]任永波,吴中军,段拥军.作物抗旱研究方法与抗旱性鉴定指标[J].西昌农业高等专科学校学报,2001,15(1):1-5.
[5]李广酶,唐顺连,商振清,等.渗透胁迫对玉米幼苗保护酶系统的影响[J].河北农业大学学报,1994,17(2):1-5.
[6]宋志荣,刘明月,刘湘桂.干旱对辣椒不同生育期生理机能的影响[J].湖南农业科学,2002(2):14-16.
[7]Nathawat N S Nair J S KumawatSM,et al.Effect of seed soaking with thjols on the antioxidant enzymes and photosystem activities in wheat subjected to water stress[J].Bjojogia plantanm,2007,51(1):93-97.
[8]祁娟,徐柱,马玉宝,等.披碱草属六种野生牧草苗期抗旱胁迫的生理变化[J].中国草地学报,2008,30(5):18-24.
[9]程嘉翎,段建丽,王娜,等.2 oorx聚乙二醇模拟水分胁迫对桑树种子萌发和生理的影响[J].安徽农业科学,34(24):6 420-6 422.
[10]王慧超,何士敏,李昌满.PEG渗调处理对植物种子的影响[J].安徽农业科学,2008,36(6):2 224-2 226.
[11]Michel B.E.,Kaufmann M.R.The oamotit potential of polyethylene glycol 6000[J].Plant Physiology,1973(51):914-916.
[12]王赞,李源,吴欣明,等.PEG渗透胁迫下鸭茅种子萌发特性及抗旱性鉴定[J].中国草地学报,2008,30(1):50-55.
[13]李文鹤,何淼,卓丽环.PEG-6000处理对野菊种子萌发期抗旱性的影响[J].种子,2010,29(11):51-54.
[14]张凤银,陈禅友,胡志辉.PEG-6000胁迫对宿根天人菊种子萌发及幼苗生理特性的影响[J].西北农林科技大学学报(自然科学版),2014,42(1):133-135.
