莲瓣兰大雪素SEP 1基因克隆和表达的研究
2016-01-16张雪梅赵银河
张雪梅, 赵 婧, 赵银河
(云南农业大学作物种质创新与可持续利用重点实验室和工程中心, 昆明650201)
全球开花植物已知有250 000多种,在陆地生态系统中占有明显的优势。花器官是植物生殖过程中的重要的器官,已经成为进化论者和生态学家的研究焦点。对授粉方式的适应,花器官发生了巨大变化,有利于对被子植物花器官进化的进一步了解。
开花是高等植物从营养生长转向生殖生长的一个重要过程,即受外界环境因素的影响,又受内在基因的调控。研究发现MADS-box基因在花发育过程中起着重要作用[1]。随着花器官发育研究的深入,有关花器官发育的相关基因研究已取得了突破性的进展,这主要体现在通过对双子叶植物拟南芥和金鱼草的花同源异型突变体的研究发现上。这些双子叶植物的花由同心圆的四轮结构组成,从外向内依次为:第1轮萼片,第2轮花瓣,第3轮雄蕊,第4轮心皮[2]。花器官的同源异形突变体有一个共同的特征,即相邻两轮器官的发育同时受到影响。按照变异器官分布的空间顺序,这些突变体分为三类:第一类突变体的萼片转化为心皮,花瓣转化为雄蕊,导致花的组成由外至内依次为心皮-雄蕊-雄蕊-心皮;第二类突变体将花瓣转化为萼片,雄蕊转化为心皮,花组成为萼片-萼片-心皮-心皮;第三类突变体雄蕊转化为花瓣,心皮转化为类似萼片的结 构,花组成为萼片-花瓣-花瓣-萼 片[3-4]。通 过ABC功能基因的转化,无法使叶片转变成花器官,因此,植物从营养器官到花器官转变的过程还需要其他花发育相关基因的参与[2-3]。在寻找与 ABC类基因相互作用的蛋白时发现了这类SEPALLATA(SEP)基因。目前ABCE模型能成功地解释花器官发育,即A+E控制萼片的发育,A+B+E控制花瓣的发生,B+C+E控制雄蕊的发育,C+E决定心皮的发育[5]。另外,胚胎的发育由D和E类基因共同控制。在拟南芥中,E类基因有4个,SEPALLATA 1(SEP 1),SEP 2,SEP 3,SEP 4[3],它们在功能上是冗余的,在四轮花器官中都表达,单独突变sep 4没有明显的表型变化,如果sep 1、sep 2、sep 3、sep 4四类基因都突变,那么,所有花器官变成叶状的结构,表明拟南芥的SEP 1、SEP 2、SEP 3、SEP 4基因都与花发育相关。因此,拟南芥花器官的发育是受SEP类基因与A、B、C类基因的共同调控。SEP类转录因子不仅能够与B、C类蛋白共同作用,调控第三和第四轮花器官的发育,还能够与D类基因编码蛋白相互作用,调控胚珠的发育[3-4]。研究发现,sep 1、sep 2、sep 3 三重突变体具有和stk、shp 1、shp 2三突变体类似的胚珠结构,此外,STK和SHP等C类基因编码蛋白都可能和SEP-3-蛋白形成聚合体,这表明SEP 与D类基因共同决定胚珠的发育[3,5]。除了在拟南芥中的作用外,在其它植物中也发现SEP类基因在花发育的功能。
莲瓣兰(Cymbidium tortisepalum)是中国春兰的一个新品系,大雪素为滇兰四大名品之首,宽叶莲瓣素白花素心品种,并且于春节期间开花[6],俗称大素心,已有数百年的栽培历史,原产于滇西的部分地区[6]。本研究以莲瓣兰大雪素为实验材料,用RACE方法快速地克隆全长cDNA,从花的器官材料中分离开花相关SEP 1基因并进行克隆。通过对莲瓣兰大雪素SEP 1基因的初步研究,了解SEP 1基因是植物花器官调控途径的一个重要因子。
1 材料与方法
1.1 材 料
1)所采用材料为莲瓣兰大雪素(Cymbidium tortisepalum),是中国兰花中的优秀品种,也是滇兰莲瓣兰中的一颗明珠,是莲瓣兰代表品种。它盛开在元旦春节花,它的花枝高挺出架,洁白的花朵显得格外清雅、素净,具有暗香[9]。
2)必要培养液的配置。200 m L LB培养液的配制:2 g胰蛋白胨、1 g酵母提取物、1 g NaCl(p H=7),若配制固体培养基则加3 g琼脂。
3)实验设备。计算机、PCR仪、电泳槽、离心机、振荡床、超净工作台、恒温培养箱、冰箱、灭菌锅、烘箱、移液设备、容器、刮子等。
1.2 方 法
1.2.1 RNA的提取
选用 TransZol Plant(TransGen Biotech,Beijing,code#ET 121-01)提取大雪素花器官的RNA,严格按照试剂盒进行。
1.2.2 特异性引物设计
3′-RACE CDC Primer:5-AAGCAGTGGTATCAACGCAGAGTAC(T)30 VN-3
SEP-F 5-TTGAAAAGAGAGTAAGAGATGGGA-3
SEP-R 5-AACTTCTGATTTGCCCCCC-3
1.2.3 cDNA的合成
按SMART RACE c DNA Amplication Kit操作流程进行。3’SMART-RACE PCR加入以下试剂于灭菌的PCR反应管中:Total RNA,2μg;10×Advantage PCR Buffer,5μL;d NTP mix(10 mmol/L),4μL;Primers(10μmol/L),各0.75μL;Advantage 2 Polymerase Mix,2μL;dd H2O 17.75μL。混合以上试剂,短暂离心,将反应管放在预热的PCR仪上,按下列程序进行循环:35的循环;94℃×3 min 30 s,94℃×20 s,58℃×30 s,72℃×1 min,72℃×7 min,4℃×∞循环结束后,取3μL样品在1%琼脂糖凝胶上电泳,检测合成情况。
1.2.4 电泳检测,割胶回收目的片段
取5μL的PCR产物进行克隆,克隆方法参照文献[7],随机筛选白色菌落,送北京华大基因公司进行测序。
1.2.5 SEP 1基因的表达
选用 TransZol Plant(TransGen Biotech,Beijing,code#ET 121-01)分别提取苞叶、花萼、花瓣,合蕊柱以及授粉后3天的合蕊柱的RNA,然后进行cDNA的合成。选用特异引物进行RT-PCR.,其引物序列如下:
SEP-F 5-ACGCATGTTGTAGGATACG-3
SEP-R 5-AACTTCTGATTTGCCCCCC-3
PCR反应条件与克隆该基因一样,反应终止取5止的PCR产物,用1.0%琼脂糖凝胶电泳分析。
2 结果与分析
2.1 RACE的结果
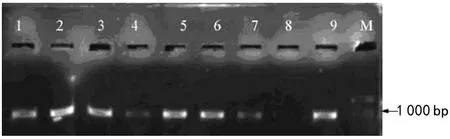
图1 SEP 1基因全长电泳结果
用转录组测序方法获得了SEP 1基因的序列,在NCBI http://www.ncbi.nlm.nih.gov/database 中 进行功能预测是SEP 1 5′片段序列。为了进一步研究这些基因的功能及表达特性,克隆了全长序列cDNA。对瓣兰大雪素不同发育时期的花原基、花蕾以及合蕊柱混合样品进行Total RNA的提取,琼脂糖凝胶电泳方法监测RNA的质量;以Total RNA为模板,按照RACE试剂盒的说明进行反转录后得到3′端和5′端cDNA模板,对3′端的cDNA模板进行特异引物和Outprimer进行PCR扩增,获得3′端片段,5′端与3′端的序列进行拼接,再一次进行全长cDNA的克隆,对菌液PCR进行扩增,见图1。
2.2 序列比对
通过测序获得了功能预测为SEP 1基因的全长cDNA。这个基因cDNA全长为1 047 bp,包含有编码框,207 bp的5′UTR和87 bp 3′UTR 的非翻译区,并具有olig(d T)的尾巴,具有完整的开放阅读框 (ORF)753 bp,编码250氨基酸的蛋白质,该基因序列从起始密码子ATG,如图2。从莲瓣兰大雪素中分离出来的SEP 1基因,是属于MADS-box基因。
2.3 SEP 1基因在各个花器官的表达
从图3可以看出,SEP 1基因除了授粉前合蕊柱和授粉后3 d合蕊柱,在其他各个花器官中都没有表达,包括包裹在花序外面的苞叶,而在授粉前的合蕊柱中表达量最高。

图2 SEP 1基因的核苷酸序列和编码的氨基酸序列

图3 SEP 1基因在各个花器官的表达
3 讨 论
本实验以莲瓣兰大雪素为材料分离出SEP 1基因,通过RACE方法快速克隆出全长cDNA,确定该基因为1 047 bp的全长cDNA序列,编码250个氨基酸。获得的序列及其推导的氨基酸序列在NCBI上进行Blastx分析,发现其编码的蛋白质含有典型的MADS结构域(MADS-MEF 2-like)和 K结构域,这两个保守结构域是MADS-box基因家族的典型特征,具有高度的保守性,与MADS-box家族中从其他植物提取出的SEP 1基因的同源性很高[3]。MADS-box 结构域在MADS-box蛋白因子的N末端,大约有60个氨基酸组成具有高度保守结构域,可以和特异DNA结合[4],因此,MADS-box 结构域具有 DNA结合和蛋白质二聚化的功能[5]。
SEP类基因属于E类基因,在拟南芥中已研究得比较清楚。用RACE方法从蝴蝶兰花葶和春兰中克隆并己经证明SEP基因参与花器官发育和植物开花的调控[8]。而从莲瓣兰大雪素中还没有研究过,本研究结果显示,该序列还与其他植物上克隆出来的SEP 1基因有很高的同源性[9]。在表达模式上,SEP 1在四轮中花器官中都表达,这与高等真双子植物中分离出来的SEP 1不一致,这也许与兰科比较复杂的花器官结构有关系,将为后续的研究提供基础,并且了解SEP 1在莲瓣兰大雪素中的调控。
虽然对花发育相关基因的研究已经有几十年,但是对于SEP基因功能的研究仍然存在着很多问题,在兰花上的研究更少见,并且兰花SEP 1基因的克隆以及SEP 1与开花相关基因、蛋白的作用关系还有待进一步研究,另外,SEP 1基因可以诱导开花,但其分子机制和在莲瓣兰花中的调控机制还有待研究。
[1]马辉,张智俊,罗淑萍.植物 MADS-box 基因研究进展[J].生物技术通报,2006(6):14-18.
[2]Coen ES,Meyerowitz EM.The war of whorls:Genetic interactions controlling flower development[J].Nature,1991,353:31-37.
[3]Theissen G.Development of floral organ identity:stories from the MADS house[J].Current Opinion in Plant Biology,2001,4:75-85.
[4]丛楠,程治军,万建民.控制花器官发育的ABCDE模型[J].中国农学通报,2007,23(7):124-127.
[5]Ditta G,Pinyopich A,Robles P,et al.The SEP 4 gene of Arabidopsis thaliana functions in floral organ and meristem identity[J].Curr Biol,2004,14:1 935-1 940.
[6]陈贵.云南名兰大、小雪素[J].中国花卉园艺,2001,17:45.
[7]赵银河,彭晟,周平,等.莲瓣兰大雪素SOC 1基因克隆和系统发育分析[J].种子,2015,34(5):1-5.
[8]袁秀云,蒋素华,田云芳,等.1个兰花 MADS-box 基因的克隆与表达分析[J].河南农业大学学报,2013,47(6):683-691.
[9]张则婷,李学宝.MADS-box 基因在植物发育中的功能[J].华中师范大学植物生理学通讯,2007,43(2):198-202.
