沉水樟组织培养技术研究
2016-01-16,,
, ,
(1.福建省林业科学研究院, 福建 福州 350012;2.国家林业局南方山地用材林培育重点实验室, 福建 福州 350012)
沉水樟(Cinnamomunmicranthum)别名水樟,是我国樟科樟属的经济树种,为我国大陆和台湾的间断分布种。长期以来对沉水樟资源的人为破坏,导致资源锐减,目前除福建建瓯万木林自然保护区分布有较大面积的沉水樟外,其余多被破坏殆尽,沉水樟种群已处于濒危状态,1982年被列为国家三级濒危保护植物[1]。沉水樟木材纹理通直,结构均匀细致,气味芳香,是优良的船舶、家具用材。植株可提取芳香油,主含黄樟油素,是重要的工业原料。沉水樟为树形高大雄伟、干形通直、枝叶繁茂的常绿乔木。由于沉水樟属自花授粉,雌雄花发育成熟期不一致,因而结实率很低,用作城市园林绿化树种时,这反而成了一个优点——可避免大量的落花落果,易于保持地面清洁。15年生沉水樟才能开花结果,果实在成熟前大量落果,果实成熟后其空壳率高达75%以上,种子多油、寿命短,难贮存,发芽率低[2]。
组织培养特点是繁殖速度快、繁殖后代整齐一致并能保持原有品种的优良性状,可在人工控制的条件下进行周年生产而不受自然环境中季节和恶劣天气的影响,可以克服沉水樟种子寿命短,难贮存,发芽率低等问题。因此,开展沉水樟组培技术研究具有重要意义。
国内仅见河南翟晓巧等《沉水樟体外植株再生体系的建立》和罗坤水等《沉水樟组织培养研究》的报道[3-4]。
1 材料与方法
1.1 材 料
取沉水樟小苗顶芽或半木质化枝条作为试验的外植体。
1.2 方 法
1.2.1 外植体表面灭菌
取沉水樟外植体经自来水冲洗15~20 min,再用洗涤粉溶液浸泡20~30 min,然后用自来水流水冲洗干净。在超净工作台上先用70%~75%酒精浸泡60 s,0.1%HgCl2消毒12~13 min,无菌水洗涤4次。剔除顶芽基部或茎段上下两端,保留长度约为1.5 cm的茎段,接种于预先配置好的外植体诱导培养基上[5]。
1.2.2 培养条件
外植体诱导试验采用暗培养;继代培养光照强度1 000~1 500 lx;生根培养光照强度从1 000~1 500 lx增加到炼苗光照2 000~5 000 lx。培养温度为(24±2)℃,光照时间为12 h/d。
1.3 试验设计
1.3.1 外植体诱导
外植体诱导培养基: 1) MS+BA 5.0 mg/L(以下生长调节剂浓度相同)+IBA 0.1+Vc (抗坏血酸)5 mg/L; 2) 改良MS+BA 5.0+IBA 0.1+Vc 5 mg/L。以上均附加白糖30 g/L(“田趣”牌,下同)和琼脂粉5.5 g/L,pH=6.0。每个处理接种30瓶(广口瓶规格200 mL),每瓶接种1个芽(或茎段),3次重复,培养30 d后观察污染和诱导率[6-10]。
1.3.2 继代培养基
继代培养基: 3) MS+BA 5.0+IBA 0.1+Vc 5 mg/L+B25 mg/L; 4) MS+BA 0.5+IBA 0.1+Vc 5 mg/L+B25 mg/L; 5) 改良MS+BA 5.0+IBA 0.1+Vc 5 mg/L+B25 mg/L; 6) 改良MS+BA 0.5+IBA 0.1+Vc 5 mg/L+B25 mg/L。以上基本均附加白糖30 g/L和琼脂粉5.5 g/L,pH=6.0。每个处理接种30瓶(广口瓶规格200 mL),每瓶接种3个茎芽,3次重复,培养30 d后观察增殖系数和茎芽高度[4-8]。
表1 沉水樟外植体诱导试验结果分析

培养基号基本培养基BA(mg/L)IBA(mg/L)平均诱导率(%)外植体表现1MS5.00.132.2±0.87a愈伤组织多、芽大、长得快2改良MS5.00.113.3±0.64b愈伤组织少、芽小、长得慢
表2 沉水樟增殖培养基试验结果分析
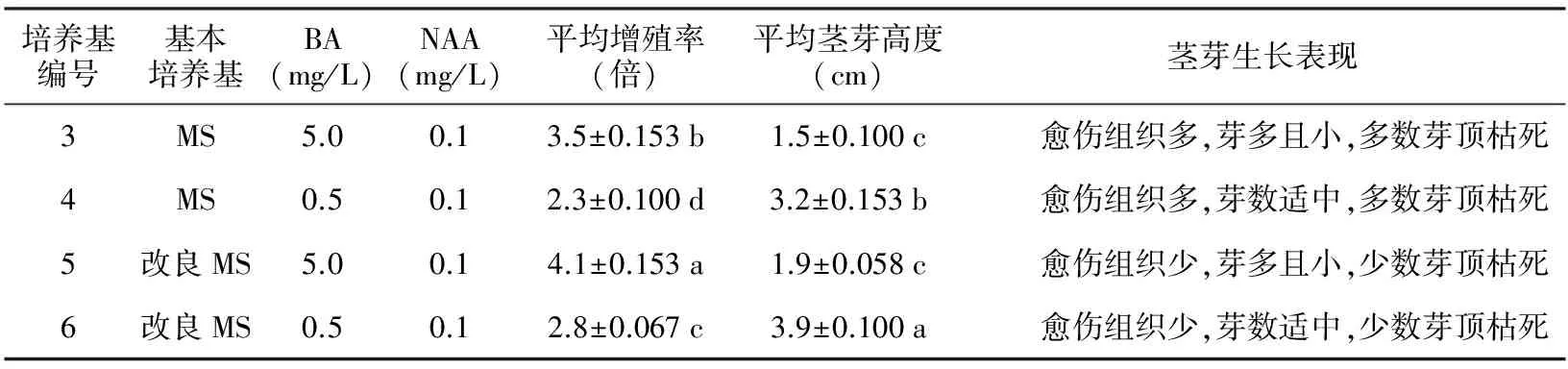
培养基编号基本培养基BA(mg/L)NAA(mg/L)平均增殖率(倍)平均茎芽高度(cm)茎芽生长表现3MS5.00.13.5±0.153b1.5±0.100c 愈伤组织多,芽多且小,多数芽顶枯死4MS0.50.12.3±0.100d3.2±0.153b 愈伤组织多,芽数适中,多数芽顶枯死5改良MS5.00.14.1±0.153a1.9±0.058c 愈伤组织少,芽多且小,少数芽顶枯死6改良MS0.50.12.8±0.067c3.9±0.100a 愈伤组织少,芽数适中,少数芽顶枯死
表3 沉水樟生根培养基试验结果分析
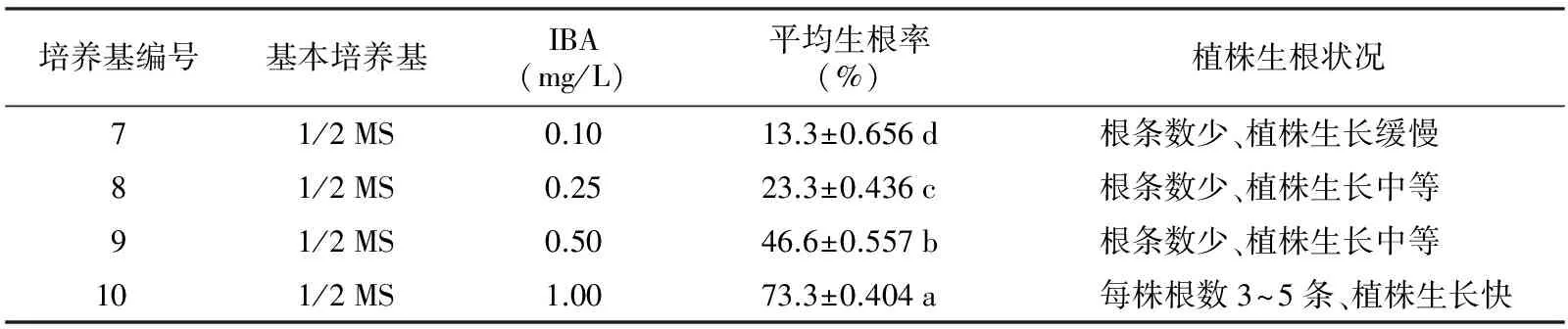
培养基编号基本培养基IBA(mg/L)平均生根率(%)植株生根状况71/2MS0.1013.3±0.656d 根条数少、植株生长缓慢81/2MS0.2523.3±0.436c 根条数少、植株生长中等91/2MS0.5046.6±0.557b 根条数少、植株生长中等101/2MS1.0073.3±0.404a 每株根数3~5条、植株生长快
1.3.3 生根培养基
生根基本培养基: 7) 1/2 MS+IBA 0.10; 8) 1/2 MS+IBA 0.25; 9) 1/2 MS+IBA 0.5; 10) 1/2 MS+IBA 1.0。以上基本培养基均添加白糖20 g/L和琼脂粉6.0 g/L,pH=6.0。每个处理接种10瓶,每瓶接种3个茎芽,3次重复。
1.3.4 炼 苗
经培养25 d后的生根苗,搬到玻璃温室炼苗15 d。光照度3 000~5 000 lx。生根培养40 d后观察统计根长、根数、生根率和高度茎芽。
1.3.5 移 栽
栽培基质采用红心土,装入营养袋,移入温室中,以0.2‰高锰酸钾溶液消毒土壤。炼苗后的沉水樟瓶苗,植株根部的培养基经自来水洗净,经70%甲基托布津可湿性粉剂1 200倍液浸泡15 min消毒后,移植于营养袋内,浇透水后立即用薄膜覆盖保湿。叶片每天喷水1次、2周后可揭开薄膜,并以后每天喷1~3次,并逐步过渡到每天1次。
试验数据采用SPSS 11.5软件进行单因素方差分析,置信度为0.05。
2 结果与分析
2.1 外植体表面灭菌
沉水樟外植体消毒比较困难,加上外植体容易褐化,外植体诱导困难,诱导成功率只有12%~35%。
2.2 外植体诱导培养基选择
沉水樟外植体诱导结果见表1。试验过程发现,外植体褐化严重,加入Vc 5 mg/L以减少褐化,并采用暗培养[6]。SPSS分析结果表明:培养基1号平均诱导率达到32.2%,培养基2号仅为13.3%,2个培养基之间具有显著差异。该2种培养基除了基本培养基不同,其余激素等添加物完全相同,所以选择培养基1号:MS+BA 5 mg/L+IBA 0.1 mg/L+Vc 5 mg/L作为外植体诱导基本培养基。
2.3 继代培养基选择
于无菌操作台上,切下外植体诱导出的新芽,淘汰老组织,接种到继代培养基,试验结果列于表2。分析结果表明:培养基3~6号的平均增殖率分别达到3.5倍(b)、2.3倍(d)、4.1倍(a)和2.8倍(c),四者之间具有显著差异;对于平均茎芽高度,4种培养基分别为1.5 cm(c)、3.2 cm(b)、1.9 cm(c)和3.9 cm(a),四者之间除了3号和5号培养基没有显著差异外,其余均有显著差异。由于培养基3、4号导致茎芽基部愈伤组织多而且茎顶枯死较多,因此不选择MS作为继代基本培养基。由于培养基5号平均茎芽高度达不到工厂化育苗的要求,只有培养基6号茎芽高度3.9 cm符合要求;虽然培养基6号增殖率达仅为2.8倍,已经符合组培工厂化育苗技术要求,所以选择培养基6号:改良MS+BA 0.5+IBA 0.1+Vc 5 mg/L+B25 mg/L,作为沉水樟继代培养基。
2.4 生根培养基选择
增殖培养获得的沉水樟合格生根茎芽接种到生根试验培养基上,于培养室培养25 d,接着炼苗15 d,观察统计植株生根状况,结果见表3。结果表明:培养基7~10号生根率之间具有显著差异,其中培养基10号的平均生根率最高,达到73.3%,所以选择培养基10号:1/2 MS+IBA 1.0 mg/L作为沉水樟生根培养基。
2.5 组培苗移栽
沉水樟组培瓶苗经过15 d炼苗,倒出并洗净根部培养基,然后移栽到温室,移栽基质采用红心土,基质提前3 d用0.2‰高锰酸钾溶液消毒,移栽后立即覆盖薄膜保湿和加强病虫害防治,30 d后统计成活率达到82%以上。
3 结论和讨论
3.1确定适宜沉水樟外植体诱导培养基为:MS+BA 5.0 mg/L+IBA 0.1 mg/L+Vc 5 mg/L,诱导率达到35%;增殖培养基为:改良MS+BA 0.5 mg/L+IBA 0.1 mg/L+Vc 5 mg/L+B25 mg/L,平均增殖率达到2.8倍、平均茎芽高度达到3.9 cm;生根培养基为:1/2 MS+IBA 1.0 mg/L,平均生根率达到73.3%。
3.2试验中加入Vc 5 mg/L并采用暗培养可以减轻沉水樟外植体褐化。外植体诱导、增殖培养过程中茎芽基部始终有愈伤组织团存在和褐化现象出现,一定程度上影响茎芽的增殖和生长。瓶内生根率有待于进一步提高。
[1]陈远征.濒危植物沉水樟种群生殖生态学研究[D].福州:福建农林大学,2005:9-10.
[2]郑小春,龙光远.值得推广的园林绿化树种——沉水樟[J].植物杂志,2002(6):17.
[3]翟晓巧,翟翠娟,康伟玲.沉水樟体外植株再生体系的建立[J].河南林业科技,2004,24(3):4-5.
[4]罗坤水,胡庆,罗忠生,等.沉水樟组织培养研究[J].南方林业科技,2015,43(2):12-14,27.
[5]谭文澄,戴策刚.观赏植物组织培养技术[M].北京:中国林业出版社,1991:40-44.
[6]陈碧华,张娟,江斌,等.木荷组织培养技术研究[J].湖北林业科技,2015,44(1):16-19.
[7]Chen B H.In vitro propagation of a medicinal plant:Tripterygium wilfordii Hook f.[J].Forestry studies in China,2009,11(3):174-178.
[8]Chen B H,Trueman S J,Li J M,et al.Micropropagation of the Endangered Medicinal Orchid,Dendrobium officinale[J].Life Science Journal,2014,11(9):526-530.
[9]Trueman S J,Hung C D.Cytokinin concentrations for optimal micropropagation of Corymbia torelliana×C.citriodora[J].Australian Forestry,2012,75(1):233-237.
[10]陈碧华,李乾振,吴丽君,等.巨桉组织培养及工厂化育苗技术的研究[J].福建林业科技,2006,33(1):61-63,79.
