联用CD-CIK细胞和养肝解毒丸治疗丙型肝炎的效果研究
2016-01-16李杨
李 杨
(山东省泰安市中医医院肝病科 山东 泰安 271000)
丙型肝炎是丙型病毒性肝炎的简称,多由丙型肝炎病毒感染所致,其主要的传播途径是输血、针刺及吸毒,临床治疗的效果效差。在本次研究中,为了探讨分析联用CD-CIK细胞和养肝解毒丸治疗丙型肝炎的临床效果,笔者进行了以下研究:
1 资料与方法
1.1 临床资料
本文的研究对象是近年来我院收治的160例丙型肝炎患者,我们将其随机分为DC-CIK细胞组(40例)、养肝解毒丸组(40例)、DC-CIK细胞联合养肝解毒丸组(40例)及长效干扰素组(40例),这4组患者的临床表现及各项检查结果均符合中华医学会肝病学分会、中华医学会传染病与寄生虫病学分会在《丙型肝炎防治指南》中制定的关于丙型肝炎的临床诊断标准,并且这4组患者在年龄、性别、体重等一般资料方面的差异均不显著(P>0.05),不具有统计学意义,具有可比性。
1.2 中医诊断及辨证标准
这160例患者的临床症状均符合中国中医药学会在《病毒性肝炎中医辨证标准》中制定的关于肝肾阴虚[1]的证候诊断标准,均伴有神疲乏力、口咽干燥、胁肋隐痛、腰膝酸软、腹胀、皮肤存在蛛丝纹缕、面色晦暗等症状,舌质红、少苔,脉弦细、弦缓、弦沉或弦涩。
1.3 方法
使用DC-CIK细胞为DC-CIK细胞组患者进行治疗,使用养肝解毒丸为养肝解毒丸组患者进行治疗,联用DCCIK细胞和养肝解毒丸为DC-CIK细胞联合养肝解毒丸组患者进行治疗,使用长效干扰素为长效干扰素组患者进行治疗,然后观察对比这4组患者的临床疗效,并将对比的结果及4组患者的临床资料进行回顾性的分析。DC-CIk细胞的制备方法及用法是:分离患者血液样本中的外周血单个核细胞(PBMC),在无菌及严格监控的条件下进行细胞诱导和培养,获得DC-CIK细胞,然后采用静脉滴注的方式将增殖数百倍的DC-CIK细胞分3次回输至患者的体内,每次滴注的间隔时间为1~2天。此后,每个月培养DCCIk细胞1次,分3次回输至患者的体内,连续治疗6个月为1个疗程。养肝解毒丸(由泰安市中医医院自制,鲁药制字为Z0920030155)的用法及用量是:口服,9g/次,3次/日,连续服用6个月为1个疗程。长效干扰素的用法及用量是:①使用180ug的聚乙二醇干扰素α-2a为患者进行皮下注射,每周注射1次,或使用1.5ug/kg体重的聚乙二醇干扰素α-2b为患者进行皮下注射,每周注射1次。②让患者每日口服1000mg的利巴韦林片,连续服用6个月为1个疗程。
1.4 观察指标
①临床疗效。②肝功能指标。③安全性。
1.5 临床疗效判定标准
肝肾阴虚症状、体征记分,症状体征内容以病例选择纳入标准为准,记分(参照中国中医药学会内科肝病专业委员会,病毒性肝炎中医辨证标准拟定)。西医标准时:①治愈:HCV抗体阴转,HCV-RNA<103copy/ml,随访48周患者未复发。②显效:HCV抗体未阴转,HCV-RNA<103copy/ml。③有效:HCV抗体未阴转,HCV-RNA下降至103copy/ml-106copy/ml。④无效:HCV抗体未阴转,HCV-RNA未下降或升高。
1.6 统计学方法
应用SPSS13.0 for windows统计学软件对本次研究所得数据进行统计学分析,正态分布计量资料采用均数±标准差(X±S)表示,采用t检验,非正态分布计数资料采用例数或百分率表示,采用X²检验,当P<0.05时,视为差异显著,具有统计学意义。
2 结果
2.1 4组患者临床疗效的比较
DC-CIk细胞联合养肝解毒丸组患者治疗的总有效率为82.5%,DC-CIk细胞组患者治疗的总有效率为75.0%,养肝解毒丸组患者治疗的总有效率为32.5%,长效干扰素组患者治疗的总有效率为40.0%。DC-CIk细胞联合养肝解毒丸组患者的临床疗效明显优于其他三组患者,差异显著(P<0.05),具有统计学意义。详情见表1。
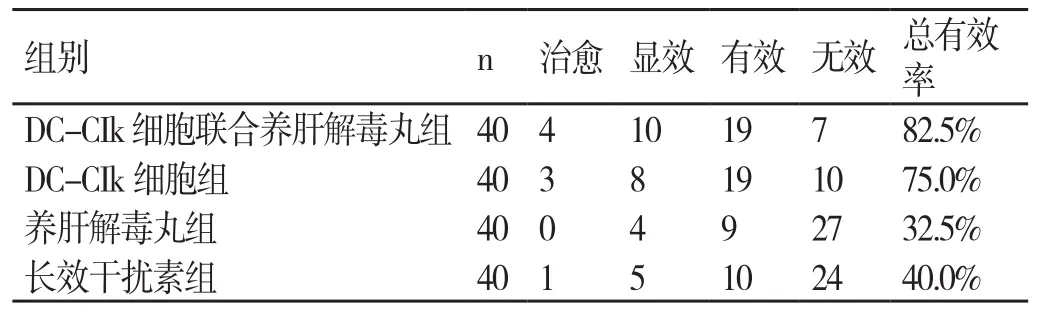
表1 4组患者临床疗效的比较
2.2 4组患者治疗前后各项肝功能指标的比较
在治疗前,4组患者各项肝功能指标之间的差异均不显著(P>0.05),不具有统计学意义。经过一段时间的治疗,这4组患者的各项肝功能指标较治疗前均有明显的改善,且DC-CIk细胞联合养肝解毒丸组患者各项肝功能指标的改善程度更为明显,差异显著(P<0.05),具有统计学意义。详情见表2。
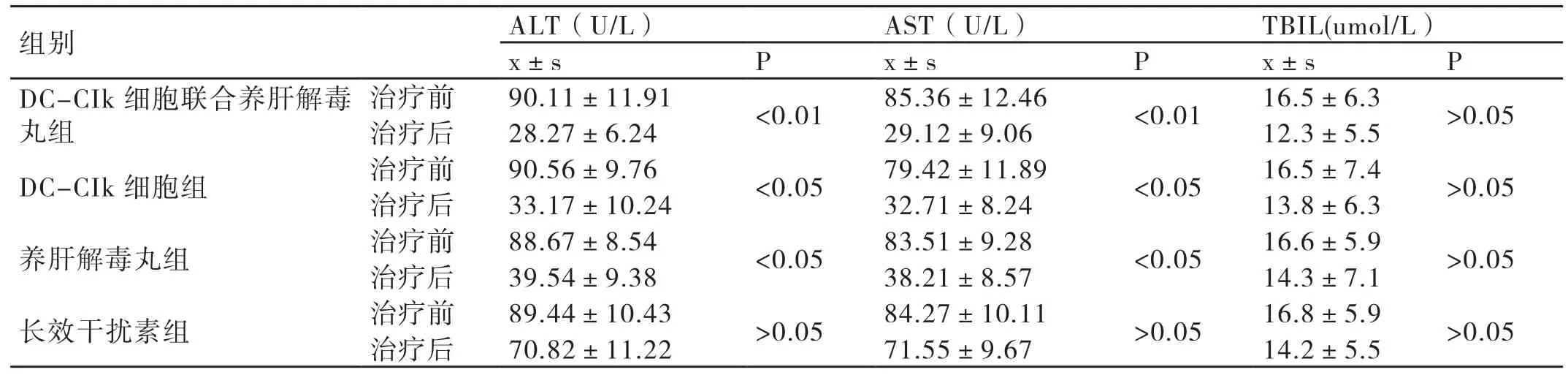
表2 4组患者治疗前后各项肝功能指标的比较
2.3 安全性分析
DC-CIk细胞联合养肝解毒丸组患者、DC-CIk细胞组患者及养肝解毒丸组患者的甲状腺功能、血糖水平均正常,而长效干扰素组患者中有1例患者出现了血糖升高的情况、有2例患者出现了甲状腺功能亢进的情况。
3 讨论
3.1 DC-CIK细胞对丙型肝炎的治疗机制
DC-CIK疗法是指将DC-CIK细胞(即DC细胞和CIK细胞)在人体外进行培养,然后回输给患者的一种治疗方法。严格地说,该方法最终的治疗效应细胞是经DC体外活化的CIK细胞。多项研究表明,DC细胞与CIK细胞具有协同作用,将二者共同孵育后,DC细胞表面的刺激分子的表达及抗原递呈能力均明显提高,而CIK细胞的增殖能力和体内外细胞毒活性也显著提高,因此,与单独的CIK细胞相比,DC-CIK细胞的治疗效果更佳。CIK细胞治疗属于自体免疫细胞治疗范畴,回输后无排斥反应;此外,经过体外培养的CIK细胞对病毒感染细胞或肿瘤细胞具有很强的细胞毒作用,还可以通过分泌大量的细胞因子,如IL-2、IL-6以及IFN-r等调节机体的免疫反应。早期CIK细胞主要应用于临床上各种肿瘤的治疗,包括肝癌、肺癌、淋巴瘤等[2-4]。近期研究表明CIK细胞对慢性乙型肝炎、慢性丙肝都具有良好的疗效[5-6]。据统计,目前全世界约有1.7亿人感染HCV。70%的HCV感染者会转为慢性感染,并在长期的慢性炎症作用下产生肝纤维化,最终形成肝硬化甚至肝癌[7]。这主要由于HCV作为一种RNA病毒,在复制过程中经常发生错误的“拼写检查”。与DNA病毒相比较,只有少数RNA病毒可以被完全无误地读取和复制。所以,HCV的变异速度远远大于HBV,这就使得HCV可以轻而易举地逃避免疫系统“追击”,并在与机体长期 -的相互作用中导致免疫系统的耗竭(exhausted)或者失能(anergy)。研究表明,HCV在感染早期可以迅速复制,产生的结构蛋白能够抑制宿主DC和NK细胞的活化,无法产生足够强度的天然免疫反应[8-10],进而影响到适应性免疫的应答。另外,HCV的高变异性可以迅速地逃避机体产生的特异性免疫应答,使得机体针对病毒的免疫反应无法被充分调动[11-12]。所以寻找可以重新激活免疫系统的方法显得尤为重要。CIK细胞诱导培养方案可以提高培养体系中CD3+CD8+、CD3+CD56+细胞的比例,增强其分泌IFN-r和脱颗粒(CD107a)的能力。CD3+CD8+以及CD3+CD56+细胞具有很强的抗病毒作用,这主要通过细胞裂解和非裂解两个途径。对于细胞裂解途径,效应细胞通过分泌各种颗粒酶,穿孔素直接杀伤、裂解靶细胞,从而破坏HCV感染、复制的场所;而在非裂解途径中,效应细胞分泌的IFN-r可以作用于被感染的肝细胞,通过一系 列细胞内信号途径,抑制HCV在肝细胞内的复制过程[13]。另外,CIK技术通过CD3+CD8+以及CD3+CD56+细胞分泌大量促炎因子,包括IFN-r、IL-6,还具有重新调动免疫学反应的作用。
3.2 养肝解毒丸的组方意义
养肝解毒丸以扶正、解毒、化瘀为配伍原则,所使用的药物主要有熟地、败酱草、山萸肉、山药、赤灵芝、丹皮、夏枯草、苡米、砂仁等,具有滋补肝肾、祛毒化瘀的功效,其中熟地、败酱草为君药,具有补肝肾、解毒邪的功效;山萸肉、山药、赤灵芝、夏枯草为臣药,具有助君药滋补肝肾、扶正祛毒的功效;丹皮、苡米为佐药,具有助君药清血中虚热、引药入血、滋补肝肾、活血化瘀的功效;砂仁为使药,具有免除滋补药的副作用(妨害消化、减低食欲)、引熟地归肾的功效,可谓一举两得。
本次研究结果显示,经过一段时间的治疗,这4组患者的各项肝功能指标较治疗前均有明显的改善,且DC-CIk细胞联合养肝解毒丸组患者各项肝功能指标的改善程度更为明显,差异显著(P<0.05),具有统计学意义。DC-CIk细胞联合养肝解毒丸组患者的临床疗效明显优于其他三组患者,差异显著(P<0.05),具有统计学意义。DC-CIk细胞联合养肝解毒丸组患者、DC-CIk细胞组患者及养肝解毒丸组患者的甲状腺功能、血糖水平均正常,而长效干扰素组患者中有1例患者出现了血糖升高的情况、有2例患者出现了甲状腺功能亢进的情况。
综上所述,联用CD-CIK细胞和养肝解毒丸治疗丙型肝炎的临床效果显著,值得在临床上推广应用。
[1] 中国中医药学会内科肝病专业委员会《病毒性肝炎中医辨证标准》.中医杂志,1992,33(5):39-40.
[2] 施明,王福生,张冰,等.自体CIK细胞治疗肝癌的安全性和有效性评价[J].解放军医学杂志,2004,29:333-335.
[3] 田声望,蒋敬庭,石亮荣,等.自体CIK细胞治疗晚期非小细胞肺癌[J].江苏医药,2008,34:880-881.
[4] 孙健冰,林丽,刘莲卿.CIK细胞免疫治疗恶性淋巴瘤31例护理[J].福建医药杂志,2010,32:146-147.
[5] Shi M,Fu J,Shi F,et al.Transfusion of autologous cytokine induced killer cells inhibits viral replication in pati ents with chronic hepatitis B virus infection.Clin Immun ol,2009,132:43-54.
[6] Shi M,Fu J,Shi F,et al.Viral suppression corrslates with d endritic cell restoration in chronic hepatitis B patients with autoligous cytokine-induced killer cell transfusion.Liver Int,2009,29:466-474.
[7] Ahmad A,Alvarez F.Role of NK and NKT cells in the immun opathogenesis of HCV-induced hepatitis.J Leuk Biol,2004,76:743-759.
[8] Kaplan DE ,Sugimoto K,Newton K,et ai.Discordant role of CD4 T-cell response relative to neutralizing antibody and CD8 T-cell response in acute hepatitis C.Gastroente rology,2007,132:654-666.
[9] Von Hahn T,Yoon JC,Alter H,et al,Hepatitis C virus conti nuously escapes from neutralizing antibody and T-cell responses during chronic infection in vivo.Gastroenterol ogy,2007,132:667-678.
[10] Sarobe P,Lasart JJ,Zabaleta A,et al,Hepatitis C virus stru ctural proteins impair dendritic cell maturation and inh ibit in vivo induction of cellular immune responses.J Vi rol,2003,77:10862-10871.
[11] Huang L,Koziel MJ.Immunology of hepatitis C virus infe ction.Curr Opin Gastroenterol,2000,16:558-564.
[12] Rehemann B,Nascimbeni M.Immunology of hepatitis B virus and hepatitis C virus infevtion.Nat Immunol,2005,5:215-229.
[13] Fress M,Schwarzle V,Barth K,et al.Interferon-gamma inhib its replication of subgenomic and genomic hepatitis C virus RNAs.Hepatology,2002,35:694-703.
