四倍体矮秆小麦拔节期赤霉素合成途径中关键酶基因表达分析
2016-01-15胡召杉巫有霞杨在君王清海彭正松
胡召杉, 巫有霞,2, 杨在君, 王清海, 彭正松
(1.西华师范大学西南野生动植物资源保护教育部重点实验室, 四川 南充637009;2.西昌一中, 四川 西昌615000)
小麦(Triticvum aestivum)是主要的粮食作物之一。研究表明,株高这一农艺学性状能够影响小麦的产量,同时,矮化植株抗倒伏能力更强[1]。小麦矮化育种和推广利用获得的成果显示,小麦矮化育种主要与矮杆基因(Dwarfing gene)有关[2]。在小麦育种实践中利用Rht(Reduced height)基因降低株高,有助于加大矮秆基因在小麦产量提高和品种遗传改良方面的应用。迄今,已鉴定并统一编号的矮秆基因有21个,从Rht 1到 Rht 20及 Rht 22。有人报道 Rht 21基因,后来被证实并不存在[3-4]。21个矮杆基因中天然产生的有8个,理化因素诱变的有13个。小麦中的Rht基因大部分源于六倍体,来自四倍体的只有7个,分别为Rht 14、Rht 15 、Rht 16、Rht 18、Rht 19、RhtB 1(IC 12196)和 Rht 22。在这7个基因中,Watanabe[5]报道了一个来源于自然变异的 Rht基因,即 Rht-B 1(IC 12196),它位于4B染色体上,但还没证实它就是一个新基因;而Peng等[6]从矮杆番麦中发现了一个控制其半矮杆性状的新基因,即Rht 22[7],该基因也来源于自然变异并被定位于7A染色体上。其余5个矮杆基因 Rht 14、Rht 15、Rht 16、Rht 18和 Rht 19都是通过辐照或化学诱变获得[8]。Haque M 等[9]利用 Rht 14、Rht 16、Rht 18等矮秆基因构建了硬粒小麦近等基因系。
赤霉素(gibberellin,GA)是一种重要的植物激素。赤霉素参与调节植物、真菌、细菌等的整个生长发育过程,包括种子的萌发、根和茎的延伸、叶片的伸展等[10]。赤霉素缺陷型突变体通常表现出植株矮化等性状[11]。GA 的合成过程十分复杂[12-13],合成途径中需要多种酶的参与,如古巴焦磷酸合成酶(CPS)、内根-贝壳杉烯合成酶(KS)、内根-贝壳杉烯19-氧化酶(KO)、内根-贝壳杉烯酸7β羟化酶、GA-7-氧化酶(GA 7ox)、GA-13-羟化酶(GA 13ox)、GA 20-氧化酶(GA 20ox)和 GA 2-氧化酶(GA 2ox)等[14];同时,14-3-3、RSG、GID 1、GA-MYB、GAI、GIP、XET 等多种调控基因也参与了GA的生物合成途径[15]。
本研究通过实时荧光定量PCR技术对GA合成途径中的14种关键酶基因在四倍体矮杆小麦及其高杆对照品系中的时空表达模式进行了分析,以期为小麦的矮化育种奠定理论基础。
1 材料与方法
1.1 实验材料
实验材料选用四倍体(AABB)圆锥小麦地方品种矮秆番麦,硬粒小麦矮杆近等基因系ANW 16D、ANW 16F、ANW 16G,以高杆品种小麦LD为对照。
其中LD、ANW 16D、ANW 16F、ANW 16G由日本岐阜大学农业学院N.Watanabe提供,矮秆番麦来自四川农业大学小麦研究所,由西华师范大学生命科学学院遗传学实验室提供。在拔节期取穗下第一茎节节间部分于RNA保存液中并置于-70℃冰箱中保存待用。
1.2 引物合成

表1 各基因及内参基因RT-PCR引物序列
根据赤霉素生物合成过程中涉及到的关键基因GA 20ox、CPS、GA 2ox、KAO、KO、KS、GA 3ox、GID 1、GA-MYB、XET、GIP、GAI、RSG、14-3-3和2个内参基因Actin、GAPDH 的cDNA 序列,利用 Primer Express 3.0(Applied Biosystems)设计定量PCR的引物,引物序列及相关参数如表1所示,由上海英骏生物技术有限公司合成。
1.3 总RNA提取
总 RNA的提取按照EZgeneTM Plant Easy Spin RNA Miniprep Kit试剂盒(Biomega,R 6611),将所得RNA溶解在DEPC-treated ddH2O中。然后用1%琼脂糖凝胶电泳和NANODROP 2 000c紫外分光光度计检测RNA的浓度和纯度,-70℃保存备用。
1.4 cDNA的合成
以总RNA为模板,按反转录试剂盒PrimeScript Perfect Real-Time RT Reagent Kit(TaKaRa)步骤反转录出cDNA链。80μL反应体系:5×Primescript buffer 16μL,PrimeScript RT Enzyme Mix 4μL,Oligo dT Primert 4μL,Random 6mers 4μL,模板RNA根据浓度计算,剩余用水补足80μL。反应程序:37℃15min,85℃5s,-20℃保存备用。
1.5 荧光定量检测 (Realtime-PCR)
根据目的基因和内参基因的反应参数,按照SYBR Premix Ex Tap 试剂盒(TaKaRa,中国),对反转录所得的cDNA进行5倍梯度稀释,进行Real-time PCR反应,绘制相对标准曲线。对5个小麦品种的总RNA 反 转 录 样 品 于 Bio-RAD c 1 000TMThermal Cycler仪器上进行SYBR Green实时荧光定量PCR反应,使用CFX 96TM系统对定量结果进行荧光采集。通过检测其荧光值,绘制溶解曲线[16]。
2 结果与分析
GA合成途径中的14个关键酶基因,除14-3-3和CPS未检测到表达量外,其它12个基因在矮杆品种和高杆对照的拔节期节间均有不同程度的表达(图1)。GA 2ox在ANW 16F中的表达量最高,其次是LD,而在 ANW 16D、ANW 16G和矮秆番麦中表达量较低(图1a)。GA 3ox在 ANW 16D、ANW 16 F、LD以及矮秆番麦中表达量极低,仅为ANW 16F中 GA 3ox表达量的1/40(图1b);GA 20ox在LD中表达量最高,其次依次是ANW 16D、矮秆番麦,在ANW 16F和ANW 16G中表达量最低(图1c);GAI在ANW 16F的表达量最高,ANW 16G中次之,矮秆番麦中表达量仅次于ANW 16G,LD和ANW 16D表达量最低(图1d);GA-MYB在LD中表达量最高,其次是 ANW 16G,仅为 LD 中表达量的一半,ANW 16D中表达量仅次于ANW 16G,矮秆番麦中表达量则仅次于ANW 16D,ANW 16F表达量最低,仅为LD的1/16(图1e);GID 1在 ANW 16F中的表达量最高,其次是ANW 16D,再次为ANW 16G、LD,矮秆番麦中的表达量最低,仅为ANW 16F中的1/6(图1f);KAO在 ANW 16F中表达量最高,其次是ANW 16G,剩余3种材料中表达量均较低,依次为LD、ANW 16G、矮秆番麦,矮秆番麦中表达量仅为ANW 16D中的1/11(图1g);KO在5种材料中的表达量与GID 1相似,在ANW 16F中的表达量最高,其次是ANW 16D、ANW 16G、LD,矮秆番麦中的表达量最低,仅为 ANW 16F中的1/4(图1h);RSG 在ANW 16F中的表达量最高,其次依次为ANW 16D、ANW 16G、矮 秆 番 麦、LD,LD 中 表 达 量 仅 为ANW 16F的1/9(图1i);XET在 ANW 16F中的表达量最高,其次为 LD、ANW 16G、矮 秆番麦、ANW 16D,ANW 16G与矮秆番麦中XET表达量相近,ANW 16D中的表达量最低(图1j);KS在 ANW 16D中表达量最高,ANW 16F和ANW 16G次之,ANW 16D中表达量大约是ANW 16F和ANW 16G表达量的一倍,在LD和矮秆番麦中几乎没有检测到表达(图1k);GIP在ANW 16D的表达量最高,其次是矮秆番麦,LD、ANW 16F和 ANW 16G中的表达量相近且较低,仅为ANW 16D表达量的1/5(图1l)。
GA 20ox和GA-MYB在矮秆小麦和高秆小麦中的表达模式相似,均是高秆小麦中的表达量高于其余4种矮秆小麦中的表达量。
3 讨 论
小麦的株高主要通过茎的伸长来实现,而拔节期则是小麦长高最关键的时期[17]。本实验通过对4个矮杆小麦品系和高秆对照品系小麦拔节期节间部分各赤霉素关键酶基因的Real-time PCR检测分析得出,CPS与14-3-3基因在5种小麦材料中均没有表达。前体物质GGPP合成GA的第一个阶段,在柯巴焦磷酸合成酶的催化下,生成柯巴焦磷酸(ent-copalyl pyrophosphate,CPP)[18-19]。CPS可能为赤霉素合成途径中前体物质GGPP转化为CPP的催化酶,是赤霉素合成途径的最开始阶段,由于拔节期是一个时间段而不是一个时间点,在取材的这个时间点上CPS可能已经完成了催化任务,因此检测不到表达量。14-3-3是RSG的负调控因子,拔节期需要赤霉素促进茎的伸长,此时RSG的活性不应该受到抑制,因此检测不到表达量也是合理的。GA 20ox、GA 2ox、KAO、KO、KS、GA 3ox、GID 1、GA-MYB、XET、GIP、GAI、RSG在5种小麦材料中都有表达,其中GA 20ox和GA-MYB在高秆小麦和矮秆小麦中的表达模式相同,均是高秆小麦中的表达量略高于矮杆小麦。这与Zhang等[20]的研究结果类似,GA 20ox过表达的植物通常表现为节间伸长的特征。在拔节期,具有生物活性的GA的量将影响小麦茎的伸长程度,因而拔节期小麦内源赤霉素缺失就会抑制小麦茎节间的伸长[21]。高杆小麦和矮杆小麦株高差异的关键时期就在于拔节期,茎杆在该时期迅速伸长,植株也迅速增高,该时期对GA的需求量可能是最大的。GA 20ox在矮秆中的表达量较高杆小麦中低,这可能导致矮杆小麦ANW 16D、ANW 16F、ANW 16G和矮秆番麦在拔节期因赤霉素量合成不足而影响了细胞的伸长,最终导致 ANW 16D、ANW 16F、ANW 16G和矮秆番麦出现矮化性状。此外,GA-MYB在高秆小麦中的表达量略高于矮杆小麦。Zhang等研究表明,GA-MYB是赤霉素合成途径中一个重要的正向调节器,提高GA-MYB基因的表达量,可以提高赤霉素合成水平或赤霉素信号的灵敏度,使细胞伸长,植株增高[20]。本实验中,GA-MYB的表达量在拔节期矮秆小麦ANW 16D、ANW 16F、ANW 16G和矮秆番麦较LD低,这可能导致在矮化小麦中赤霉素的合成途径受阻或使其对赤霉素的信号灵敏度降低,从而导致ANW 16D、ANW 16F、ANW 16G和矮秆番麦的株高较LD矮小。
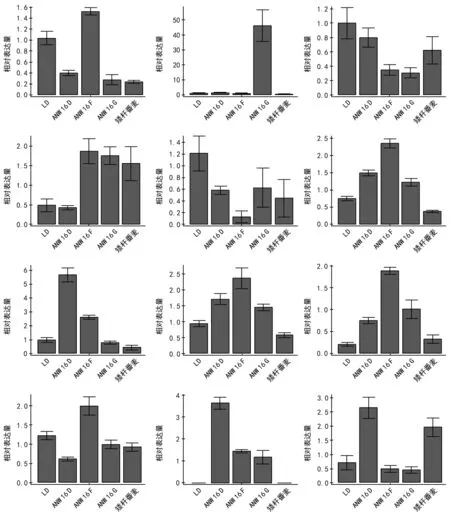
图1 GA 2ox、GA 3ox、GA 20ox、GAI、GAMYB、GID 1、KAO、KO、RSG、XET、KS、GIP基因在不同小麦拔节期的表达情况
在小麦、水稻等禾本科作物中,茎的伸长一般都是由细胞有丝分裂增加细胞数目以及使细胞伸长增加细胞长度两方面作用的共同结果[22]。拔节期是小麦茎秆伸长最迅速的时期,但在检测到表达量的12个基因中只有2个基因在高秆小麦和矮秆小麦中差异性表达,但是这种差异并不大,不能够认定为拔节的原因。这与蔡鹏[23]对簇毛麦(Dasypyrum villosum)矮化突变体的研究结果一致。
[1]Kuczyńska A,Surma M,Adamski T.Effects of the semidwarfing sdw 1/denso gene in barley[J].J Appl Genet.2013,54(4):381-390.
[2]Rebetzke,G.J.Ellis,M.H.Bonnett,D.G.The Rht 13dwarfing gene reduces peduncle length and plant height to increase grain number and yield of wheat[J].Field Crops Research.2011,124(3):374-381.
[3]杨天章,张晓科,刘宏伟.矮秆小 XN 000的矮秆基因 R ht 21的染色体臂定位[J].西北农业大学学报,1993,21(4):13-17.
[4]Borner A.Worland AJ.Does the Chinese dwarf wheat variety XN 0004carry Rht 21?[J].Cereal Research Communications,2002,30(7):79-83.
[5]Watanabe,N.Triticum polonicum IC 12196:apossible alternative source of GA 3-insensitive semi-dwarfism[J].Cereal Research Communication.2004,32(4):125-134.
[6]Peng ZS,Li X,Yang ZJ.A new reduced height gene found in the tetraploid semi-dwarf wheat landrace Aiganfanmai[J].Genet Mol Res.2011,10(04):2349-2357.
[7]苏瑾,彭正松,杨在君.小麦新矮源矮秆番麦的赤霉素敏感性分析[J].西北农业学报,2012,21(10):28-33.
[8]Bingham AM,Burkett-Cadena ND,Hassan HK.Field investigations of winter transmission of eastern equine encephalitis virus in Florida[J].Am J Trop Med Hyg.2014,91(4):685-693.
[9]Haque,M.A.Martinek,P.Watanabe,N.Genetic Mapping of Gibberellic Acid-sensitive Genes for Semi-dwarfism in Durum Wheat[J].Cereal Research Communications.2011,39(02):1 161-1 170.
[10]Li A,Yang W,Li S.Molecular characterization of three GIBBERELLIN-INSENSITIVE DWARF 1homologous genes in hexaploid wheat[J].JPlantPhysiol,2013,170(4):432-443.
[11]Shimane M,Ueno Y,Morisaki K.Molecular evolution of the substrate specificity of ent-kaurene synthases to adapt to gibberellin biosynthesis in land plants[J].Biochem J,2014,462(3):539-546.
[12]Dijkstra C,Adams E,Bhattacharya A.Over-expression of a gibberellin 2-oxidase gene from Phaseolus coccineus L.enhances gibberellin inactivation and induces dwarfism in Solanum species[J].Plant Cell Rep,2008,27(3):463-470.
[13]Gou J,Ma C,Kadmiel M.Tissue-specific expression of Populus C 19GA 2-oxidases differentially regulate aboveand below-ground biomass growth through control of bioactive GA concentrations[J].New Phytol,2011,192(3):626-639.
[14]Gallego-Giraldo L,Ubeda-Tomás S,Gisbert C.Gibberellin homeostasis in tobacco is regulated by gibberellin metabolism genes with different gibberellin sensitivity[J].Plant Cell Physiol,2008,49(5):679-690.
[15]Rieu I,Eriksson S,Powers SJ.Genetic analysis reveals that C 19-GA 2-oxidation is a major gibberellin inactivation pathway in Arabidopsis[J].Plant Cell,2008,20(9):2 420-2 436.
[16]李兴亮,郭献平,沈元月.板栗赤霉素缺陷型短雄花序芽变的初步鉴定及CmGID 1基因的表达分析[J].园艺学报,2011,38(7):1 251-1 258.
[17]Zi J,Mafu S,Peters RJ.To gibberellins and beyond Surveying the evolution of(di)terpenoid metabolism[J].Annu Rev Plant Biol,2014,65:259-286.
[18]Qin X,Liu JH,Zhao WS.Gibberellin 20-oxidase gene OsGA 20 ox 3regulates plant stature and disease development in rice[J].Mol Plant Microbe Interact.2013,26(02):227-239.
[19]Kimura O,Endo T,Hotta Y.Effects of P-glycoprotein inhibitors on transepithelial transport of cadmium in cultured renal epithelial cells,LLC-PK 1and LLC-GA 5-COL 150[J].Toxicology,2005,208(1):123-132.
[20]Yi Zhang Zhongfu Ni,Yingyin Yao.Gibberellins and heterosis of plant height in wheat(Triticum aestivumL.)[J].BMC Genetics.2007,40(08):1-10.
[21]Foulkes MJ,Slafer GA,Davies WJ.Raising yield potential of wheat.III.Optimizing partitioning to grain while maintaining lodging resistance[J].J Exp Bot.2011,62(02):469-486.
[22]董丽娜.毛毛竹秆茎高生长的发育解剖研究[D].南京.南京林业大学南京南京林业大学,2007.
[23]蔡鹏.簇毛麦(Dasypyrum villosum)矮化突变体鉴定及矮化机理初步研究[D].四川.四川农业大学,2011.
