海洋卡盾藻对青岛大扁藻的化感作用及其对UV-B辐射的响应*
2016-01-15唐弘硕袁梦琪
唐弘硕 袁梦琪 杨 雷 王 影①
(1. 天津市第五十四中学 天津 300000; 2. 中国海洋大学海洋生命学院 青岛 266003)
近年来, 随着海水富营养化的加剧, 赤潮频发对水产养殖和人类生活造成了严重影响。海洋卡盾藻(Chattonella marina)是一种隶属于针胞藻纲(Raphidophyceae)、卡盾藻属(Chattonella)的鱼毒性赤潮藻种, 可引起单相型有毒赤潮(安鑫龙等, 2010)。近年来, 该藻藻华在我国沿海频发, 对海洋生态系统造成严重危害。青岛大扁藻(Platymonas helgolandica var.tsingtaoensis)是属于绿藻纲(Chlorophyceae)、扁藻属(Platymonas)的饵料微藻, 被广泛用作贝类、海参等海产品的育苗开口饵料(湛江水产专科学校, 1980), 为广温广盐特性的我国近岸广布种(张德瑞等, 1964)。卡盾藻产生的毒素可能是它抑制其他藻生长而成为赤潮优势种的原因(Marshall et al, 1999); 研究发现,海洋卡盾藻无细胞滤液能显著抑制赤潮藻三角褐指藻(Phaeodactylum tricornutum)、塔玛亚历山大藻(Alexandrium tamarense)和东海原甲藻(Prorocentrum donghaiense)的种群增长(杨翠云等, 2011); 也有研究表明, 饵料藻亚心形扁藻(Platymonas subcordiformis)的藻液、细胞内含物和培养滤液均可抑制赤潮藻米氏凯伦藻(Karenia mikimotoi)的生长(马龙, 2008), 但赤潮藻对于饵料微藻影响的研究目前仍较少。
化感作用(Allelopathy), 又称他感作用或相生相克, 指真菌、细菌、藻类等生物通过产生次生代谢产物对生物和农业系统产生的影响, 在陆地、淡水和海水生态系统中广泛存在, 包括促进和抑制两方面的作用(Legrand et al, 2003)。藻类化感作用是指藻类能够通过分泌物质影响自身或周围其他藻类、微生物或高等植物的生长, 或致使其改变营养盐离子的聚集和作用(Inderjit et al, 1994)。微藻之间的种间关系主要包括种间竞争和互利共生等, 微藻干扰性竞争机制主要通过分泌化感物质实现, 化感作用已成为微藻群落结构变化和赤潮演替中最重要的因素之一(王悠等, 2006; 郝雯瑾等, 2008; 洪喻等, 2014)。因此,推断海洋卡盾藻通过化感作用对青岛大扁藻产生危害, 然而目前关于赤潮微藻与饵料微藻间化感作用的研究报道尚不多见(马龙, 2008; 潘远健, 2015)。
人类活动使臭氧层侵蚀不断加剧, 到达地面的紫外线中UV-B辐射(280—320nm)不断增强, 微藻作为在海洋生态系统中重要的初级生产者, UV-B对其影响将威胁海洋碳库和整个海洋生态系统。研究表明,UV-B辐射能显著抑制海洋微藻的生长(蔡恒江等,2005b), 且影响海洋微藻的形态、光合作用、生物量和有机物含量等(Tevini et al, 1989)。UV-B辐射增强可改变两种微藻间的竞争能力(张培玉等, 2007; 谢志浩等, 2011), 也可以加强微藻与大型海藻相互间的种群生长抑制作用, 影响大藻对微藻的化感效应, 例如高剂量 UV-B辐射(3.0J/m2)使小珊瑚藻(Corallina pilulifera)对赤潮异弯藻(Heterosigma akashiwo)的化感效应明显减弱(蔡恒江, 2004; 张培玉, 2005; 周立明, 2008)。
本实验选取赤潮微藻海洋卡盾藻和饵料微藻青岛大扁藻作为实验材料, 研究海洋卡盾藻和青岛大扁藻的生长竞争关系, 探讨海洋卡盾藻对青岛大扁藻可能的致毒机制与危害方式, 为探讨赤潮微藻与饵料微藻的相互作用机制及评价赤潮微藻对海洋初级生产者的危害奠定基础。另外, 通过研究UV-B辐射增强对两种藻间相互作用的影响, 为评价臭氧层破坏对海洋生态系统尤其是近岸养殖水域的影响提供基础数据。
1 材料与方法
1.1 实验材料
实验中所用的青岛大扁藻藻种取自中国海洋大学生态学实验室, 海洋卡盾藻藻种取自中国科学院海洋研究所。
1.2 培养方法
两种藻均无菌培养于添加 f/2培养盐(Guillard,1975)的灭菌海水中, 培养温度为(20±1)°C, 光照强度为 70μmol/(m2·s), 光暗比为 L∶D=12h∶12h, 放置于恒温光照培养箱内进行培养, 每日定时摇晃三角瓶 6次, 防止微藻贴壁生长, 每日向三角瓶中补充 f/2培养盐以避免营养盐的限制。实验开始前, 将两种藻在指数生长期接种, 并连续培养 3—4个周期, 使藻细胞实现同步生长。
天然海水取自青岛鲁迅公园附近海域, 经脱脂棉和 300目筛绢粗滤, 再使用 0.45μm醋酸纤维滤膜抽滤除去颗粒物质, 使用高压蒸汽灭菌锅在121°C灭菌20min, 冷却到室温后用于藻类培养, pH为7.9±0.1,盐度为31—33。
1.3 UV-B辐射体系
UV-B辐射体系所用灯管外壁用乙酸纤维素薄膜(0.12mm)全部包被, 去除280nm的短波辐射, 使用紫外辐射强度仪(北京师范大学光电仪器厂)进行辐射强度测定。整个体系正式实验前连续照射 72h, 用于减少薄膜使用过程中过滤作用的不稳定性, 且薄膜每周更换一次以防老化。实验中辐射强度设置为1.25μW/cm2, 设置辐射剂量为0的日光灯管对照组和2.16J/m2的 UV-B处理组, 通过对辐射时间的控制达到辐射剂量。
1.4 研究方法
1.4.1 海洋卡盾藻和青岛大扁藻的相互作用关系研究 (1) 不同初始密度的海洋卡盾藻和青岛大扁藻单培养: 取生长状况良好、处于指数生长期的海洋卡盾藻藻液和青岛大扁藻藻液各1mL用Lugol’s试剂固定。海洋卡盾藻因密度较低且藻体较大, 使用藻类计数框计数细胞个数, 青岛大扁藻因藻细胞密度较高, 将藻液稀释后用血球计数板计数细胞个数, 计算藻细胞密度后分别将不同体积的两种藻液接种于100mL灭菌三角瓶中, 使初始接种密度分别为200、600、1800cell/mL。
(2) 不同初始生物量比的海洋卡盾藻和青岛大扁藻共培养: 海洋卡盾藻(Cm)与青岛大扁藻(Ph)的细胞体积比约为 3∶1, 因此共培养体系中设定两种藻的初始接种比例为 Cm∶Ph=1∶3、1∶1、3∶1。青岛大扁藻的初始接种密度保持为600cell/mL, 改变了海洋卡盾藻的初始密度, 分别为 200、600、1800cell/mL,实验周期共为30d, 每隔2d计数一次藻细胞密度。
(3) 海洋卡盾藻去藻过滤液对青岛大扁藻生长的影响: 将海洋卡盾藻藻液的细胞密度调整至3600cell/mL, 经 0.22μm 玻璃纤维素滤膜过滤, 收集滤液作为母液, 用 f/2营养盐重新加富, 采用一次性添加的方式, 分别将 5.56、16.67和 50mL母液加入100mL灭菌三角瓶中, 以添加f/2营养盐的灭菌海水作为对照, 将生长于指数生长期的青岛大扁藻同时接种于不同实验组中, 接种密度均为 600cell/mL, 最后用已添加f/2营养盐的灭菌海水定容至100mL, 每个实验组设置3个平行, 恒温光照培养箱中培养10d,隔天计数一次藻细胞密度。
(4) 海洋卡盾藻藻细胞裂解液对青岛大扁藻生长的影响: 将海洋卡盾藻藻液在 4°C 4000r/min条件下离心4min, 弃去上清, 用灭菌海水冲洗两遍, 加入灭菌海水将藻细胞密度调整至 3600cell/mL, 然后将藻液加入 10mL无菌离心管中, 插入冰盒内, 使用超细匀浆机(FLUKO F6-10)匀浆破碎细胞后获得藻细胞裂解液, 4°C 4000r/min离心5min, 收集上清液作为母液, 用 f/2营养盐重新加富, 分别将 5.56、16.67和50mL母液加入100mL灭菌三角瓶中, 以添加f/2营养盐的灭菌海水作为对照, 青岛大扁藻的初始接种密度均为 600cell/mL, 最后用添加 f/2营养盐的灭菌海水定容至100mL, 每个实验组设置3个平行, 恒温光照培养箱中培养 10d, 隔天计数青岛大扁藻藻细胞密度。
1.4.2 海洋卡盾藻和青岛大扁藻的相互作用对UV-B辐射增强的响应 (1) UV-B辐射对单培养海洋卡盾藻和青岛大扁藻生长的影响: 两种微藻均设置初始密度为 200、600、1800cell/mL的三个实验组, 以2.16J/m2UV-B辐射剂量为处理组, 以日光灯管照射为对照组。为了防止微藻的自遮蔽作用, 将藻液倒于直径90mm、高18mm的培养皿中, 置于UV-B灯管正下方 20cm处进行照射, 每日定时辐照处理 1次,辐射结束将藻液重新转移回 100mL三角瓶, 放置在培养箱内进行培养, 实验周期为4d(96h), 计数96h时的藻细胞密度。
(2) UV-B辐射对共培养海洋卡盾藻和青岛大扁藻生长的影响: 共培养体系中设定海洋卡盾藻与青岛大扁藻初始接种比例为Cm∶Ph=1∶3、1∶1、3∶1。青岛大扁藻的初始接种密度保持为600cell/mL, 改变了海洋卡盾藻的初始细胞密度, 分别为 200、600、1800cell/mL, 以 2.16J/m2UV-B辐射剂量为处理组,以日光灯管照射为对照组, 每日定时辐照处理 1次,辐照方法与上相同, 计数96h时的藻细胞密度。
1.5 数据处理
实验数据使用SPSS 20.0进行分析, 采用t检验分析两组间数据的差异显著性, P<0.05代表差异显著,P<0.01代表差异极显著。
2 结果与分析
2.1 单培养条件下海洋卡盾藻和青岛大扁藻的生长
单培养条件下, 不同初始密度的2种藻的生长曲线如图1所示。结果显示, 初始接种密度会影响2种藻的生长, 随着初始接种密度的提高2种藻进入指数生长期和静止期的时间提前。海洋卡盾藻初始密度为1800cell/mL时, 16d起海洋卡盾藻的细胞密度可达到赤潮密度(>3×105cell/mL)(王朝晖等, 2010), 26d 时藻细胞密度已呈下降趋势, 进入衰亡期。最终所达到的最大藻细胞密度也随初始接种密度的升高而相应提高, 海洋卡盾藻初始密度为200cell/mL时所能达到的最大藻细胞密度为 2.0×104cell/mL, 而初始密度为1800cell/mL时最大藻细胞密度可达到6.4×104cell/mL。
2.2 共培养条件下海洋卡盾藻和青岛大扁藻的生长
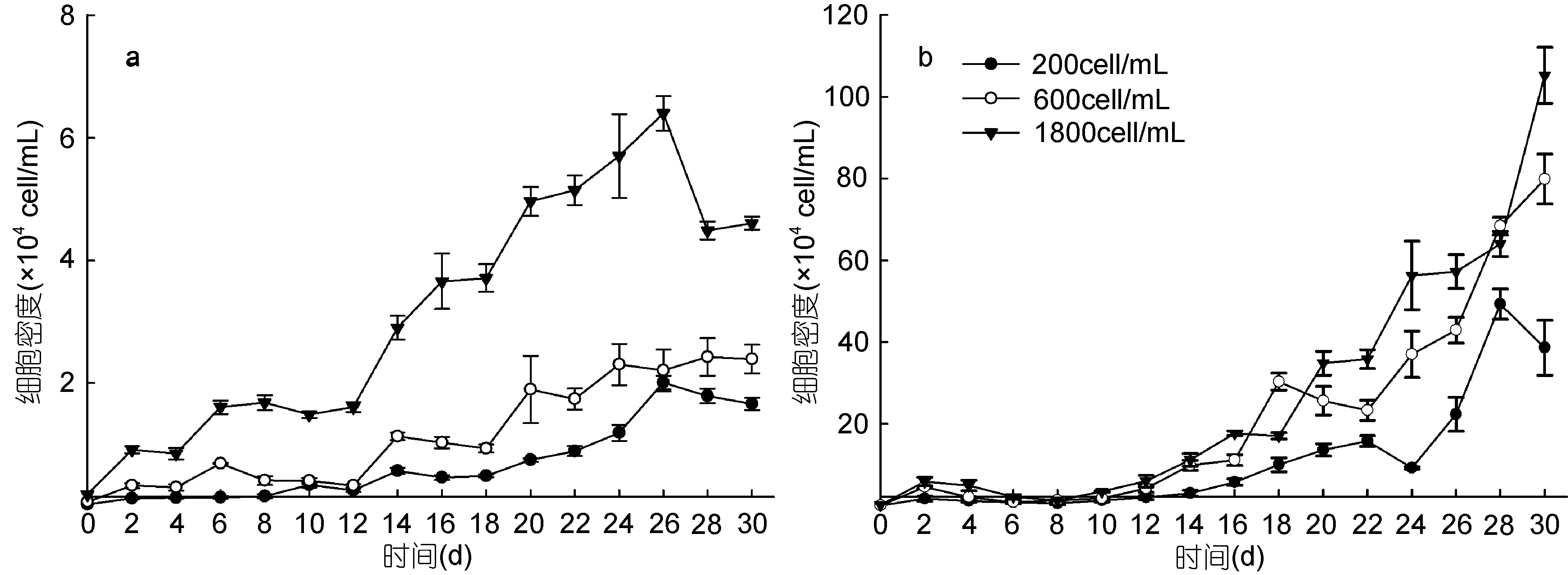
图1 不同初始密度下单培养海洋卡盾藻和青岛大扁藻的生长曲线Fig.1 The growth curves of C. marina and P. helgolandica at different initial cell densities
图2反映了不同初始生物量比下, 共培养海洋卡盾藻和青岛大扁藻的种群增长情况。与单培养相比,青岛大扁藻生长缓慢(图2b), 均在14d之后才进入指数生长期, 且青岛大扁藻所能达到的最大种群密度随着海洋卡盾藻初始密度的增加而降低, 分别为71.13×104、44.44×104、43.06×104cell/mL, 只有单培养时的89.05%、55.63%和53.91%, 22d之后, 初始生物量比 Cm:Ph=1:3实验组的藻细胞密度显著高于其他两组(P<0.05)。初始生物量比为 Cm:Ph=1∶1(Ph=600cell/mL)时, 8d之后, 除了 16d, 青岛大扁藻的生长均受到海洋卡盾藻的显著抑制(P<0.05)。初始生物量比 Cm∶Ph=3∶1(Ph=600cell/mL)时, 除了 6d,青岛大扁藻的生长均受到海洋卡盾藻的极显著抑制(P<0.01)。由此可见, 共培养条件下, 海洋卡盾藻在2个高浓度下对青岛大扁藻的生长产生显著抑制作用(P<0.05)。
3个实验组在实验周期内, 海洋卡盾藻的藻细胞密度随其初始密度的升高而升高(图2a), 初始生物量比 Cm∶Ph=3∶1(Cm=1800cell/mL)的实验组的藻细胞密度显著高于其他两组(P<0.05), 所能达到的最大种群密度也随初始密度而增大。初始生物量比Cm∶Ph= 1∶3时(Cm=200cell/mL), 10d之后, 除了 16d,其生长受到青岛大扁藻的显著抑制(P<0.05), 整个生长周期未呈现出明显的生长曲线, 生长受到显著影响, 所能达到的最大种群密度为 0.65×104cell/mL, 仅为单培养时的 32.5%。初始生物量比 Cm∶Ph=3∶1时, 14d之后, 除了28d, 海洋卡盾藻的生长受到青岛大扁藻的显著抑制(P<0.05), 海洋卡盾藻的生长曲线在8d之前呈指数增长, 8d到20d未呈现指数增长曲线, 20d之后到达平台期, 所能达到的最大种群密度为4.39× 104cell/mL, 仅为单培养时的68.6%, 可见青岛大扁藻也对海洋卡盾藻的生长产生了影响。
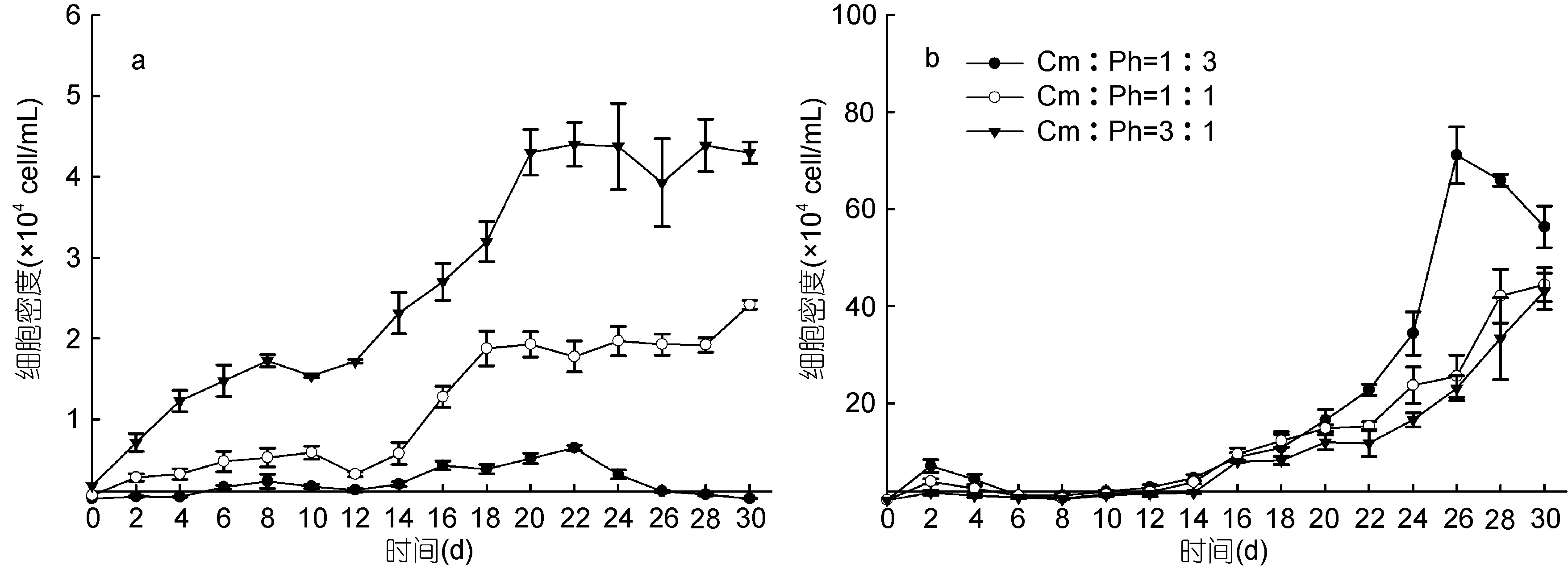
图2 共培养条件下不同初始生物量比的海洋卡盾藻和青岛大扁藻的生长曲线Fig.2 The growth curves of C. marina and P. helgolandica in co-culture at different initial biomass ratios
2.3 海洋卡盾藻去藻过滤液和藻细胞裂解液对青岛大扁藻生长的影响
图3a为添加海洋卡盾藻去藻过滤液的青岛大扁藻的生长曲线, 与对照组相比, 除了 2d的低浓度组外, 3个添加海洋卡盾藻去藻过滤液的处理组中青岛大扁藻的生长均受到显著抑制(P<0.05), 对照组与添加 5.56、16.67和 50mL去藻过滤液的处理组在 10d时的比生长速率分别为0.309、0.284、0.273、0.247。可见添加滤液体积越大, 青岛大扁藻受抑制效果越明显, 滤液浓度最高的实验组在10d时青岛大扁藻藻细胞密度比对照组低46.27%。
海洋卡盾藻藻细胞裂解液对青岛大扁藻生长的影响与去藻过滤液类似(图3b)。与对照组相比, 除了6d、10d的低浓度组和2d的中浓度组外, 3个添加海洋卡盾藻藻细胞裂解液的处理组中青岛大扁藻的生长均受到显著抑制(P<0.05), 对照组与添加 5.56、16.67和50mL裂解液的处理组在10d时的比生长速率分别为 0.303、0.289、0.258、0.211。高浓度抑制效果更明显, 添加裂解液比例最高的实验组中的青岛大扁藻在10d时的藻细胞密度比对照组低60.12%,可见海洋卡盾藻藻细胞裂解液对青岛大扁藻生长的抑制作用比去藻过滤液更显著。
2.4 海洋卡盾藻和青岛大扁藻间化感作用对 UV-B辐射增强的响应
从图4可以看出, 单培养条件下, 2.16J/m2UV-B辐射处理96h后, 海洋卡盾藻和青岛大扁藻的生长均受到抑制。UV-B辐射组藻细胞密度一直低于日光灯对照组, 且初始密度高的海洋卡盾藻和青岛大扁藻实验组比初始密度低的实验组表现出更强的抗性,200cell/mL的海洋卡盾藻实验组和青岛大扁藻实验组96h内的生长均受到极显著抑制(P<0.01)。
共培养条件下(图5), 经过UV-B灯管辐射处理的两种藻的生长亦均受到抑制。处理组藻细胞密度一直低于对照组, 其中1∶1实验组和3∶1实验组的海洋卡盾藻96h内受到显著抑制(P<0.05), 1∶3实验组和1∶1实验组的青岛大扁藻 96h内受到显著抑制(P<0.05),96h时, 1∶3、1∶1、3∶1实验组青岛大扁藻的细胞密度只有对照组的 50.49%、40.11%、87.27%, 而单培养UV-B处理条件下, 96h时600cell/mL青岛大扁藻实验组的细胞密度为对照组的 82.33%, 可见 1∶3和 1∶1实验组中, 海洋卡盾藻对青岛大扁藻化感作用产生的影响较UV-B辐射明显, 而3∶1实验组中,UV-B辐射处理下, 添加海洋卡盾藻共培养与青岛大扁藻单培养实验结果差异不大, 以上结果表明: UV-B辐射使海洋卡盾藻对青岛大扁藻的化感作用减弱。
3 讨论
3.1 影响海洋卡盾藻化感物质产生和作用的因素
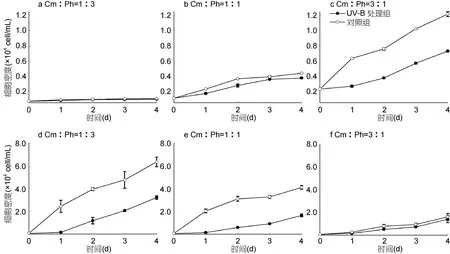
图5 共培养海洋卡盾藻和青岛大扁藻种群生长对UV-B辐射增强的响应Fig.5 Effect of UV-B radiation on the growth of C. marina and P. helgolandica in the co-culture
藻类产生的化感物质属于次级代谢产物, 包括肽聚糖、长链脂肪酸、有机酸和生物碱等(禚鹏基等,2007)。影响化感物质产生和作用的因素包括营养盐限制、光照、pH、生长时期、细胞浓度、种间相互影响等, 例如营养盐水平不只影响化感物质的产生,还会影响化感物质对于目标微藻的作用(禚鹏基等,2007); 生长时期方面亚历山大藻属(Alexandrium)在平台期的化感作用比指数生长期要强(Arzul et al,1999), 而多鳞金色藻(Chrysochromulina polylepis)与之相反(Schmidt et al, 2001); 细胞浓度方面作用藻和目标藻的细胞浓度高低都会对化感作用产生影响,产生化感物质的作用藻的藻细胞密度越高, 产生的化感物质浓度越高, 化感作用越明显(Skovgaard et al,2003; Tillmann, 2003), 也有研究表明目标藻浓度升高会使化感作用减弱(Tillmann, 2003), 因此本实验在实验设计中人为控制了营养盐、光照、pH、生长时期和细胞浓度这5个因素排除其对实验结果的干扰。
不同处理的海洋卡盾藻与青岛大扁藻共培养实验体系中, 控制各实验组的光照、pH、营养盐等资源竞争因素相同, 使用处于同一生长时期的微藻进行实验, 且整个实验体系使用无菌海水, 可以排除天然海水中细菌对微藻生长的影响。结果证明海洋卡盾藻藻液、去藻过滤液和藻细胞裂解液均能显著抑制青岛大扁藻的生长, 化感物质的产生是海洋卡盾藻抑制青岛大扁藻生长的主要原因, 且随着海洋卡盾藻初始密度的升高, 共培养体系中存在的化感物质增加,海洋卡盾藻对青岛大扁藻的化感作用增强, 有关海洋卡盾藻对有害赤潮藻链状裸甲藻(Gymnodinium catenatum)化感作用的最新研究也表明, 海洋卡盾藻化感物质的产生量与初始细胞密度成正比(Fernández-Herrera et al, 2016)。
3.2 海洋卡盾藻与青岛大扁藻间化感作用的作用方式和途径
化感作用主要通过2种途径进行, 一种是细胞间直接接触抑制, 一种是通过分泌次生物质产生抑制作用。实验方法上, 共培养的优点是产生化感物质的藻可以与目标藻生活在同样的理化条件下, 减少除化感作用外其他因素的影响, 同时可降低去藻过滤液母液制备过程中光合细菌可能对化感物质产生的影响(Granéli et al, 2006)。
使用去藻过滤液可以研究分泌到水体中的化感物质, 不仅可避免藻细胞接触的影响, 还可以消除两种藻间营养盐竞争带来的干扰, 缺点是有些化感物质不稳定、易分解; 使用藻细胞裂解液可以研究藻细胞内产生的化感物质对实验种群的影响。本研究使用了去藻过滤液和藻细胞裂解液两种方法研究两种微藻间的化感作用从而判断两种作用方式中哪种起主要作用。
已有实验研究表明, 化感物质可通过细胞间直接接触传递至目标细胞, 当存在细胞接触时化感作用一般更显著, 例如赤潮异弯藻对其他微藻种群的抑制作用主要通过细胞间直接接触实现, 起抑制作用的部位位于细胞表面(Gross, 1999; Uchida et al,1999; Fernández-Herrera et al, 2016; 蔡恒江等, 2005a)。本实验亦证明海洋卡盾藻藻液和藻细胞裂解液对青岛大扁藻生长的抑制作用比去藻过滤液显著, 海洋卡盾藻释放的可溶性化感物质具有活性, 但海洋卡盾藻对青岛大扁藻的化感作用主要通过细胞直接接触实现, 通过胞外物质传递产生的化感作用不如前者显著。这与钟恢明等(2011)研究中肋骨条藻(Skeletonema costatum)与海洋原甲藻(Prorocentrum micans)种间关系的结果类似, 种间干扰可不需要介质由细胞间直接接触完成。虽然也有研究用去藻过滤液培养目标藻并产生化感作用, 证明细胞间的直接接触不是必需的, 但是有些藻分泌的化感物质不稳定、具半衰期, 不能充满培养液, 化感作用因作用范围有限需要靠细胞传递才能实现作用, 因此有些藻只能通过细胞接触在细胞周围产生化感作用(Gentien,2006)。但也有研究与本实验结果不同, 徐艳红等(2012)的研究表明海洋卡盾藻藻液和藻滤液对卤虫(Artemia sinica)均有毒性作用, 藻液对卤虫的毒性作用虽高于滤液, 但两者之间的差距不明显, 说明藻细胞胞内合成并分泌于细胞表面或释放到水体的有毒物质可能是卤虫死亡的主要原因。
微藻化感作用会对目标藻种的藻细胞结构、运动能力、细胞分裂、离子水分吸收、水分子平衡、新陈代谢、光合作用、呼吸作用、酶活性、信息传递和基因表达等各方面产生影响(Fernández-Herrera et al,2016; 冀晓青等, 2011), 引起目标藻细胞消散、麻痹、生长抑制, 甚至死亡, 作用途径包括: 对光合系统产生影响; 酶水解破坏细胞表面的细胞膜离子通道; 使细胞失去活动能力; 产生具有潜在生长抑制作用的胞外产物; 藻体直接接触影响等(禚鹏基等, 2007)。例如: 实球藻(Pandorina morum)滤液会抑制球团藻(Volvox globator)的光合作用(Harris, 1970); 海洋卡盾藻可通过接触信号引起链状裸甲藻细胞形态发生改变, 例如失去鞭毛和运动能力、肿胀、失去带和沟、细胞核突出、细胞膜破裂、细胞溶解等, 同时诱发暂时性孢囊, 化感物质可抑制链状裸甲藻生长并使其生活史发生变化(Fernández-Herrera et al, 2016)。赤潮微藻对饵料微藻的化感作用也需要更多深入研究以从机理方面进行进一步解释。
3.3 海洋卡盾藻和青岛大扁藻之间的化感作用对UV-B辐射增强的响应
本实验中, 单培养条件下, 2.16J/m2辐射剂量能极显著抑制海洋卡盾藻和青岛大扁藻的生长(P<0.01),与蔡恒江等(2005b)的研究结果类似, 但有关UV-B辐射对微藻间化感作用影响的实验研究仍不多见, 有研究发现高剂量UV-B辐射(3.0J/m2)能使小珊瑚藻化感物质的合成量或活性显著降低, 低剂量UV-B辐射(0.9J/m2)使小珊瑚藻中化感物质的合成量或活性显著升高, 且UV-B作用并没有使小珊瑚藻细胞间直接接触的作用方式改变(周立明, 2008)。本实验中, 共培养条件下, 添加的 2.16J/m2UV-B辐射能通过影响海洋卡盾藻的生长抑制其对青岛大扁藻的化感作用。
先前的研究表明, UV-B辐射具有较高能量, 能够改变芳香族氨基酸的结构, 进而改变陆生植物体内多种蛋白质的合成过程与功能(Sinha et al, 1998)。蔡恒江等(2005b)的研究证明, UV-B对海洋藻类具有相似的作用, 经过 UV-B处理后, 海洋卡盾藻体内化感物质的合成和代谢可能已受到影响。赵妍等(2009)的研究表明, 高剂量 UV-B辐射(3.0J/m2)可能使小珊瑚藻体内化感物质的合成与代谢受阻, 而低剂量的UV-B辐射(0.9J/m2)则诱导和促进化感物质的合成。Jordan等(1992)通过探索指出, UV-B辐射能降低叶绿体内与光合作用有关的编码蛋白 mRNA的含量, 海洋卡盾藻化感物质产生受UV-B辐射影响的作用机制可能与此类似。本实验中, UV-B辐射可能已致使海洋卡盾藻体内化感物质的合成与代谢受阻, 但其具体作用机理仍需要进一步研究。
4 结论
(1) 海洋卡盾藻藻液、去藻过滤液和藻细胞裂解液均能显著抑制青岛大扁藻的生长, 其中细胞裂解液的抑制作用比去藻过滤液强, 海洋卡盾藻对青岛大扁藻产生化感作用, 两种藻间通过细胞间直接接触传递的化感物质比通过介质传递的多;
(2) 2.16J/m2UV-B辐射处理后, 两种藻的生长均受到抑制, UV-B辐射会通过影响海洋卡盾藻的生长减弱其对青岛大扁藻的化感作用。
马 龙, 2008. 利用经济微藻的竞争作用防治米氏凯伦藻(Karenia mikimotoi)赤潮的初步研究. 青岛: 中国海洋大学硕士学位论文, 82—87
王 悠, 俞志明, 宋秀贤等, 2006. 大型海藻与赤潮微藻以及赤潮微藻之间的相互作用研究. 环境科学, 27(2):274—280
王朝晖, 袁美玲, 骆育敏等, 2010. 海洋卡盾藻与中肋骨条藻和锥状斯氏藻种间竞争研究. 水生生物学报, 34(2):336—344
安鑫龙, 么 强, 李雪梅, 2010. 赤潮微藻海洋卡盾藻研究.安徽农业科学, 38(32): 18281, 18283
杨翠云, 赵娜娜, 夏传海等, 2011. 海洋卡盾藻无细胞滤液对赤潮微藻的作用及其与微藻的共培养. 海洋环境科学,30(6): 798—803
张培玉, 唐学玺, 董双林等, 2007. 塔玛亚历山大藻(Alexandrium tamarense)和中肋骨条藻(Skeletonema costatum)种间竞争及UV-B辐射胁迫对其影响. 海洋与湖沼, 38(2): 187—192
张培玉, 唐学玺, 蔡恒江等, 2005. UV-B辐射增强对海洋大型藻与微型藻种群生长关系的影响. 生态学报, 25(12):3335—3342
张德瑞, 郑宝福, 唐志洁, 1964. 青岛产扁藻及其形态变异.植物学报, 12(1): 109—118
周立明, 2008. 小珊瑚藻对 3种赤潮微藻的克生效应对 UV-B辐射增强的响应研究. 青岛: 中国海洋大学博士学位论文,73—84
赵 妍, 于庆云, 周 斌等, 2009. 小珊瑚藻对赤潮异弯藻的克生效应及其对 UV-B辐射增强的响应. 应用生态学报,20(10): 2558—2562
郝雯瑾, 王 悠, 唐学玺, 2008. 两种海洋微藻——强壮前沟藻与青岛大扁藻之间的相互作用研究. 中山大学学报(自然科学版), 47(z1): 98—105
钟恢明, 张 健, 刘力章, 2011. 实验条件下原甲藻与中肋骨条藻种间相互作用研究. 江西科学, 29(5): 593—596, 677
洪 喻, 许 可, 2014. 微藻间竞争机制研究进展. 环境科学与技术, 37(5): 75—81
徐艳红, 江 涛, 沈萍萍, 2012. 海洋卡盾藻对卤虫的急性毒性效应. 暨南大学学报(自然科学版), 33(5): 510—515
湛江水产专科学校, 1980. 海洋饵料生物培养. 北京: 农业出版社, 40—43
谢志浩, 俞泓伶, 曹鲁妍, 2011. UV-B辐射对强壮前沟藻(Amphidinium carterae)和等鞭金藻(Isochrysis galbana)种间竞争的影响. 海洋与湖沼, 42(6): 857—862
蔡恒江, 2004. UV-B辐射对大型-微型海藻相互作用的影响.青岛: 中国海洋大学硕士学位论文, 21—38
蔡恒江, 唐学玺, 张培玉等, 2005a. 不同起始密度对3种赤潮微藻种间竞争的影响. 生态学报, 25(6): 1331—1336
蔡恒江, 唐学玺, 张培玉等, 2005b. uv-b辐射对青岛大扁藻生长及其某些生理特性的影响. 海洋科学进展, 23(4):460—465
禚鹏基, 赵卫红, 2007. 海洋微藻之间的化感作用研究进展.海洋科学集刊, (48): 114—126
潘远健, 金 刚, 代建国等, 2015. 杜氏盐藻与 4种海洋微藻间的化感作用. 深圳职业技术学院学报, 14(3): 47—53
冀晓青, 韩笑天, 白 洁, 2011. 微藻化感作用及化感物质在赤潮演替中的作用. 海洋科学, 35(2): 92—98
Arzul G, Seguel M, Guzman L et al, 1999. Comparison of allelopathic properties in three toxic Alexandrium species.Journal of Experimental Marine Biology and Ecology,232(2): 285—295
Fernández-Herrera L J, Band-Schmidt C J, López-Cortés D J et al,2016. Allelopathic effect of Chattonella marina var. marina(Raphidophyceae) on Gymnodinium catenatum (Dinophycea).Harmful Algae, 51: 1—9
Gentien P, 2006. Allelopathy in Karenia mikimotoi: a case study.In: Abstracts, 12th International Conference on Harmful Algae. Copenhagen, Denmark, 49
Granéli E, Hansen P J, 2006. Allelopathy in harmful algae: a mechanism to compete for resources. In: Granéli E, Turner J T eds. Ecology of Harmful Algae. Berlin, Heidelberg:Springer Press, 189—201
Gross E, 1999. Allelopathy in benthic and littoral areas: case studies on allelochemicals from benthic cyanobacteria and submersed macrophytes. In: Inderjit KM, Dakshini M, Foy CL eds. Principles and Practices in Plant Ecology:Allelochemical Interactions. Boca Raton: CRC Press LLC,179—199
Guillard R R L, 1975. Culture of phytoplankton for feeding marine invertebrates. In: Smith W L, Chanley M H eds.Culture of Marine Invertebrate Animals. New York, USA:Springer Press, 29—60
Harris D O, 1970. Growth inhibitors produced by the green algae(Volvocaceae). Archiv für Mikrobiologie, 76(1): 47—50
Inderjit, Dakshini K M M, 1994. Algal allelopathy. The Botanical Review, 60(2): 182—196
Jordan B R, He J, Chow W S et al, 1992. Changes in mRNA levels and polypeptide subunits of ribulose 1,5-bisphosphate carboxylase in response to supplementary ultraviolet-B radiation. Plant, Cell & Environment, 15(1):91—98
Legrand C, Rengefors K, Fistarol G O et al, 2003. Allelopathy in phytoplankton-biochemical, ecological and evolutionary aspects. Phycologia, 42(4): 406—419
Marshall J A, Hallegraeff G M, 1999. Comparative ecophysiology of the harmful alga Chattonella marina(Raphidophyceae) form South Australian and Japanese waters. Journal of Plankton Research, 21(10): 1809—1822
Schmidt L E, Hansen P J, 2001. Allelopathy in the prymnesiophyte Chrysochromulina polylepis: effect of cell concentration, growth phase and pH. Inter-Research Marine Ecology Progress Series, 216: 67—81
Sinha R P, Hader D P, 1998. Effects of ultravjolet-B radiation in three rice field cyanobacteria. Journal of Plant Physiology,153(5—6): 763—769
Skovgaard A, Hansen P J, 2003. Food uptake in the harmful alga Prymnesium parvum mediated by excreted toxins.Limnology and Oceanography, 48(3): 1161—1166
Tevini M, Teramura A H, 1989. UV-B effects on terrestrial plants.Photochemistry and Photobiology, 50(4): 479—487
Tillmann U, 2003. Kill and eat your predator: a winning strategy of the planktonic flagellate Prymnesium parvum. Inter-Research Aquatic Microbial Ecology, 32(1): 73—84
Uchida T, Toda S, Matsuyama Y et al, 1999. Interactions between the red tide dinoflagellates Heterocapsa circularisquama and Gymnodinium mikimotoi in laboratory culture. Journal of Experimental Marine Biology and Ecology, 241(2):285—299
