二氧化硅复合微球的制备及其对His-tagged融合蛋白质的分离
2016-01-14王立,王朋,何晓锋等
二氧化硅复合微球的制备及其对His-tagged融合蛋白质的分离
王立1,王朋2,何晓锋2,邹雪艳3,赵彦保3,李宾杰4,董烁4*
(1. 河南大学 欧亚国际学院,河南 开封 475001;2. 河南大学 民生学院,河南 开封 475004;
3. 河南大学 特种功能材料重点实验室,河南 开封 475004;4. 河南大学 医学院,河南 开封 475004)
摘要:采用水热法合成了巯基纳米二氧化硅(SiO2-SH),并在其表面修饰亚氨基二乙酸基团(-IDA)得到SiO2-SH/IDA微球. 该微球从溶液中可吸附更多的Ni2+形成SiO2-SH/IDA-Ni2+复合微球. 研究结果表明,利用该复合微球可以较好地分离以组氨酸为标签(His-tagged)的融合蛋白.
关键词:复合材料;功能化;亲和分离;组氨酸
中图分类号:O61 文献标志码:A
收稿日期:2014-12-15.
基金项目:国家自然科学基金(21271062),河南省教育厅科学技术重点研究项目(14B150003).
作者简介:王立(1972-),男,实验师,主要从事复合纳米材料的制备. *通讯联系人,E-mail: BHH570@126.com.
Synthesis of silica microshpheres and separation
of His-tagged protein
WANG Li1, WANG Peng2, HE Xiaofeng2, ZOU Xueyan3, ZHAO Yanbao3,
LI Binjie4, DONG Shuo4*
(1.EurasiaInternationalCollegeofHenanUniversity,Kaifeng475001,Henan,China;
2.MinshengCollege,HenanUniversity,Kaifeng475004,Henan,China;
3.KeyLaboratoryforSpecialFunctionalMaterials,HenanUniversity,Kaifeng475004,Henan,China;
4.SchoolofMedicine,HenanUniversity,Kaifeng475004,Henan,China)
Abstract:Marcapto-silica microspheres (SiO2-SH MSs) were prepared through a solvothermal route, then these SiO2-SH MSs were further modified by conjugating iminodiacetic acid (IDA) toafford SiO2-SH/IDA MSs. These -SH groups and -IDA groups as binding sites can chelate Ni2+ ions, which can be further used to enrich and separate His-tagged proteins directly from the mixture of lysed cells without sample pretreatment. Results show that these MSs present negligible nonspecific adsorption and high protein binding, which are especially suitable for purification of His-tagged proteins.
Keywords:composite materials; functionalization; affinity separation; His-tagged
随着生命科学的发展提取高纯度的活性蛋白对于生物学及一些交叉学科有着重要意义[1-3]. 蛋白质提纯有很多方法如沉淀、透析、超过滤和层析等,但是这些方法大都需要采用多步处理,操作复杂、费时且成本较高;相比之下,亲和分离具有简便、快速的特点[4-5]. 蛋白质提纯通常要求对目标蛋白具有较高的选择性[6-7],如以六聚组氨酸为标签的(His-tagged)蛋白[8-9],它们对金属离子如镍、钴等离子具有高度的选择性,如洗脱条件温和,与金属离子结合不受变性剂影响等优良性能[10-11]. 纳米材料由于具有许多独特的物理和化学特性及生物相容性,常被用作生物载体,若进一步对纳米材料进行表面修饰还可以赋予材料特殊性能,在材料学、磁学、电学、光学、生物医学、催化等领域都将具有应用价值[12-15]. 本文作者采用巯基丙基三甲氧基硅烷为硅源,一步法制备了巯基纳米二氧化硅(SiO2-SH)微球,并在其表面修饰-IDA基团,使之成为SiO2-SH/IDA双功能团复合材料,显著提高了表面Ni2+的吸附量.
1实验部分
1.1 试剂与仪器
巯基丙基三甲氧基硅烷(MPS,95%)购自Alfa-Aesar公司;十六烷基三甲基氯化铵(CTAC,≥98.0%)购自国药集团化学试剂有限公司;三乙醇胺(TEA,≥98.0%);γ-缩水甘油醚氧丙基三甲氧基硅烷(KH560)和亚氨基二乙酸(IDA,98%)均购自阿拉丁公司;氯化镍(NiCl2·6H2O)购自天津市科密欧化学试剂有限公司.
样品的形貌及组成分别使用透射电子显微镜(TEM,JEOL JEM-2010型,日本电子株式会社)、傅立叶变换红外光谱仪(FT-IR,AVATAR360型,美国尼高力公司)、热重分析仪(TG,TGA/SDTA851e,Merrler-Toledo Instruments公司)进行检测. 捕获的His-tagged蛋白用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳检测(SDS-PAGE,Power PAC 300,郑州宝赛科贸有限公司),稳压电压为70 V,分离电压为120 V. 捕获蛋白的含量用紫外-可见分光光度计(UV-Vis,nanodrop 2000c,美国Thermo公司)进行测定,测定波长为400 nm.
1.2 实验部分
1.2.1SiO2-SH的制备
在50 mL烧瓶中加入17 mL去离子水,2.8 mL无水乙醇和0.03 g CTAC,搅拌10 min;加入1.1 mL TEA,继续搅拌20 min;升温至60 ℃,加入0.14 mL MPS的混合物,继续反应3 h;得到的产物转入50 mL高压反应釜中,于110 ℃反应48 h,自然冷至室温. 离心分离反应溶液,固体产物用盐酸乙醇溶液洗涤3次以去除模板,然后用无水乙醇和去离子水各洗涤3次,于60 ℃烘干即得到SiO2-SH样品.
1.2.2SiO2-SH/IDA的制备
称取0.8 g IDA和0.5 g NaOH加入100 mL三口瓶内,再加入10 mL水;控制溶液温度为0 ℃,加入1.0 g KH560,磁力搅拌20 min,升至室温反应4 h,再升温至65 ℃继续反应12 h. 所得溶液标记为样品1.
取3 mL 样品1加入100 mL三口瓶内,用6 mol·L-1HCl溶液调pH=3;加水稀释至10 mL,再调 pH=2,加入0.2 g SiO2-SH样品,升温至90 ℃,反应3 h;沉淀分别用无水乙醇和去离子水洗涤3次,即得SiO2-SH/IDA样品.
1.2.3SiO2-SH/IDA微球吸附Ni2+
准确称取3 mg SiO2-SH/IDA样品分散在50 mL 2 mol·L-1NiCl2溶液中,放入25 ℃水浴中,震荡反应2 h;反应后沉淀用水反复洗涤6次,得到SiO2-SH/IDA-Ni2+样品,样品分散在1 mL 25%的乙醇中备用.
1.2.4SiO2-SH/IDA-Ni2+微球对His-tagged蛋白的分离
本文中分离的蛋白为His-tagged Thioredoxin (His-tagged TRX)[16],来自于PET-32a质体[17],被植入大肠杆菌体内进行表达[18]. 一般来说,所有His-tagged融合蛋白都可以用亲和分离的方法捕获分离. 蛋白分离的具体步骤如下:首先用1 000 μL破菌buffer (20 mmol·L-1Tris-HCl,含0.2 mol·L-1NaCl) 洗涤SiO2-SH/IDA-Ni2+复合材料,然后将这些复合材料分散到1 500 μL 细胞裂解液中,在摇床上 (90 r/min)于 4 ℃孵育2 h;随后,将捕获了目标蛋白的复合材料用破菌buffer离心洗涤数次以去除表面残留的蛋白;最后,捕获的His-tagged TRX蛋白用一定浓度的300 μL咪唑进行洗脱,取适量洗脱后的蛋白进行SDS-PAGE分析,剩余的部分用于目标蛋白浓度的定量检测.
2结果与讨论
图1为SiO2-SH/IDA样品的TEM(a)、FT-IR(b)和TG(c)图. 从图1a可以看出,制备的样品为核壳结构,粒径均一,分散性好,平均粒径为120 nm. 从图1b可以看出,1 124、801和471 cm-1有明显的吸收峰,分别归属于Si-O-Si的反对称伸缩吸收、对称伸缩振动吸收及弯曲振动吸收,说明制备的样品主要成分为SiO2[19]. 在2 550 cm-1处为-SH的伸缩振动[20],说明制备的样品表面含有-SH. 2 926 cm-1为亚甲基的伸缩振动峰,另外在687 cm-1为IDA中-NH键的伸缩振动峰[21]. 从图1c的TG曲线可以看出,从220 ~700 ℃有明显的失重,总失重率约为54.7%,这主要是由于表面修饰的-SH和-IDA基团的热分解所致.
蛋白质的亲和分离已成为蛋白质分离中的重要方法,配体与靶蛋白之间通过特异性识别,可从混合蛋白中实现对目标蛋白的分离纯化. 为了提高对目标蛋白的亲和分离效率,可将长短不一的连接臂分子插入配体与基体之间,以减小空间位阻. 图2为SiO2-SH/IDA-Ni2+样品以及分离His-tagged TRX蛋白质的示意图. 本文作者利用制备的SiO2-SH纳米球为载体,通过在其表面修饰一层-IDA基团,从而键合了长短相间的两种连接臂,减小了分离蛋白时的空间位阻,从而可以更好的实现对目标蛋白的分离.

图1 SiO 2-SH/IDA样品的TEM(a)、FT-IR(b)和TG(c)图 Fig.1 TEM image (a), FT-IR spectrum (b) and TG curve (c) of as-prepared SiO 2-SH/IDA samples
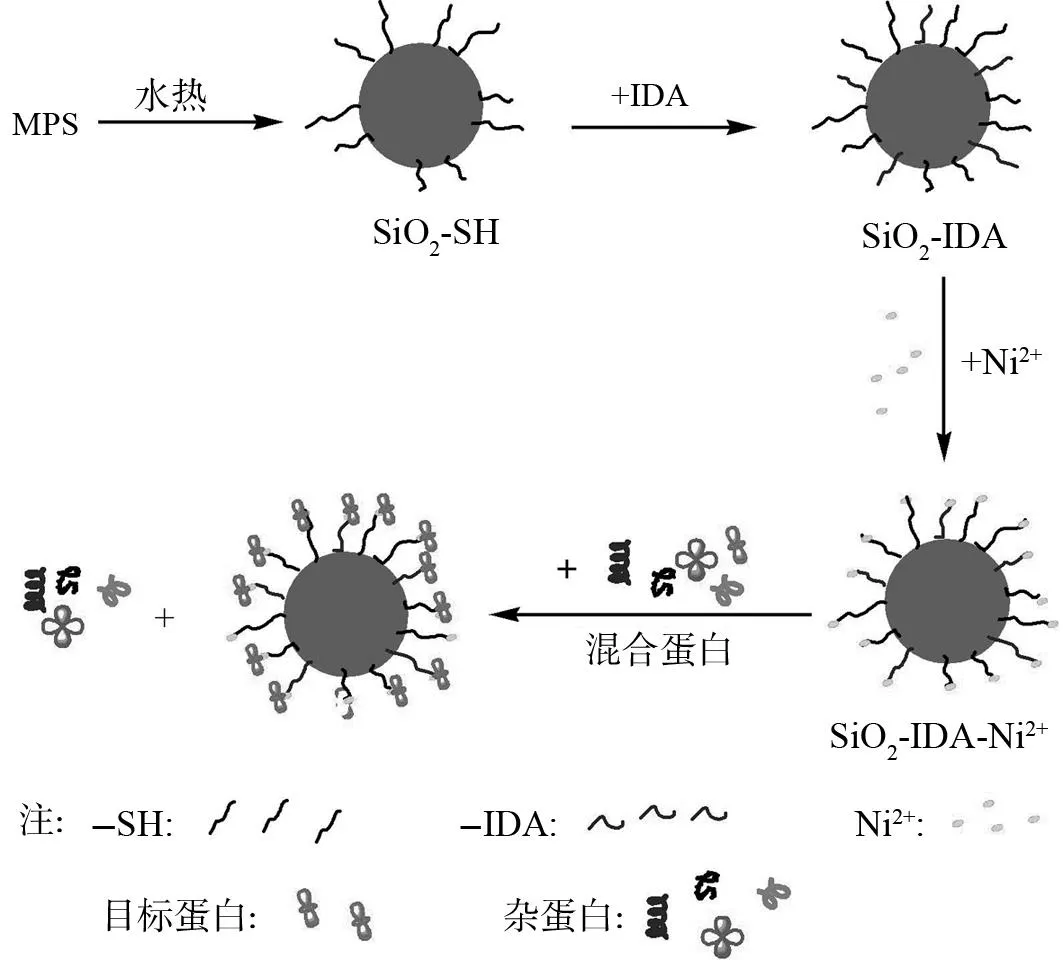
图2 样品制备及分离蛋白示意图 Fig.2 Schematic representation of the preparation procedure of SiO 2-SH/IDA-Ni 2+ and its enrichment and separation of His-tagged proteins
为了检测样品分离目标蛋白的效果,我们采用十二烷基磺酸钠-聚丙酰胺凝胶电泳(SDS-PAGE)对分离的蛋白进行检测. 图3为用不同浓度咪唑进行洗脱His-tagged TRX蛋白的电泳图. 可以看出,随着咪唑洗脱浓度的增大,杂蛋白的量也逐渐增加;当咪唑浓度为1 mol·L-1时,洗脱效果最好,可以实现对目标蛋白的特异性分离.
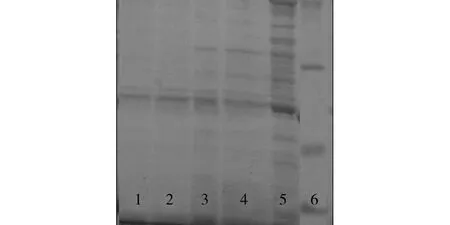
泳道: (1) 0.5 mol·L -1; (2) 1 mol·L -1; (3) 2 mol·L -1; (4) 3 mol·L -1; (5) 混合蛋白; (6) Marker. 图3 不同浓度咪唑洗脱条件下分离His-tagged TRX 融合蛋白的SDS-PAGE图 Fig.3 SDS-PAGE analysis of purified His-tagged TRX proteins by as-prepared SiO 2-SH/IDA-Ni 2+ MSs.
为了检测制备样品对His-tagged蛋白均具有特异性分离能力,我们选用了两种His-tagged蛋白(His-tagged TRX蛋白和His-tagged LOV蛋白)进行检测 (保持咪唑洗脱浓度为1 mol·L-1不变). 如图4所示,SiO2-SH/IDA-Ni2+样品对两种蛋白均具有较好的分离效果,几乎没有非特异性吸附. 采用紫外分光光度计检测分离蛋白的能力分别为2.3 mmol/g (His-tagged LOV)和4.5 mmol/g (His-tagged TRX).
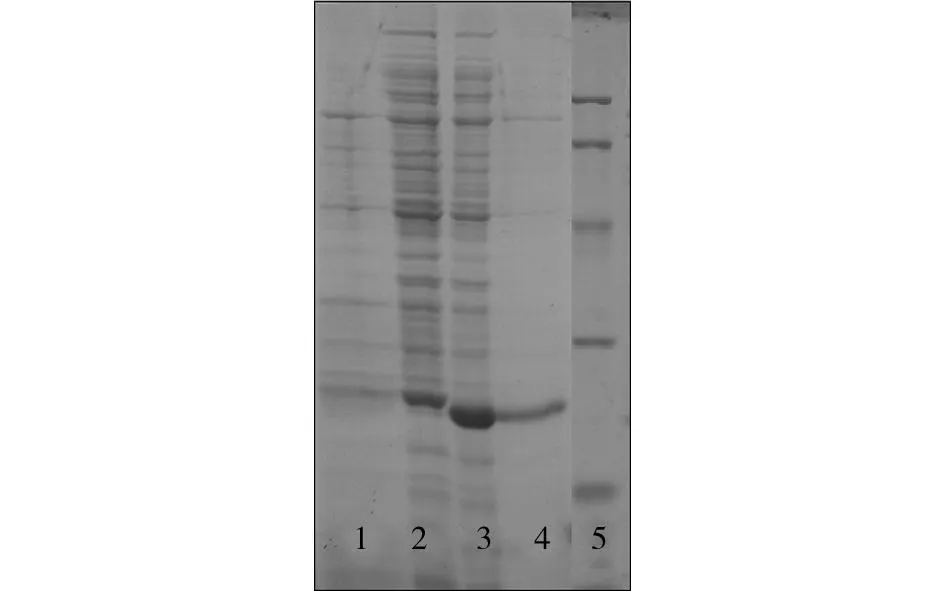
泳道: (1) 分离His-tagged TRX蛋白; (2) 含His-tagged TRX的混合蛋白; (3) 含His-tagged LOV的混合蛋白; (4) 分离His-tagged LOV蛋白; (5) Marker. 图4 SiO 2-SH/IDA-Ni 2+样品分离不同 His-tagged融合蛋白的SDS-PAGE图 Fig.4 SDS-PAGE analysis of the fractions washed off from SiO 2-SH/IDA-Ni 2+ MSs when different kinds of His-tagged proteins were used
3结论
采用水热法合成了表面带巯基的纳米二氧化硅(SiO2-SH),并在其表面修饰-IDA基团,再用其吸附溶液中的Ni2+,得到SiO2-SH/IDA-Ni2+微球. 用此微球对His-tagged TRX蛋白进行分离,实验证明其可以特异性的分离目标蛋白,分离蛋白的能力为4.5 mmol/g,显示出较好的应用前景.
参考文献:
[1] MARTIN C, JAN S, HANA C, et al. Advances in purification and separation of posttranslationally modified proteins [J]. J Proteomics, 2013, 92: 2-27.
[2] NIU R, QIN S L. Progress in research of protein separation-and purification-techniques [J]. Chemical Technology Market, 2010, 33(4): 16-18.
[3] CHEN H Y, ZHANG C X, MA X K, et al. Strategies on the separation and purification of protein [J]. J Anhui Agri Sci, 2009, 37(36): 17849-17851.
[4] LEE I S, LEE N, PARK J, et al. Ni/NiO core/shell nanoparticles for selective binding and magnetic separation of histidine-tagged proteins [J]. J Am Chem Soc, 2006, 128 (33): 10658-10659.
[5] LEE K S, LEE I S. Decoration of superparamagnetic iron oxide nanoparticles with Ni2+: agent to bind and separate histidine-tagged proteins [J]. Chem Commun, 2008,14(6): 709-711.
[6] XIE H Y, ZHEN R, WANG B, et al. Fe3O4/Au core/shell nanoparticles modified with Ni2+- nitrilotriacetic acid specific to histidine-tagged proteins [J]. J Phys Chem C, 2010, 114 (11): 4825-4830.
[7] YANG L R, GUO C, CHEN S, et al. pH-sensitive magnetic ion exchanger for protein separation [J]. Ind Eng Chem Res, 2009, 48 (2): 944-950.
[8] 许艳, 万敏, 张培因, 等. 六聚组氨酸在重组蛋白中的位置对镍亲和层析的影响[J]. 医学分子生物学杂志, 2004,1(2): 90-93.
[9] HUANG Y, SHI R N, ZHONG X F, et al. Enzyme-linked immunosorbent assays for insulin-like growth factor-I using six-histidine tag fused proteins[J]. Anal Chim Acta, 2007, 596(1): 116-123.
[10] AHRENDS R, PIEPER S, NEUMANN B, et al. Metal-coded affinity tag labeling: a demonstration of analytical robustness and suitability for biological applications [J]. Anal Chem, 2009, 81(6): 2176-2184.
[11] KIM J, PIAO Y, LEE N, et al. Magnetic nanocomposite spheres decorated with NiO nanoparticles for a magnetically recyclable protein separation system [J]. Adv Mater, 2009, 22(1): 57-60.
[12] 段涛, 杨玉山, 彭同江, 等. 核壳型纳米复合材料的研究进展[J]. 材料导报, 2009, 23(2): 19-23.
[13] 邹雪艳, 董烁, 李宾杰, 等. 纳米材料在蛋白质分离中的应用[J]. 化学研究, 2014, 25(5): 543-550.
[14] ZOU X Y, LI K, ZHAO Y B, et al. Ferroferric oxide/L-cysteine magnetic nanospheres for capturing histidine-tagged proteins [J]. J Mater Chem B, 2014, 1: 5108-5113.
[15] 李广录, 何涛, 李雪梅. 核壳结构纳米复合材料的制备及应用 [J]. 化学进展, 2011, 23(6): 1081-1089.
[16] JENG M F, CAMPBELL A P, BEGLEY T, et al. High-resolution solution structures of oxidized and reduced Escherichia coli thioredoxin [J]. Structure, 1994, 2(9): 853-868.
[17] LAVALLIE E R, REHEMTULLA A, RACIE L A, et al. Cloning and functional expression of a cDNA encoding the catalytic subunit of bovine enterokinase [J]. J Biol Chem, 1993, 268 (31): 23311-23317.
[18] SAMBROOK J, RUSSELL D W. Molecular cloning: a laboratory manual [M]. New York: Cold Spring Harbor Laboratory Press, 2001: 33-34.
[19] 邹雪艳, 褚留杰, 董烁, 等. 生物功能化纳米SiO2微球的构建及对谷胱甘肽S-转移酶的捕获分离 [J]. 高等学校化学学报, 2012, 33(7): 1394-1400.
[20] LI B J, ZOU X Y, ZHAO Y B, et al. Biofunctionalization of silica microspheres for protein separation [J]. Mat Sci Eng C, 2013, 33: 2595-2600.
[21] ZOU X Y, LI K, YIN Y B, et al. Synthesis of petal-like ferric oxide/cysteine architectures and their application in affinity separation of proteins [J]. Mat Sci Eng C, 2014, 34: 468-473.
[责任编辑:毛立群]
