乙偶姻对解淀粉芽胞杆菌细胞生理的影响
2016-01-13罗秋玲,吴静,邬敏辰

乙偶姻对解淀粉芽胞杆菌细胞生理的影响
罗秋玲1,2,3,吴静1,邬敏辰1
(1.江南大学 无锡医学院,江苏无锡214122; 2.江南大学 药学院,江苏无锡214122;
3.江南大学 食品科学与技术国家重点实验室,江苏无锡214122)
摘要:以出发菌株解淀粉芽胞杆菌FMME044和其突变株E-11为研究对象,研究在不同浓度乙偶姻胁迫下,菌株的细胞活力、细胞存活率、胞内蛋白含量、膜电位和膜通透性的变化。结果表明:在不同乙偶姻浓度下,突变株 E-11 的细胞活力、菌体存活率、胞内蛋白含量和膜电位均高于出发菌株 FMME044。当乙偶姻质量浓度为40、60 和80 g/L时,与出发菌株相比,突变株 E-11 的细胞活力分别提高了7.16%、17.7%和 40.1%;存活率分别提高了9.09%、18.3%和38.2%;胞内蛋白含量分别提高了9.63%、19.1%和31.6%;膜电位比出发菌株分别提高了 6.28%、9.14%和 27.1%。突变株 E-11 的膜通透性低于出发菌株,分别降低了6.33%、16.1%和33.1%。在抵抗外界乙偶姻情况下,乙偶姻耐受性菌株 E-11 的这些参数均高于出发菌株(膜通透性相反)。说明乙偶姻会对细胞产生毒性,但这种毒性可以通过增加菌体自身抗性而得以缓解。
关键词:Bacillus amyloliquefaciens;乙偶姻;细胞生理;耐受性;毒性
doi:10.3969/j.issn.1672-3678.2015.06.009
收稿日期:2014-04-11
基金项目:国家高技术研究发展计划(863计划)(2012AA022108);国家自然科学基金(31101229);无锡市科技支持项目(CLE01N1111)
作者简介:罗秋玲(1988—),女,河南周口人,硕士研究生,研究方向:生物工程;吴静(联系人),副教授,wujing@jiangnan.edu.cn;邬敏辰(联系人),教授,biowmc@126.com
中图分类号:Q935
文献标志码:A
文章编号:1672-3678(2015)06-0049-06
Abstract:We studied the effects of acetoin on cell vitality,cell survival,cell protein content,cell of the membrane potential and membrane permeability of both the mutant E-11 and the starting strain FMME044. Under different acetoin concentrations,cell vitality,cell survival,cell protein content,cell of the membrane potential of the mutant E-11 increased than those of FMME044. When the concentration of acetoin at 40,60 and 80 g/L,compared with the starting strain FMME044,its cell vitality improved 7.16%,17.7% and 40.1%,respectively;its cell survival improved 9.09%,18.3% and 38.2%,respectively;its cell protein content improved 9.63%,19.1% and 31.6%,respectively.The membrane potential improved 6.28%,9.14% and 27.1%,respectively. Whereas the membrane potential of the mutant E-11 reduced (6.33%,16.1% and 33.1% than that of the control,respectively,when acetoin concentrations to 40,60 and 80 g/L). Furthermore,under the condition of resistance to acetoin,these parameters of the acetoin-tolerant mutant E-11 were higher than those of FMME044 (membrane permeability and vice versa). All these illustrate that the presence of acetoin could produce toxic to cells,but the toxicity could be eased by increasing bacteria tolerance to acetoin.
Keywords:Bacillus amyloliquefaciens; acetoin; cell physiology; tolerance; toxicity
Effects of acetoin on Bacillus amyloliquefaciens cell physiology
LUO Qiuling1,2,3,WU Jing1,WU Minchen1
(1.Wuxi Medical School,Jiangnan University,Wuxi 214122,China;2.School of Pharmaceutical Science,
Jiangnan University,Wuxi 214122,China;3.State Key Laboratory of
Food Science and Technology,Jiangnan University,Wuxi 214122,China)
乙偶姻作为一种重要的化学合成中间体,广泛应用于食品、制药、化工等领域[1-3],已被美国能源部指定为优先开发的平台化合物。目前,乙偶姻的生成方法主要包括化学法、酶转化法和微生物发酵法。与化学合成法和酶转化法相比,微生物发酵法生产乙偶姻具有生产效率高、原料来源广泛、成本低廉等优势,因此,开展微生物发酵法生产乙偶姻的技术研究,具有重要意义。安全菌株,如解淀粉芽胞杆菌(Bacillusamyloliquefaciens)、短小芽胞杆菌(Bacilluspumilus)、枯草芽胞杆菌(Bacillussubtilis)和地衣芽胞杆菌(Bacilluslicheniformis)等,都是乙偶姻生产最常使用的发酵菌株,它们都具有发酵速度快、高产乙偶姻等优良特性。然而,在发酵后期,高浓度乙偶姻的毒性影响到菌体的生长、存活和发酵能力,进而限制了乙偶姻浓度的提高。Zhu等报道,高浓度乙偶姻的存在不但影响菌体生长,而且也会影响聚-L-谷氨酸(γ-PGA)的发酵生产。
目前,微生物发酵生产乙偶姻的研究主要集中于以下四个方面:解析代谢机制[10],调控代谢流量、抑制产物分解[11],筛选高产菌株[12],静息细胞法生成高纯度立体异构体乙偶姻[13]。虽然,有文献报道可以通过增加提高底物耐受性来提高乙偶姻的产量,但是人们却忽略了菌株对产物乙偶姻的耐受性。乙偶姻作为有机溶剂对细胞产生毒性,高浓度的乙偶姻甚至会造成细胞死亡,进而影响细胞进一步生成乙偶姻。因此,为了更进一步加强乙偶姻的产量和生产强度,需要了解乙偶姻抑制生理学基础,分析菌株耐受乙偶姻机制,通过代谢工程手段改造解淀粉芽胞杆菌,提高其对乙偶姻的耐受能力,从而提高乙偶姻产量。
笔者应用乙偶姻处理出发菌株(B.a ̄m ̄y ̄l ̄o ̄l ̄i ̄q ̄u ̄e ̄f ̄a ̄c ̄i ̄e ̄n ̄sFMME044)和耐受高浓度乙偶姻突变株E-11,四甲基偶氮唑盐(MTT)法测定细胞活力、血球计数法计算细胞存活率、分光光度计法测定细胞内蛋白含量、荧光分光光度计检测罗丹明123(Rh123)和二乙酸荧光素(FDA)细胞染色的荧光强度的变化,来探讨细胞经不同浓度乙偶姻处理细胞生长性能、膜电位和膜透性的变化,初步研究菌株耐受高浓度乙偶姻的机制,以期为选育优良菌株和提升乙偶姻发酵生产奠定基础。
1材料与方法
1.1 菌种
解淀粉芽胞杆菌(B.amyloliquefaciensFMME044)保藏于笔者所在实验室。耐受乙偶姻的突变株E-11是由B.amyloliquefaciensFMME044经亚硝基胍诱变和适应性进化筛选获得。
1.2 主要试剂和仪器
1.2.1主要试剂和仪器
NaCl、KCl、Na2HPO4、KH2PO4、二甲亚砜,国药集团化学试剂有限公司;四甲基偶氮唑盐(MTT)、罗丹明123 (Rh123)、二乙酸荧光素(FDA),Sigma公司;UVmini-1240型紫外-可见光分光光度计、F-4500型荧光分光光度计,日本岛津公司;1-14DE型冷冻离心机,Sigma公司;iMARK酶标仪,伯乐公司;XO-65D型超声波细胞破碎仪,南京先欧仪器制造有限公司。
1.2.2主要试剂的配制
1) 0.01 mol/L磷酸盐缓冲液(PBS)的配制。称取8 g NaCl、0.2 g KCl、1.44 g Na2HPO4和0.24 g KH2PO4,溶于800 mL蒸馏水中,用HCl调节溶液的pH至7.4,最后加蒸馏水定容至1 L即可。
2)配制MTT溶液。精确称取0.5 g MTT,用蒸馏水定容至100 mL,4 ℃避光贮存于冰箱备用。
3)配制Rh123溶液。用无水乙醇配制0.19 mg/mL的Rh123溶液,4 ℃避光贮存于冰箱备用。
4)配制FDA溶液。精确称取200 mg FDA,用丙酮定容至100 mL,4 ℃避光贮存于冰箱备用。
1.3 培养基
种子培养基(g/L):葡萄糖60、酵母粉10、大豆蛋白胨10、牛肉膏10、NaCl 5。
固体培养基(g/L):葡萄糖20、酵母粉10、大豆蛋白胨10、NaCl 5、琼脂粉20。pH 7.0。
乙偶姻耐受性机制研究的培养基(g/L):乙偶姻(0、40、60和80)、 葡萄糖60、酵母粉12.5、大豆蛋白胨12.5、K2HPO43、KH2PO43、MgSO4·7H2O 0.4。
1.4 实验方法
1.4.1细胞培养与处理
从冷藏的甘油管中取0.2 mL接入装有50 mL种子培养基的500 mL三角瓶中,37 ℃、200 r/min振荡培养12 h。按10%的接种量将种子接入含有70 mL乙偶姻耐受性机制研究培养基的750 mL摇瓶中,37 ℃、200 r/min振荡培养6 h,然后加入乙偶姻,使培养基乙偶姻质量浓度最终为0、40、60和80 g/L,6 h后取样测指标。
1.4.2细胞活力检测
取经过不同浓度乙偶姻处理的细胞,调OD600至1.0,加入96孔培养板(100 μL/孔)中。然后再加入MTT 20 μL/孔,放置于37 ℃培养箱中培养4 h,培养结束后,小心吸弃各个培养孔内上清液,之后每孔加入100 μL的二甲亚砜并振荡摇匀10 min,在酶标仪上测定各孔吸光度A490(波长490 nm)[14]。
1.4.3菌体存活率的测定
用平板计数法[15]测定存活率,在无菌台下把不同条件处理的细胞稀释到OD600=1,取相同体积的稀释液,5 000 r/min,离心5 min,收集菌体,用相同体积的生理盐水重悬洗涤2次,然后悬浮于生理盐水中。取1 mL悬浮液将细胞稀释到10-4、10-5和10-6后,各取0.1 mL涂布于固体培养基平板中,37 ℃培养1 d,计算菌落数(每个梯度3个平行)。菌体存活率计算见式(1)。
存活率=存在乙偶姻的菌落数/对照菌落数×100%
(1)
1.4.4胞内蛋白含量的测定
取经过不同浓度乙偶姻处理的细胞,调OD600=1,取1 mL于离心管中,5 000 r/min离心5 min收集菌体,1 mL PBS溶液洗涤2次,清除胞外残留蛋白,离心弃上清液,加入1 mL蒸馏水,200 W超声破碎细胞20 min,得胞内蛋白提取液。取20 μL蛋白提取液加入酶标板,再在各孔加入200 μL Bradford试剂,迅速振荡混匀1~2次。反应10 min后,在酶标仪上测各孔的A595值[16],计算其标准曲线见式(2)。
y=0.001 7x-0.013 8,R2=0.998 7
(2)
1.4.5膜电位和通透性的测定
参照文献[17]测定膜电位和通透性,具体方法如下。
1)膜电位的测定。取一定体积的菌液,5 000r/min离心5 min,PBS(1×)溶液重悬洗涤2次,离心弃上清液。用PBS稀释样品OD600至1.0,取0.5 mL处理好的菌悬液于离心管中加入0.19 mg/mL Rh123乙醇溶液50 μL和450 μL PBS,避光反应20 min,PBS溶液洗涤3次,离心弃上清液,加入0.5 mL PBS,使用荧光分光光度计测定。
2)膜通透性的测定。取一定体积的菌液,5 000 r/min离心5 min,PBS(1×)溶液重悬洗涤2次,离心弃上清液。用PBS稀释样品OD600至1.0,取1 mL处理好的菌悬液于离心管中加入2 mg/mL FDA 丙酮溶液500 mL和500 mL PBS,混匀、避光反应30 min,然后离心弃上清液,PBS重悬液洗涤3次,离心弃上清液并加入1 mL PBS,使用荧光分光光度计测定。
2结果与讨论
2.1 乙偶姻浓度对解淀粉芽胞杆菌生长性能的影响
2.1.1MTT实验分析乙偶姻浓度对细胞活力的影响
利用MTT方法检测经过乙偶姻处理的细胞活力,结果见图1。由图1可知: 对于突变株E-11,与未添加乙偶姻(对照)相比,乙偶姻质量浓度为40、60和80 g/L时,细胞活力分别降低了26.5%、39.9%和61.2%;对于出发菌株FMME044,与其对照组相比,乙偶姻质量浓度为40、60和80 g/L时,细胞活力分别降低了29.0%、47.2%和71.3%;当乙偶姻为0、40、60和80 g/L时,突变株E-11的细胞活力比出发菌株FMME044提高了3.50%、7.16%、17.7%和40.1%。细胞活力是表征微生物细胞的活性或活的微生物细胞数量,能及时反映微生物细胞的生长状况[14],乙偶姻的存在直接影响了细胞正常生长,但这种影响程度会因菌体对乙偶姻耐受性的提高而得以缓解。

图1 MTT分析乙偶姻浓度处理后的细胞活力变化 Fig.1 Effects of acetoin on the changes of cell vitality by MTT assay
2.1.2乙偶姻浓度对菌体存活率的影响
单纯通过测定菌体密度研究乙偶姻对菌株的影响,并不能说明菌体细胞的存活情况,因此,需要通过测定细胞的存活率来考察乙偶姻对菌株的影响。用不同浓度乙偶姻处理菌体,菌体的存活率发生变化,结果见图2。由图2可知:与对照相比,对于突变株E-11菌体存活率分别降低了22.3%(40 g/L)、44.3%(60 g/L)和64.9%(80 g/L);对于出发菌株FMME044,与对照相比,菌体存活率分别降低了28.8%(40 g/L),52.9%(60 g/L)和74.6%(80 g/L);与出发菌株相比,突变株E-11的存活率分别提高了9.09%(40 g/L),18.3%(60 g/L)和38.2%(80 g/L)。这些结果说明:乙偶姻的存在会导致细胞的死亡,浓度越大死亡率越高,通过提高菌株对乙偶姻耐受性可以减少菌体的死亡,从而进一步提高菌体发酵生产乙偶姻的能力。这也验证了在有机溶剂/水两相系统中,会有少量有机溶剂吸附在细胞表面,并能通过细胞外膜渗透进细胞周质和细胞质,对细胞膜造成破坏,导致细胞死亡[15]。

图2 乙偶姻浓度对出发菌株FMME044和 突变菌株E-11菌体存活率的影响 Fig.2 Effects of acetoin concentrations on the cell survival rate
2.1.3乙偶姻浓度对胞内蛋白外泄的影响
胞内蛋白是细胞亚细胞结构及酶系的组成物质,细胞内物质整性对于维持细胞正常生理代谢是必不可少的。为了研究在不同浓度乙偶姻存在下胞内蛋白外泄的情况,考察突变株和出发菌株在不同浓度乙偶姻处理下,经过细胞破碎后,胞内蛋白含量的变化结果见图3。

图3 乙偶姻浓度对出发菌株FMME044和突变株 E-11胞内蛋白外泄的影响 Fig.3 Effects of acetoin concentration on the leakage of intracellular proteins
由图3可知:胞内蛋白含量随着乙偶姻浓度的增加而下降。对于突变株E-11,与对照相比,乙偶姻质量浓度为40、60和80 g/L时,胞内蛋白含量分别降低了16.4%、27.7%和42.9%;对于出发菌株FMME044,与对照组相比,乙偶姻质量浓度为40、60和80 g/L时,胞内蛋白含量分别降低了18.5%、35.1%和53.6%;对比分析出发菌株与突变株E-11胞内蛋白的含量,在不同乙偶姻浓度条件下,突变株E-11胞内蛋白含量高于出发菌株,即当乙偶姻质量浓度为0、40、60 和80 g/L时,突变株E-11的胞内蛋白含量分别比FMME044高6.91%、9.63%、19.1%和31.6%。这说明,经过乙偶姻处理的菌体,细胞内容物完整性遭到破坏,胞内蛋白外泄,从而影响了菌体的正常生理代谢,导致后期发酵菌体量不断下降、转化率和生产强度下降的直接原因[18]。
2.2 乙偶姻浓度对细胞膜完整性的影响
细胞膜可以选择性地控制细胞内外营养物质和代谢产物的输送,是维持胞内渗透压的结构屏障,同时也是合成细胞壁和糖被等有关成分的重要场所。此外,细胞膜上含有与氧化磷酸化等能量代谢有关的酶系,被认为是提供细胞所需要能量的产能基地,所以细胞膜是维持细胞正常生理代谢至关重要的亚细胞结构。细胞膜完整性遭到破坏,将会导致细胞生长受阻或死亡。乙偶姻,类似丁醇之类的有机溶剂一样具有较强的疏水性,能够改变细胞膜的磷脂结构,因此影响生产菌细胞膜结构的完整性与流动性,从而对跨膜营养、离子的运输以及细胞的能量代谢产生不利影响,严重时甚至引起细胞死亡[19-21]。
2.2.1乙偶姻对膜电位的影响
Rh123是一种阳离子亲脂性荧光染料,能通过细胞膜。由于活细胞内外电势不相同,存在跨膜电位,因而Rh123能特异地吸附于细胞内膜上,Rh123的荧光强度降低,反应膜电位也随之降低或丧失[15]。所以,细胞膜经Rh123染色后,可以使用荧光分光光度计来检测荧光强度大小,探究细胞膜电位的变化,检测结果见图4。
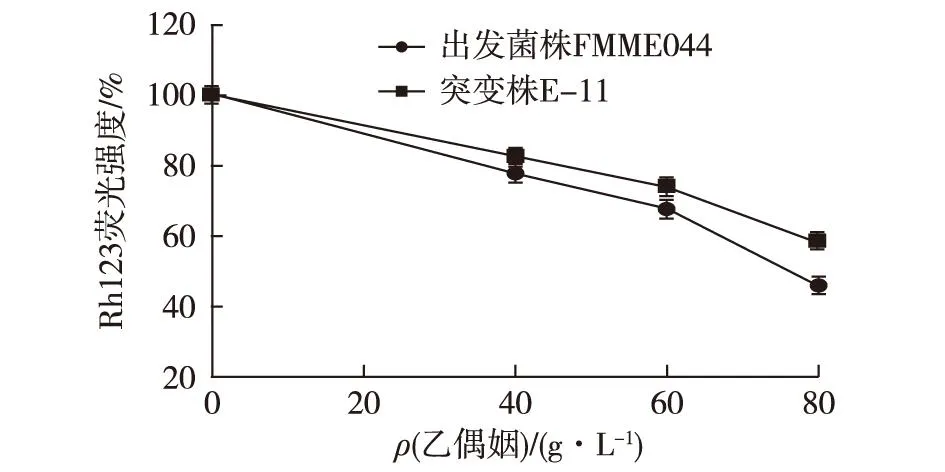
图4 乙偶姻浓度对出发菌株FMME044和突变株 E-11 Rh123荧光强度的影响 Fig.4 Effects of acetoin concentration on the Rh123 intensity
由图4可知:出发菌株与突变株E-11的Rh123荧光强度随着乙偶姻浓度的增加而不断下降,其中出发菌株荧光强度从100%(0 g/L)下降到46.1%(80 g/L),即膜电位降低了53.9%;突变株荧光强度从100%(0 g/L)下降到58.6%(80 g/L),即膜电位降低了41.4%。在不同乙偶姻浓度条件下,突变株E-11荧光强度均高于同一乙偶姻浓度时出发菌株的荧光强度。且随着乙偶姻浓度的增加,两菌的荧光强度之差逐渐增大,当乙偶姻质量浓度为40、60和80 g/L时,突变株E-11的荧光强度(膜电位)比FMME044分别高了6.28%、9.14%和27.1%。
2.2.2乙偶姻对膜通透性的影响
FDA本身虽然不能发出荧光,但它能穿透细胞膜而被细胞内的非特异性酯酶分解为黄绿色荧光的荧光素分子而产生荧光,且由于其脂溶性生化物质而得以保留于活细胞内。细胞膜受到损伤时,通透性会增加,荧光素分子便从胞浆中外漏,从而导致FDA荧光强度降低[17]。因此,可以检测荧光强度的变化来反映细胞膜的完整性及通透性变化。
考察乙偶姻浓度对突变株E-11和出发菌株FMME044膜通透性的影响,结果见图5。由图5可知:无论是突变株还是出发菌株,其FDA荧光强度随着乙偶姻浓度的增加而逐渐降低,且乙偶姻浓度越高,荧光强度变化越大。对于出发菌株,当乙偶姻质量浓度从0 g/L增至80 g/L,荧光强度从100%降为36.0%;而突变株E-11荧光强度则从100%下降为47.9%;比较出发菌株和突变株在不同乙偶姻浓度下的荧光强度发现:随着乙偶姻浓度的增加,突变株E-11荧光强度比出发菌株增加了6.33%(40 g/L)、16.1%(60 g/L)和33.1%(80 g/L),即突变株E-11的膜通透性比出发菌株降低了6.33%、16.1%和33.1%。

图5 乙偶姻浓度对出发菌株FMME044和 突变株E-11 FDA荧光强度的影响 Fig.5 Effects of acetoin concentration on the FDA intensity
当细胞处于乙偶姻环境胁迫时,乙偶姻能透过细胞膜进入细胞的内部,从而引起细胞膜的变化,细胞膜通透性和膜电位的变化能准确地反映细胞膜结构的改变,因此,可以用 FDA、Rh123 对细胞进行染色,然后通过荧光强度的变化来判别细胞膜的完整性。通过上述试验可知,加入乙偶姻后,FMME044 的膜电位与通透性变化较大,当测定时间结束时,乙偶姻质量浓度为80 g/L时,FMME044 膜通透性增加了 64.0%,膜电位下降了 53.9%,说明在高浓度乙偶姻胁迫下,FMME044细胞膜损伤较大;而 E-11 在同等条件下,膜通透性仅增加了52.1%,膜电位仅下降了41.4%,说明在乙偶姻不利环境下,E-11 细胞膜能保持较好的完整性,说明其有较好的抵抗乙偶姻冲击的能力。另一方面,细胞膜的完整性对维持细胞的活性至关重要,当其损伤严重时会引起细胞的死亡。从乙偶姻耐受性而言,E-11 的性能优于FMME044。
3结论
通过测定细胞活力、细胞存活率、胞内蛋白含量、膜电位和膜通透性来研究不同浓度乙偶姻存在下对出发菌株和突变株E-11生理的影响。结果发现在不同乙偶姻浓度下,突变株 E-11 的细胞活力、菌体存活率和胞内蛋白含量均高于出发菌株 FMME044;当乙偶姻质量浓度为40、60和80 g/L时,突变株 E-11 的细胞活力比出发菌株 FMME044 分别提高了 7.16%、17.7%和 40.1%;存活率比出发菌株分别提高了9.09%、18.3%和38.2%;胞内蛋白含量比出发菌株分别提高了9.63%、19.1%和31.6%。实验结果表明:乙偶姻的存在对细胞产生毒性,降低细胞活力和细胞存活率,引起菌株胞内蛋白外泄,破坏细胞膜。当乙偶姻质量浓度为40、60和80 g/L时,突变株 E-11 的膜电位比出发菌株分别提高了6.28%、9.14%和27.1%;膜通透性比出发菌株分别降低了6.33%、16.1%和33.1%。这说明乙偶姻是影响膜通透性增加和膜电位降低的关键因素。由此可推测乙偶姻影响菌株是通过破坏细胞膜和引发胞内物质外泄等共同作用引起的。
本文研究结果可以指导通过代谢工程手段改造解淀粉芽胞杆菌,提高其对乙偶姻的耐受能力,为更进一步加强乙偶姻的产量和生产强度奠定了基础。此外,发酵液中乙偶姻的浓度增加,还可以减少下游提取的成本和对环境的污染,利于节能与环保。
参考文献:
[1]Singh M,Krishnan P.Fermentative production of 2,3-butanediol byAerobacteraerogenes.Arch Microbiol,1959,34(2):154-157.
[2]Xiao Z J,Lv C J,Gao C,et al.A novel whole-cell biocatalyst with NAD(+) regeneration for production of chiral chemicals.PloS One,2010,5(1):e8860.
[3]Xiao Z J,Ma C Q,Xu P,et al.Acetoin catabolism and acetylbutanediol formation byBacilluspumilusin a chemically defined medium.PloS One,2009,4(5):e5627.
[4]Werpy T,Petersen G,Aden A,et al.Top value added chemicals from biomass:volume I.results of screening for potential candidates from sugars and synthesis gas[EB/OL].[2014-03-29].http://www.pnl.gov/main/publications/external/technical_reports/PNNL-14808.pdf.Oak Ridge:US Department of Energy Report.
[5]Zhang Y J,Li S B,Liu L M,et al.Acetoin production enhanced by manipulating carbon flux in a newly isolatedBacillusamyloliquefaciens.Bioresour Technol,2013,130:256-260.
[6]许平,肖梓军,杜毅.一株高产3-羟基丁酮的短小芽胞杆菌的制作方法:中国,200410084381.2.2004-11-19.
[7]刘建军,赵祥颖,田延军.一株枯草芽胞杆菌在制备3-羟基丁酮中的应用:中国,200710013403.X.2007-08-01.
[8]Liu Y F,Zhang S L,Yong Y C,et al.Efficient production of acetoin by the newly isolatedBacilluslicheniformisstrain MEL09.Process Biochem,2011,46(1):390-394.
[9]Zhu F,Cai J,Wu X,et al.The main byproducts and metabolic flux profiling of gamma-PGA-producing strainB.subtilisZJU-7 under different pH value.J Biotechnol,2013,164(1):67-74.
[10]Nicholson W L.TheBacillussubtilisydjL(bdhA) gene encodes acetoin reductase/2,3-butanedioldehydrogenase. Appl Environ Microbiol,2008,74(22):6832-6838.
[11]Sun J A,Zhang L Y,Rao B,et al.Enhanced acetoin production bySerratiamarcescensH32 using statistical optimization and a two-stage agitation speed control strategy.Biotechnol Bioproc Eng,2012,17(3):598-605.
[12]Xu H,Jia S R,Liu J J.Development of a mutant strain ofBacillussubtilisshowing enhanced production of acetoin.Afr J Biotechnol,2011,10(5):779-788.
[13]Liu Z,Qin J Y,Gao C,et al.Production of(2S,3S)-2,3-butanediol and (3S)-acetoin from glucose using resting cells ofKlebsiellapneumoniaandBacillussubtilis.Bioresour Technol,2011,102(22):10741-10744.
[14]杨翠云,刘永定.MTT方法评价微生物细胞活性的探讨.水生生物学报,2009,33(4):577-580.
[15]王永乐.大肠杆菌对有机溶剂的耐受性研究.天津:天津科技大学,2008.
[16]张春燕.中碳链脂肪酸酯类食品添加剂的制备及性能研究.南昌:南昌大学,2011.
[17]卢群,丘泰球,杨红.Rh123,FDA 荧光法测定超声作用对大肠杆菌细胞膜的影响.广东药学院学报,2006,22(2):179-180.
[18]Luo Q,Wu J,Wu M.Enhanced acetoin production byBacillusamyloliquefaciensthrough improved acetoin tolerance.Process Biochem,2014,49(8):1223-1230.
[19]Ezeji T,Milne C,Price N D,et al.Achievements and perspectives to overcome the poor solvent resistance in acetone and butanol-producing microorganisms.Appl Microbiol Biotechnol,2010,85(6):1697-1712.
[20]Isar J,Rangaswamy V.Improvedn-butanol production by solvent tolerantClostridiumbeijerinckii.Biomass Bioenerg,2012,37:9-15.
[21]Liu S,Qureshi N.How microbes tolerate ethanol and butanol.New Biotechnol,2009,26(3/4):117-121.
(责任编辑荀志金)
