酿酒酵母产D-乳酸重组菌的构建与发酵
2016-01-13汪兆峰,石贵阳,张梁

酿酒酵母产D-乳酸重组菌的构建与发酵
汪兆峰,石贵阳,张梁
(江南大学工业生物技术教育部重点实验室 粮食发酵工艺与技术国家工程实验室,江苏无锡214122)
摘要:采用基因工程方法对酿酒酵母进行代谢改造,使酵母产生乳酸代谢途径。将来源于L. mesenteroides和E.coli的D-乳酸脱氢酶基因,分别插入带有G418抗性的酵母穿梭质粒pYX212-kanMX上,电转化酵母,得到2株生产D-乳酸的酿酒酵母重组菌S. cerevisiae WE1510和S. cerevisiae WB1186。进一步摇瓶发酵试验表明:重组菌S. cerevisiae WB1186在YEPD培养基、20 g/L糖、pH 5的条件下生长条件最好,并具有更好的产乳酸能力。经3 L发酵罐条件下验证,S. cerevisiae WB1186分批发酵96 h,最终乳酸积累量达到18.0 g/L;发酵条件为培养基YEPD,接种量10%,溶解氧(DO)30%,转速150 r/min,初始葡萄糖质量浓度10 g/L,控制pH 5.0,通气量3 L/min,OD600最大值转为厌氧发酵。
关键词:D-乳酸;D-乳酸脱氢酶;Leuconostoc mesenteroides;酿酒酵母;代谢改造
doi:10.3969/j.issn.1672-3678.2015.06.002
收稿日期:2013-03-27
基金项目:国家高技术研究发展计划(863计划)(2011AA02A205、2012AA021201);教育部新世纪优秀人才支持计划(NCET-11-0665)
作者简介:汪兆峰(1987—),男,山东济南人,硕士研究生,研究方向:生物工程;石贵阳(联系人),教授,E-mail: gyshi@jiangnan.edu.cn
中图分类号:TQ812
文献标志码:A
文章编号:1672-3678(2015)06-0006-07
Abstract:A Saccharomyces cerevise strain was constructed by genetic engineering method,with lactic acid metabolic pathways. The gene dldh,encoding a lactate dehydrogenase from L. mesenteroides and E. coli,was cloned into a yeast shuttle vector PYX212-kanMX. The resultant plasmid pYX212-kanMX-DLDH was introduced into W303-1A by electroporation method and obtained two recombinant S. cerevisiae WE1510 and S. cerevisiae WB1186.Subsequently,a recombinant D-lactic acid producing yeast WB1186 was obtained,which had a better ability to produce D-lactic acid.It was up to 18.0 g/L of the lactic acid accumulation by batch fermentation in a 3-L fermenter for 96 h and the preliminary fermentation conditions were as follows,culture medium YEPD,inoculating rate 10%,DO 30%,stirring rate 150 r/min,concentration of glucose 10 g/L,pH 5.0, aeration rate 3 L/min,when OD600 up to maximum, the fermentation was turned to anaerobic.
Keywords:D-lactic acid;DLDH;Leuconostoc mesenteroides;Saccharomyces cerevisiae;metabolically engineered
Construction of metabolically engineered Saccharomyces cerevisiae forD-lactic acid production
WANG Zhaofeng,SHI Guiyang,ZHANG Liang
(National Engineering Laboratory for Cereal Fermentation Technology,Key Laboratory of Industrial Biotechnology
of the Ministry of Education,Jiangnan University,Wuxi 214122,China)
乳酸是自然界最小的手性分子,全世界近80%的厂家采用直接发酵法生产光学纯度L-乳酸。D-乳酸是合成多种手性物质的前体,在医药、农药、化工等方面的应用十分广泛[2-5]。目前,世界乳酸的总生产能力为25万t/年,总产量为13万t/年,并以每年6%~8%递增,总消费量为10万t/年,D-乳酸的市场前景广阔[6-7]。
D-乳酸的生产通常采用乳酸菌属的细菌,例如乳酸杆菌,已有报道利用纤维素和大米淀粉为原料生产D-乳酸;另一方面,由于乳酸细菌难以在高密度下培养,并且大多表现为生长营养缺陷,基因工程改造的大肠杆菌产D-乳酸渐渐发展起来[10-11]。D-乳酸发酵合成过程中,为了平衡不断降低的pH,常需要补加中和剂,如CaCO3、NaOH、Ca(OH)2等来中和所产生的乳酸[12]。而在产物提取过程中,又需要用浓H2SO4将乳酸盐进行酸化,置换出乳酸,同时形成大量CaSO4的废杂,对环境造成极大的污染[13]。酵母菌能够耐受较低的pH环境,为开发在不补加中和碱的工艺下进行有机酸发酵的工业菌种提供了可能[14-15]。Ishida等[16]在酿酒酵母菌株的染色体上整合2个拷贝的来自Leuconostocmesenteroides的dldh编码基因,同时替换掉丙酮酸脱羧酶编码基因pdc1,所获得的重组菌株SaccharomycescerevisiaeYILM-2B在补加碱中和发酵液pH的条件下,D-乳酸产量为61.5 g/L,发酵结束时pH为2.8,糖酸转化率达到0.612;在不补加碱的发酵条件下,可发酵530 g/L的葡萄糖合成54.2 g/L游离D-乳酸,其产物光学纯度在99.9%以上。此外,在马克斯克鲁维重组酵母KluyveromycesmarxianusCD590中异源表达DLDH,也可发酵合成较高浓度的D-乳酸,且产酸速率较快[15,17]。
笔者以酿酒酵母为宿主菌,采用基因工程技术构建可有效生产D-乳酸的重组酵母,以期为利用酵母发酵生产D-乳酸进行有益探索。
1材料与方法
1.1 材料
1.1.1菌株与质粒
菌株LeuconostocmesenteroidesB1186、E ̄s ̄c ̄h ̄e ̄r ̄i ̄c ̄h ̄i ̄acoli1510、S ̄a ̄c ̄c ̄h ̄a ̄r ̄o ̄m ̄y ̄c ̄e ̄scerevisiaeW303-1A来源于中国普通微生物菌种保藏管理中心(CGMCC NO.1.10327、NO.1.8732和NO.2.3853);质粒载体pYX 212-kanMX保存于工业生物技术教育部重点实验室。
1.1.2培养基
YEPD培养基(g/L):葡萄糖20,蛋白胨20,酵母膏10。用于固体培养基时添加15~20 g/L 琼脂粉;挑选转化子时添加200 μg/mL 的G418 抗生素。
LB培养基(g/L):NaCl 10,蛋白胨10,酵母膏5。用于固体培养基时添加20 g/L 琼脂粉;挑选转化子时添加终质量浓度为30 μg/mL 的卡那霉素。
发酵培养基1(g/L):葡萄糖20,酵母膏10,蛋白胨20,(NH4)2SO45,MgSO46.5,K2HPO41.5,CaCl20.55 g/L,NaNO31,KCl 1,FeSO41[18]。
发酵培养基2(g/L):葡萄糖 20,酵母膏10,(NH4)2SO45,MgSO46.5,CaCl22.0,KH2PO41.5[18]。
发酵培养基3(g/L):葡萄糖20,蛋白胨15,酵母粉25,KH2PO42.4,K2HPO4·3H2O 16.34[19]。
1.1.3酶和试剂
Taq酶、T4连接酶、限制性内切酶,购自大连TaKaRa公司;引物由上海生工技术服务有限公司合成。
1.2 方法 [20]
1.2.1细菌染色体的提取
取菌悬液1.5 mL,12 000 r/min离心2 min,收集菌体,无菌水洗涤2次,无菌水600 μL,加10~20 μL溶菌酶,轻轻混匀,37 ℃培养箱放置30 min。向其中加入60 μL 200 g/L十二烷基磺酸钠(SDS)溶液混匀,立刻加入蛋白酶K 10 μL,(注:前后时间不得超过2 min),65 ℃水浴2~6 h。温浴完毕,加入等体积的苯酚、氯仿(各300 μL)振荡,12 000 r/min离心10 min。取上清,再加入等体积的酚,氯仿抽提,进行2~4遍。取上清,加100%乙醇沉淀染色体,待烘干后加30~50 μL水溶解作为PCR模板待用。
1.2.2目的基因的PCR 扩增及克隆
根据LeuconostocmesenteroidesD-乳酸脱氢酶基因(dldh)序列(GenBank:L29327.1)设计引物。dldhb1186-U:5′-C ̄G ̄C ̄G ̄G ̄A ̄T ̄C ̄C ̄A ̄T ̄G ̄A ̄A ̄G ̄A ̄T ̄T ̄T ̄T ̄T ̄G ̄C ̄T ̄T ̄A ̄C ̄G ̄G ̄C-3′,dldhb1186-D:5′-A ̄C ̄G ̄C ̄G ̄T ̄C ̄G ̄A ̄C ̄T ̄T ̄A ̄A ̄T ̄A ̄T ̄T ̄C ̄A ̄A ̄C ̄A ̄G ̄C ̄A ̄A ̄T ̄A ̄G ̄C-3′(下划线所示分别为BamHⅠ、SalⅠ酶切位点)。PCR 反应体系体积为50 μL,扩增条件:96 ℃预变性5 min;95 ℃变性30 s,53 ℃退火60 s,72 ℃延伸90 s,共25个循环;最后72 ℃延伸10 min。
根据EscherichiacoliD-乳酸脱氢酶基因(dldh)序列(GenBank:U36928)设计引物如下。dldhe1510-U:5′-C ̄C ̄G ̄G ̄A ̄A ̄T ̄T ̄C ̄A ̄T ̄G ̄A ̄A ̄A ̄C ̄T ̄C ̄G ̄C ̄C ̄G ̄T ̄T ̄T ̄A ̄T ̄A ̄G ̄C-3′,dldhe1510-D:5′-C ̄G ̄C ̄G ̄G ̄A ̄T ̄C ̄C ̄T ̄T ̄A ̄A ̄A ̄C ̄C ̄A ̄G ̄T ̄T ̄C ̄G ̄T ̄T ̄C ̄G ̄G ̄G-3′(下划线所示分别为EcoRⅠ、BamHⅠ酶切位点)。PCR 反应体系体积为50 μL,扩增条件:95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火60 s,72 ℃延伸60 s,共30 个循环;最后72 ℃延伸10 min。
1.2.3质粒的构建
将PCR获得的D-乳酸脱氢酶基因分别用BamHⅠ和SalⅠ双酶切,EcoRⅠ和BamHⅠ双酶切,经纯化后与经同样酶切的质粒pYX212-kanMX连接,按照质量比1∶10的比例加入10 μL连接体系,于16 ℃培养箱连接过夜。次日42 ℃热击90 s转化E.coliJM109感受态细胞。37 ℃温育1 h,涂布终质量浓度100 μg/mL卡那霉素-LB抗性平板,37 ℃培养10 h。挑取转化子,用引物进行菌落PCR,挑取菌落PCR正确的转化子提取质粒,然后酶切验证目的基因的大小。构建重组质粒pYX 212-kanMX-dldhb1186与pYX 212-kanMX-dldhe1510。将验证正确的转化子送华大基因进行测序。电转化S.cerevisiaeW303-1A挑选转化子。
1.2.4酵母转化
将酵母接种于20 mL 液体YEPD 培养基,30 ℃、150 r/min 培养过夜;转接10% 菌液于50 mL YEPD 培养基中,30 ℃、150 r/min 培养8~10 h;将菌液冰浴30 min,4 ℃冷冻离心机中5 000 r/min离心5 min,收集菌体;弃上清,加入一定量提前预冷的无菌水洗涤菌体,离心收集菌体;弃上清,加入一定量提前预冷的山梨醇溶液(1 mol/L)洗涤菌体,离心收集菌体;重复3次,离心收集菌体,吸净上清,加入0.2 mL 预冷的山梨醇混匀菌体;取0.2 mL 菌悬液分装1.5 mL离心管,加入50 μL 质粒DNA,混匀,冰浴10 min,将菌悬液全部转入已预冷的电转杯中,1 500 V、5 ms电击1 次;电转之后立刻取出,用等体积的1 mol/L山梨醇溶液将转化菌从电转杯中洗出,取100 μL 涂布抗性平板。
1.2.5转化子验证
在G418抗性平板上挑取较大的转化子,点种高抗性平板传代培养,置30 ℃培养箱培养3~5 d;挑取高抗性转化子转至0.5 mL离心管中,加水30 μL混匀,沸水煮10 min作为模板,进行菌落PCR验证是否转入D-乳酸脱氢酶基因。
1.2.6发酵HPLC验证
1)种子液制备将PCR验证得到的转化子接种入YEPD培养基中(50 mL三角瓶,20 mL装液量),加G418至终质量浓度200 μg/mL,培养24 h。
2)发酵液制备接种种子液于发酵培养基(250 mL三角瓶,50 mL装液量),接种量10%,30 ℃、150 r/min培养24 h,转入厌氧发酵,瓶口保鲜膜密封,30 ℃培养箱静置2~3 d。定时取样,高效液相色谱法(HPLC)测定是否有乳酸。
3)分析方法生长量测定方法:对不同时间发酵液取样,稀释一定倍数后用721 型分光光度计于600 nm 处测其吸光值OD600。残糖测定方法:生物传感仪测定发酵液内残糖含量。HPLC法测定有机酸:发酵液经12 000 r/min 离心5 min,取700 μL 上清液加入700 μL 10%的三氯乙酸,沉淀蛋白质2 h 以上后,12 000 r/min 离心15 min,0.45 μm混纤微孔滤膜过滤后,通过HPLC进行测定。分析条件为色谱柱Shodex KC-811,流动相0.01 mol/L H2SO4,流速0.8 mL/min,进样量15 μL,柱温60 ℃,紫外检测器,检测波长210 nm。
1.2.7重组菌摇瓶发酵实验
1)种子液制备将重组菌从YEPD 抗性平板上刮取一单菌落至YEPD 液体培养基(50 mL三角瓶,装液量为10 mL)中,添加G418至终质量浓度200 μg/mL,30 ℃、150 r/min 培养24 h,即为种子液,转接发酵液时接种量为10%。
2)培养基对转化子生长的影响接种转化子S.cerevisiaeW303-1A/ pYX212-kanMX-d ̄l ̄d ̄h ̄b ̄1 ̄1 ̄8 ̄6(WB1186)和S.cerevisiaeW303-1A/pYX212-kanMX-dldhe1510(WE1510)分别于发酵培养基1、2、3和YEPD中,30 ℃、150 r/min 培养48 h,每隔6 h取样,于分光光度计600 nm处测定其生长情况,W303-1A作为空白对照。
3)糖浓度对转化子生长的影响采用YEPD培养基,以葡萄糖作为碳源,接种转化子WB1186与WE1510于初始糖质量浓度为20、60、100、140、180和200 g/L的培养基,30 ℃、150 r/min 培养48 h,每隔6 h取样,于分光光度计600 nm处测定其生长情况。
4)pH对转化子生长的影响采用初始糖质量浓度20 g/L的YEPD培养基,用乳酸调节培养基pH分别为3、4、5、6和7,接种转化子WB1186与WE1510,30 ℃、150 r/min 培养48 h,每隔6 h取样,于分光光度计600 nm处测定其生长情况。
5)转化子乳酸耐受性YEPD培养基,20 g/L初始糖,初始pH为5,接种转化子WB1186于分别添加乳酸5、10、15、20和25 g/L的培养基,30 ℃、150 r/min 培养48 h,每隔6 h取样,于分光光度计600 nm处测定其生长情况。
1.2.8重组菌3 L罐发酵实验
1)种子液制备将重组菌WB1186从YEPD 抗性平板上刮取一单菌落至YEPD液体培养基(250 mL 三角瓶,装液量为50 mL) 中,添加G418至终质量浓度200 μg/mL,30 ℃、150 r/min 培养24 h,即为种子液,转接发酵液时接种量为10%。
2)3 L发酵罐初步发酵试验发酵采用YEPD培养基,装液量2 L,控制发酵温度30 ℃,pH控制在5(100%氨水调节),溶氧(DO)维持在30%左右,转速150 r/min;当菌体达到一定OD不再生长后,其他条件不变,停止通气,转为厌氧发酵,厌氧发酵时间72 h;整个过程中葡萄糖为碳源,发酵液糖浓度控制在2%以下。每隔一定时间取样,OD600测定生长情况,测定残糖,计算耗糖速率;发酵液经处理后,4 ℃放置2 h以上,HPLC法测定乳酸含量。
3)3 L发酵罐延长厌氧发酵试验同以上条件,延长厌氧发酵时间至140 h,并用HPLC法测定酒精含量。
2结果与讨论
2.1 产乳酸酿酒酵母菌株构建
2.1.1D-乳酸脱氢酶基因的获得
通过游离表达将乳酸脱氢酶DLDH基因引入酿酒酵母S.cerevisiaeW303-1A,使其可以再生NADH,酵母体内代谢碳流一部分转向乳酸生成途径,使胞内丙酮酸直接还原为乳酸,导致乙醇和乳酸同时积累。分别以E.coli和L.mesenteroides的乳酸脱氢酶基因为模板,PCR扩增获得乳酸脱氢酶基因dldhe1510和dldhb1186。
扩增的琼脂糖电泳图谱如图1所示。由图1可知:2种来源的基因经PCR扩增后,在约1 000bp处均有单一的扩增片段,与目的基因片段大小(996bp)基本一致,经测序验证,2条基因片段为乳酸脱氢酶基因dldhe1510和dldhb1186。
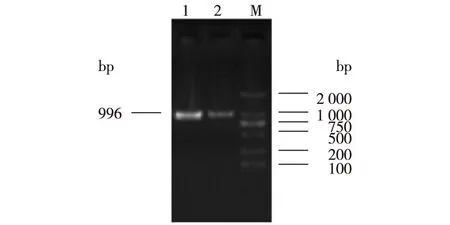
M—DL2000 marker;1—dldhb1186;2—dldhe1510 图1 DLDH基因电泳图 Fig.1 The product of PCR amplification
2.1.2乳酸脱氢酶基因表达质粒的构建
选择阳性克隆子提取质粒,对pYX212-kanMX-dldhb1186 进行BamHⅠ、SalⅠ双酶切,对pYX212-kanMX-dldhe1510进行EcoRⅠ、BamHⅠ双酶切,结果如图2所示。图2结果显示重组质粒构建成功。
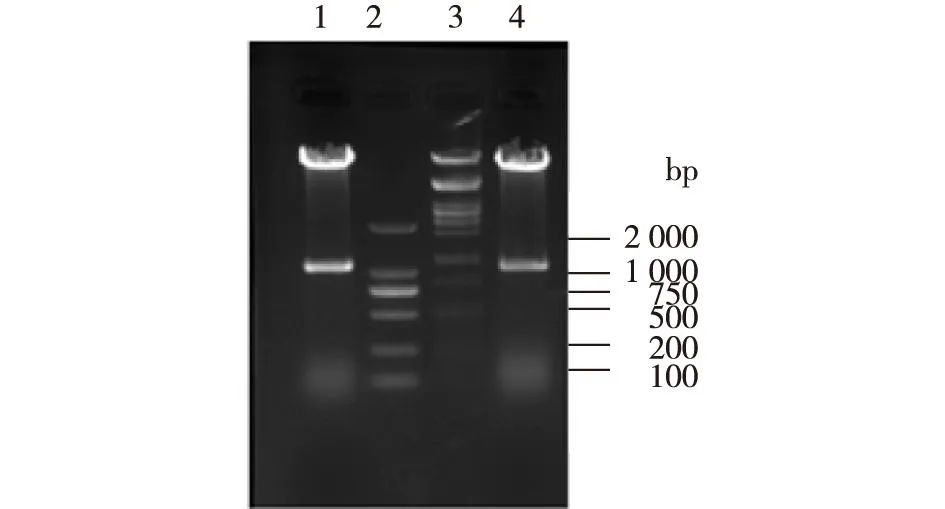
1—BamHⅠ和 SalⅠ双酶切质粒 pYX 212-kanMX-dldhb1186结果; 2—DL2000 marker;3—标准DNA;4—EcoRⅠ和 BamHⅠ双酶切质粒 pYX 212-kanMX-dldhe1510 的结果 图2 重组质粒双酶切电泳 Fig.2 Restriction analysis of the recombinant plasmid
2.1.3电转化及验证
通过电转化构建的质粒pYX212-kanMX-dldhb1186与pYX212-kanMX-dldhe1510到S. cerevisiaeW303-1A,转化后的酵母涂布在含200μg/mLG418 抗生素的YEPD平板上,挑选转化子进行菌落PCR扩增,电泳验证,结果如图3所示。由图3可知,2株重组菌均得到大小1 000bp左右片段,而原始菌S. cerevisiaeW303-1A没有,证明已成功转入重组质粒。

M—DL2000 marker;1—W303-1A;2—WB1186;3—WE1510 图3 菌落PCR验证 Fig.3 The product of colony PCR amplification
2.2 产乳酸酵母发酵性能的研究
为对比不同D-乳酸脱氢酶来源的产乳酸酵母WE1510和WB1186的产乳酸能力,利用摇瓶发酵进行初步探究。因为D-乳酸是在厌氧的情况下积累,此时菌体已经基本停止生长,故在转厌氧前积累较高的OD,有利于乳酸的积累,以下为在摇瓶发酵条件下确定转化子的最优生长条件。
2.2.1转化子在不同培养基中的生长情况
比较重组菌在多种培养基中的生长情况,结果如图4所示。由图4可知,2株重组菌在YEPD培养基中生长情况最好,培养约50h时,OD值分别达到13.3和13.7,所以选择YEPD作为下一步研究所用培养基。

图4 转化子在不同培养基中的生长情况 Fig.4 Growth of transformants in different culture medium
2.2.2转化子在不同糖浓度下的生长情况
在YEPD培养基的基础上,比较重组菌在不同糖浓度下的生长情况,结果如图5所示。由图5可知,重组菌在20g/L糖培养基中的生长情况优于其他糖浓度的,WB1186的最高OD600高于WE1510的。

图5 转化子在不同糖浓度下生长情况 Fig.5 Growth of transformants in different sugar concentration
2.2.3转化子在不同pH下的生长情况
在含糖质量浓度20g/L的YEPD培养基中,比较重组菌在不同pH条件下的生长情况,结果如图6所示。由图6可知,在pH为5的培养基中,OD值能达到最高值,WB1186的最高OD600高于WE1510的。
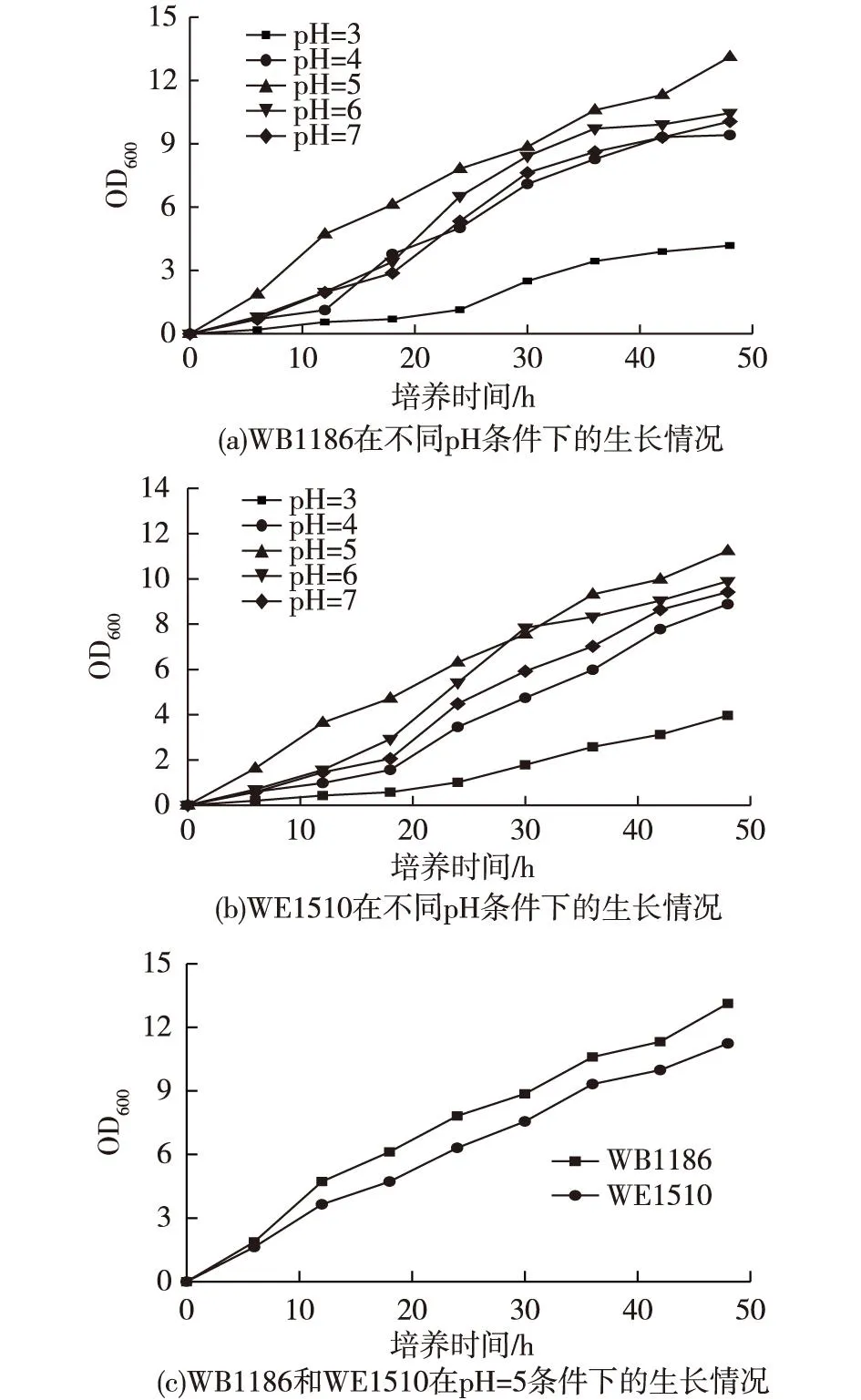
图6 不同pH下转化子生长情况 Fig.6 Growth of transformants in different pH
2.2.4转化子摇瓶发酵验证
对转化子进行初步发酵性能测试,YEPD培养基,20g/L糖,pH5,30 ℃、150r/min培养24h,接种量为10%,之后保鲜膜封口转至培养箱厌氧发酵。测定WB1186与WE1510产乳酸情况,结果如图7所示。由图7可知,WB1186具有更好的产乳酸能力,所以选择WB1186作为下一步上罐发酵的研究菌株。

图7 转化子摇瓶发酵验证 Fig.7 Fermentation test of transformants in the flask
2.2.5重组菌3L罐发酵实验
上罐培养基YEPD,溶氧(DO)30%,接种量10%, 150r/min,初始糖质量浓度10g/L,控制pH5,通气量3L/min,OD最大值时转为厌氧发酵,2个阶段总发酵时间96h。定时取样测定菌体OD值、乳酸浓度、耗糖速率,结果见图8。由图8可知,最终乳酸积累量达到18.0g/L。
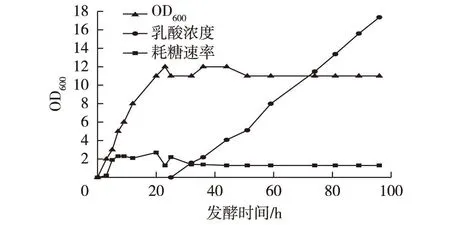
图8 重组菌3 L罐发酵实验 Fig.8 Recombinant strains fermentation in a 3-L fermentation tank
2.2.6重组菌3L罐延长发酵时间发酵实验
上罐培养基YEPD,溶氧(DO)30%,接种量10%,150r/min,初始糖质量浓度10g/L,控制pH5,通气量3L/min,OD最大值时转为厌氧发酵。延长发酵时间至140h,定时取样测定菌体OD600值、乳酸浓度、耗糖速率,D-乳酸积累量,结果如图9所示。由图9可知,乳酸最终积累量14.0g/L。由此可知,单纯延长发酵时间并不会使乳酸有效积累。

图9 重组菌3 L罐延长发酵时间发酵实验 Fig.9 Recombinant strains fermentation in a 3-L fermenter with longer time
3结论
成功地将L. mesenteroides和E. coli来源的D-乳酸脱氢酶基因在酿酒酵母中进行表达,构建了2株重组菌S. cerevisiaeWE1510和S. cerevisiaeWB1186。在摇瓶发酵试验条件下,重组菌S. cerevisiaeWB1186在YEPD培养基、20g/L糖和pH5的条件下生长条件最好,并具有更好的产乳酸能力。选取S. cerevisiaeWB1186进行下一步3L发酵罐发酵验证。YEPD培养基、接种量10%、溶氧30%、150r/min、初始葡萄糖质量浓度10g/L,控制pH5,通气量3L/min,OD600最大值时转为厌氧发酵,在此分批发酵条件下,乳酸最终积累量达到18.0g/L。
参考文献:
[1]王宏伟,郭绍华,冯靓.L-乳酸发酵的研究进展.辽宁农业科学,2004(4):28-30.
[2]崔小明.乳酸的生产应用及市场前景.四川化工与腐蚀控制,2002,5(2):37-44.
[3]胡永红,管珺,杨文革,等.发酵法生产D-乳酸的研究进展.食品与发酵工业,2007,33(12):99-106.
[4]王正岩,郝章来.聚乳酸的生产和应用及市场前景.化工新型材料,2003,37(1):40-44.
[5]季平,徐银宝,江志荣.聚乳酸的性能及开发现状.合成技术及应用,2003,18(1):31-37.
[6]HirayamaS,UedaR.ProductionofopticallypureD-lacticacidbyNannochlorumsp.26A4.ApplBiochemBiotechnol,2004,119(1):71-77.
[7]VijayakumarJ,AravindanR,ViruthagiriT.Recenttrendsintheproduction,purificationandapplicationoflacticacid.ChemBiochemEngQuart,2008,22(2):245-264.
[8]YanezR.,MoldesAB,AlonsoJL,etal.ProductionofD-lacticacidfromcellulosebysimultaneoussaccharificationandfermentationusingLactobacillus coryniformissubsp.torquens.BiotechnolLett,2003,25(14):1161-1164.
[9]FukushimaK,SogoK,MiuraS,etal.ProductionofD-lacticacidbybacterialfermentationofricestarch.MacromolBiosci,2004,4(11):1021-1027.
[10]CgangDE,JungHC,RheeJS,etal.Homofermentativeproductionofd-orl-lactateinmetabolicallyengineeredEscherichia coliRR1.ApplEnvironMicrobiol,1999,65(4):1384-1389.
[11]ZhouS,CauseyT,HasonaA,etal.ProductionofopticallypureD-lacticacidinmineralsaltsmediumbymetabolicallyengineeredEscherichia coliW3110.ApplEnvironMicrobiol,2003,69(1):399-407.
[12]IshidaN,SaitohS,TokuhiroK,etal.EfficientproductionofL-lacticacidbymetabolicallyengineeredSaccharomyces cerevisiaewithagenome-integratedL-lactatedehydrogenasegene.ApplEnvironMicrobiol,2005,71(4):1964-1970.
[13]HofvendahlK,Hahn-HägerdalB.Factorsaffectingthefermentativelacticacidproductionfromrenewableresources.EnzymeMicrobTechnol,2000,26(2/3/4):87-107.
[14]AdachiE,TorigoeM,SugiyamaM,etal.ModificationofmetabolicpathwaysofSaccharomyces cerevisiaebytheexpressionoflactatedehydrogenaseanddeletionofpyruvatedecarboxylasegenesforthelacticacidfermentationatlowpHvalue.JFermentBioeng,1998,86(3):284-289.
[15]周丽.高产高纯D-乳酸的E. coli代谢工程菌的构建.无锡:江南大学,2012:13-15.
[16]IshidaN,SuzukiT,TokuhiroK,etal.d-LacticacidproductionbymetabolicallyengineeredSaccharomyces cerevisiae.JBiosciBioeng,2006,101(2):172-177.
[17]HauseB,RajgarhiaV,SuominenP.MethodsandmaterialsfortheproductionofL-lacticacidinyeast:US,7534597.2009-05-19.
[18]邢建宇,杨莉.培养基中各营养组分对酿酒酵母发酵的影响.食品研究与开发,2011,32(2):139-142.
[19]王颖,何宁,李清彪,等.酿酒酵母 S.cerevisiae 高密度培养条件优化研究.工业微生物,2007,37(1):34-38.
[20]萨姆布鲁克J,拉塞尔DW.分子克隆实验指南.黄培堂,译.3版.北京:科学出版社,2002.
(责任编辑荀志金)
