刺参温度相关基因在模拟不同海域冬春季水温条件下的表达研究
2016-01-13白雪秋,丁君,曹学顺等
刺参温度相关基因在模拟不同海域冬春季水温条件下的表达研究
白雪秋,丁君,曹学顺,李成泽,常亚青
(大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
摘要:为探讨不同海域冬春季水温对刺参温度相关基因的表达影响,在实验室内模拟了俄罗斯沿海地区、大连沿海地区、福建沿海地区12月至翌年4月刺参Apostichopus japonicus生长的海水温度,并从已构建的刺参耐寒基因筛选cDNA文库和刺参高温胁迫正反消减cDNA文库中选取了7个差异基因:hsp70、gp96、UQCRFS1、ferritin、lysozyme、mtLSU、proeintl(2)efl,利用实时荧光定量PCR方法研究了这7个基因在3种海域冬春季模拟水温条件下的表达情况。结果表明:3个水温组刺参同一组织中hsp70基因的表达量变化不明显,但在不同组织中的表达量存在差异;模拟福建沿海地区冬春季水温组刺参各组织中gp96基因的表达量整体上均高于其他两个水温组,并且在模拟福建沿海地区冬春季水温组刺参呼吸树中的表达量显著高于该组肠和体壁(P<0.05);模拟俄罗斯沿海地区冬春季水温组刺参各组织中UQCRFS1基因的表达量均高于其他两个水温组;3个水温组刺参各组织中ferritin基因的表达模式及表达量均不相同;3个水温组刺参各组织中lysozyme和proeintl(2)efl两个基因的表达量均在呼吸树中达到最高,且显著高于肠和体壁(P<0.05);3个水温组刺参各组织中mtLSU基因的表达模式基本相同,其表达量均表现为体壁显著高于肠和呼吸树(P<0.05)。
关键词:刺参;温度;实时荧光定量PCR;功能基因;差异表达
DOI:10.3969/J.ISSN.2095-1388.2015.01.004
文章编号:2095-1388(2015)01-0018-07
中图分类号:S917.1
文献标志码:A
收稿日期:2014-05-17
基金项目:辽宁省教育厅优秀人才支持计划项目(LTQ2011073); 辽宁省重大科技攻关项目(2011203003); 国家海洋公益性行业科研专项(201105016-3)
作者简介:白雪秋(1988—), 女, 硕士研究生。E-mail:baixue135qiu@sina.cn
Abstract:The genes related to temperature including hsp70, gp96, UQCRFS1, ferritin, lysozyme, mtLSU, and proeintl(2)efl selected from the subtracted cDNA library were expressed in body wall, intestine and respiratory tree of sea cucumber Apostichopus japonicas using quantitative Real-time PCR under the simulated sea water temperature in Russian coastal area, Dalian coastal area, and Fujian coastal area from December to April in a laboratory. The expression of hsp70 gene was found to be not significant difference in the same tissue in the three temperature groups, but there was significant differences in different tissues at the same conditions. There was higher expression of gp96 gene in the simulation of Fujian coastal area in winter and spring group than in the other two groups, significantly higher relative expression levels in respiratory tree than in intestine and the body wall in the simulation of Fujian coastal area in winter and spring group (P<0.05). The expression of UQCRFS1 gene was higher in the simulation of Russian coastal area in winter and spring groups than in the other two groups. No same ferritin gene expression patterns and relative expression levels was observed in the three temperature groups. The maximal relative expression levels of both lysozyme and proeintl (2)efl genes were found in the respiratory tree, significantly higher than in the intestine and body wall in the three groups (P<0.05). There were essentially the same mtLSU gene expression patterns in the three groups, significantly higher relative expression levels in the body wall than that in the intestine and respiratory tree (P<0.05).
刺参Apostichopusjaponicus(Selenka)是亚洲海岸广泛分布的浅海底栖物种,栖息于潮间带至水深20~30 m的浅海,主要分布于35°N到44°N的西北太平洋沿岸,自然分布区北起俄罗斯远东地区,经朝鲜、韩国、日本,南至中国北部[1-2]。刺参可以在0~30 ℃的水温范围内生存,但刺参的生长水温为12~21 ℃,幼参生长的最适水温为15~18 ℃,水温是影响刺参生长和生理活动的重要因子之一,水温大于24 ℃时刺参开始进入夏眠阶段[3]。
刺参是一种高蛋白、低脂肪的经济物种,其巨大的经济价值推进了该物种养殖业的快速发展以及养殖地域由北方向南方的拓展。福建省沿海地区利用冬春季水温(10~20 ℃)适合刺参生长的优势,从辽宁等地引进刺参开始了中国南方的刺参养殖。2011年福建地区刺参的总产量达到8532 t,为中国南方刺参养殖的主要地区。2011年辽宁地区刺参总产量为5.49万t,占中国刺参总产量的39.89%[4],为刺参产量的主要产区,并且中国众多海参中以分布在北方沿海(主要为辽东半岛)的刺参营养价值最高且药用价值最广泛。俄罗斯远东海域为刺参养殖的最北部,所产刺参的肉刺多为6排、体壁厚度大且营养价值高[1]。目前,有关刺参养殖环境方面的研究主要集中在一个地区的温度、溶氧、盐度、pH等环境因子对刺参的影响,或者是高低温以及盐度胁迫对刺参功能基因的影响[5-9]。于姗姗等[7]研究了夏季暴雨引起养殖池塘盐度变化对仿刺参的影响,在实验室内模拟野外盐度变化,研究了hsp70、hsp90a和hsp90b基因的表达。李成泽等[8]研究了在温度胁迫下刺参组织中MYP1和MYP2基因的表达情况。杨爱馥等[9]研究了幼参注射LPS前后其4种组织中ferritin基因的表达量。但尚未见不同地区水温对刺参功能基因影响方面的报道,本研究中,借助已构建的刺参耐寒基因筛选cDNA文库和刺参高温胁迫正反消减cDNA文库中的7个差异基因:热休克蛋白70基因(hsp70)、热休克蛋白gp96基因(gp96)、cytochrome b-c1 complex subunit rieske基因(UQCRFS1)、铁蛋白基因(ferritin)、溶菌酶基因(lysozyme)、线粒体核糖体大亚基RNA 基因(mitochondrial large subunit ribosomal RNA,mtLSU)、致死必需蛋白基因(protein lethal(2)essential for life,proeintl(2)efl),利用实时荧光定量PCR方法研究了模拟3种海域冬春季水温条件下这7个基因在刺参各组织中表达水平的变化,以期为刺参南移养殖提供新的资料。
通信作者: 丁君(1973—), 女, 研究员。E-mail:dingjun1119@dlou.edu.cn
1材料与方法
1.1 材料
试验用刺参为农业部北方海水增养殖重点实验室培育的1龄刺参。从中随机选取120头个体活泼、大小相近的刺参,体长为(78.4±2.1)mm,体宽为(19.1±0.5)mm,湿体质量为(18.8±1.1)g。
1.2 方法
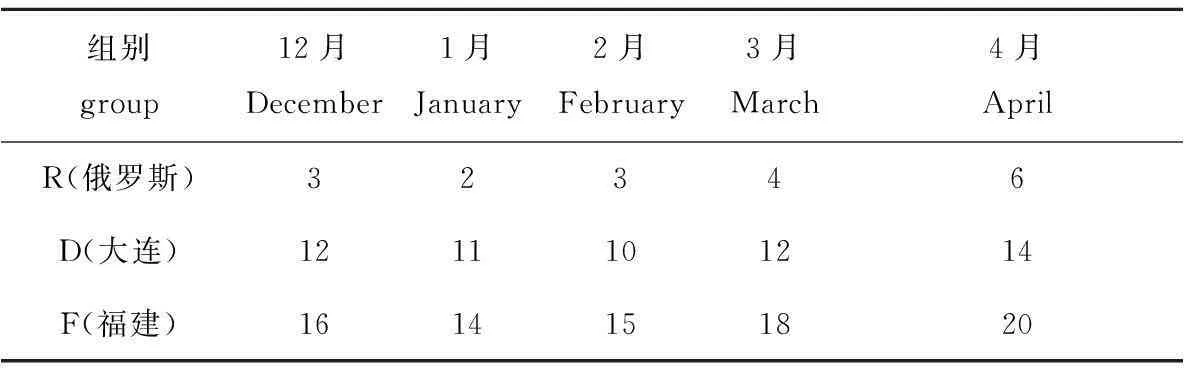
1.2.1试验设计将120头刺参分成3组,每组40头,暂养于实验室控温水槽中。3个水温组分别模拟俄罗斯沿海地区、大连沿海地区、福建沿海地区2012年12月至翌年4月刺参生长环境温度(表1),其中R组为模拟俄罗斯沿海地区冬春季水温组(简称为俄罗斯水温组),D组为模拟大连沿海地区冬春季水温组(简称为大连水温组),F组为模拟福建沿海地区冬春季水温组(简称为福建水温组)。3个水温组的养殖条件除温度不同外其他条件均相同。
试验从2012年11月29日开始,将3组刺参放入3个水温组的水槽中,按照表1中各海域每月的海水温度严格控制水温,经过151 d的养殖,至2013年4月30日试验结束时,从每组取3头刺参,将刺参解剖后分别取适量体壁、肠、呼吸树组织于1.5 mL RNase free离心管中,冻存于冰箱(-80 ℃)中保存备用。
1.2.2总RNA的提取取冻存的组织10~20 mg,用RNA试剂盒(天根生化科技有限公司)提取总RNA,用10 g/L的琼脂糖凝胶电泳检测RNA的完整性,用NV3000 Sepctrophotometer检测RNA的纯度及浓度,将完整性、浓度与纯度符合试验要求的RNA溶液冻存于冰箱(-80 ℃)中保存备用。
表13个沿海地域冬春季的海水温度
Tab.1Sea water temperature at the three coastal areas in winter and spring
℃
1.2.3cDNA的制备用PrimeScriptTMRT Reagent Kit(TaKaRa公司)试剂盒进行反转录。反应体系(共20 μL):5 × PrimeScriptTMbuffer 4 μL, PrimeScriptTMRT enzyme Mix I 1 μL, Oligo dT Primer 1 μL, Random 6 mers 1 μL, Total RNA 500 ng, 用RNase Free ddH2O补足至20 μL。样品混匀后在PCR仪上进行反转录,反应条件为37 ℃下反应15 min, 85 ℃下反应5 s。
1.2.4引物设计及筛选使用Primer Premier 5.0软件对每个基因设计实时荧光定量PCR引物,并检测引物的特异性及扩增效率。引物序列信息见表2,引物由生工生物工程(上海)股份有限公司合成。
1.2.5Real-time PCR以反转录得到的cDNA为模板,使用SYBR©Premix Ex TaqTMII Kit (Tli RNaseH Plus, TaKaRa公司)试剂盒,在Applied Biosystems 7500 Real-time PCR System(Life Technologies, USA) 上进行荧光定量PCR。反应体系(共20 μL):2 × SYBR Premix ExTaqTMII (Tli RNaseH Plus)10 μL, ROX Reference Dye II 0.4 μL, cDNA模板1 μL,上、下游引物各0.4 μL, 用ddH2O补足至20 μL。反应程序:95 ℃下预变性30 s,95 ℃下变性5 s, 60 ℃下退火32 s,共进行40个循环;溶解曲线阶段95 ℃下变性30 s, 60 ℃下退火1 min, 95 ℃下延伸15 s。
1.3 数据处理
以cytb为内参基因,用2-△△Ct法进行实时定量PCR,所得结果用SPSS 19.0软件进行统计分析,在单因素ANOVA方差分析达到显著水平(P<0.05)时,采用Duncan法进行多重比较。试验数据均以平均值±标准误表示。
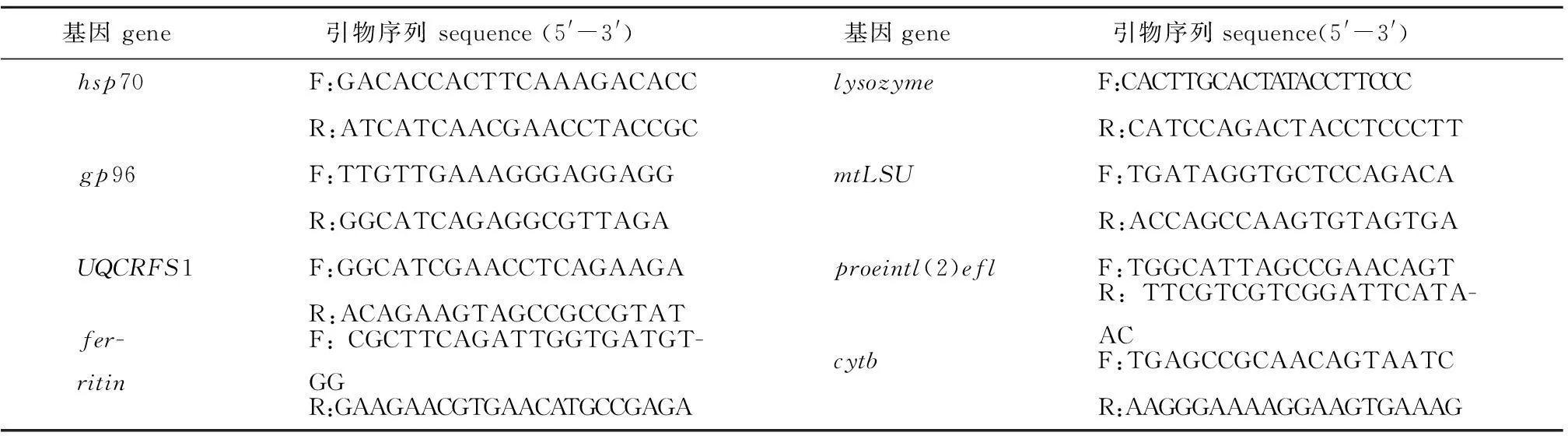
表2 实时定量PCR引物信息
2结果与分析
2.1 RNA的提取
将提取的RNA进行完整性检测,经10 g/L琼脂糖凝胶电泳进行检测分析,部分结果如图1所示。从图1可以看出,样品电泳后所得到的28 S、18 S条带清晰,且28 S条带的亮度明显高于18 S。说明提取的RNA完整性良好,符合后续试验要求。
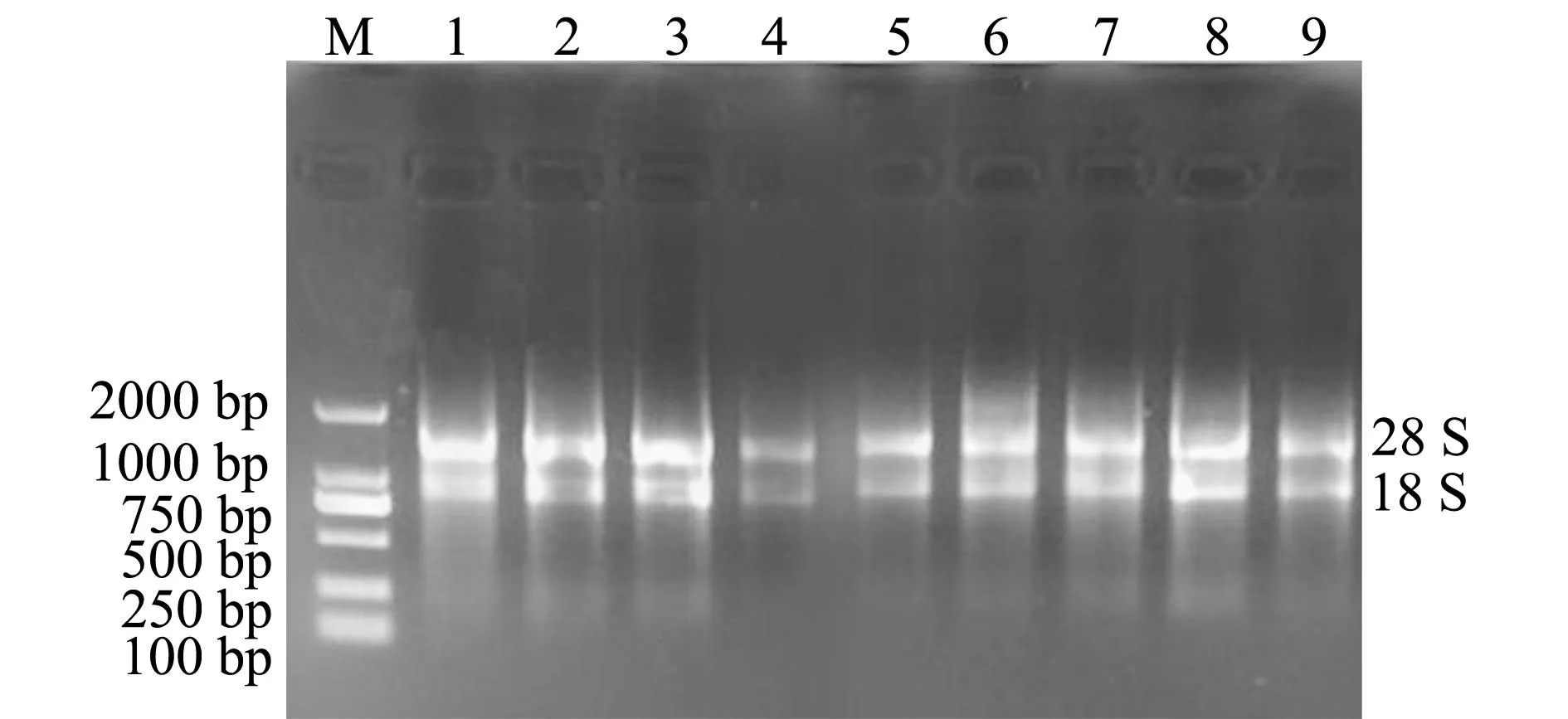
注:M为DL2000 Marker;1~3为肠组织样品;4~6为体壁组织样品;7~9为呼吸树组织样品 Note:M,DL2000 Marker; 1-3,RNA of sample in intestine; 4-6,RNA of sample in body wall; 7-9,RNA of sample in respiratory tree 图1 刺参部分组织RNA的琼脂糖电泳图 Fig.1 Agarose gel electrophoresis in several tissues of sea cucumber Apostichopus japonicus
2.2 引物筛选结果
cytb基因和7个刺参温度相关基因所得溶解曲线的熔点峰窄且尖,为单峰,说明其特异性好,所设计的引物可用于实时荧光定量PCR。
2.3 温度相关基因在刺参组织中的表达
使用实时荧光定量PCR检测3个水温组刺参肠、呼吸树、体壁组织中各基因的表达量,结果使用SPSS 19.0进行均一化处理,其中以大连水温组刺参肠组织中温度相关基因的表达量作基准为1,取平均值及标准误,使用OriginPro 8软件作柱状图进行分析。
2.3.1hsp70和gp96基因从图2可见:3个水温组刺参各组织中hsp70和gp96基因的表达量均在呼吸树中达到最高;同一水温组刺参各组织中hsp70基因的表达量有差异且部分显著(P<0.05),不同水温组刺参同一组织中hsp70基因的表达量无显著性差异(P>0.05);福建水温组刺参呼吸树中gp96基因的表达量显著高于该组的肠和体壁(P<0.05),也显著高于其他两个水温组刺参呼吸树中的表达量(P<0.05),俄罗斯和大连两个水温组刺参各组织中的表达量均无显著性差异(P>0.05),福建水温组刺参各组织中gp96基因的表达量整体上均高于其他两个水温组。
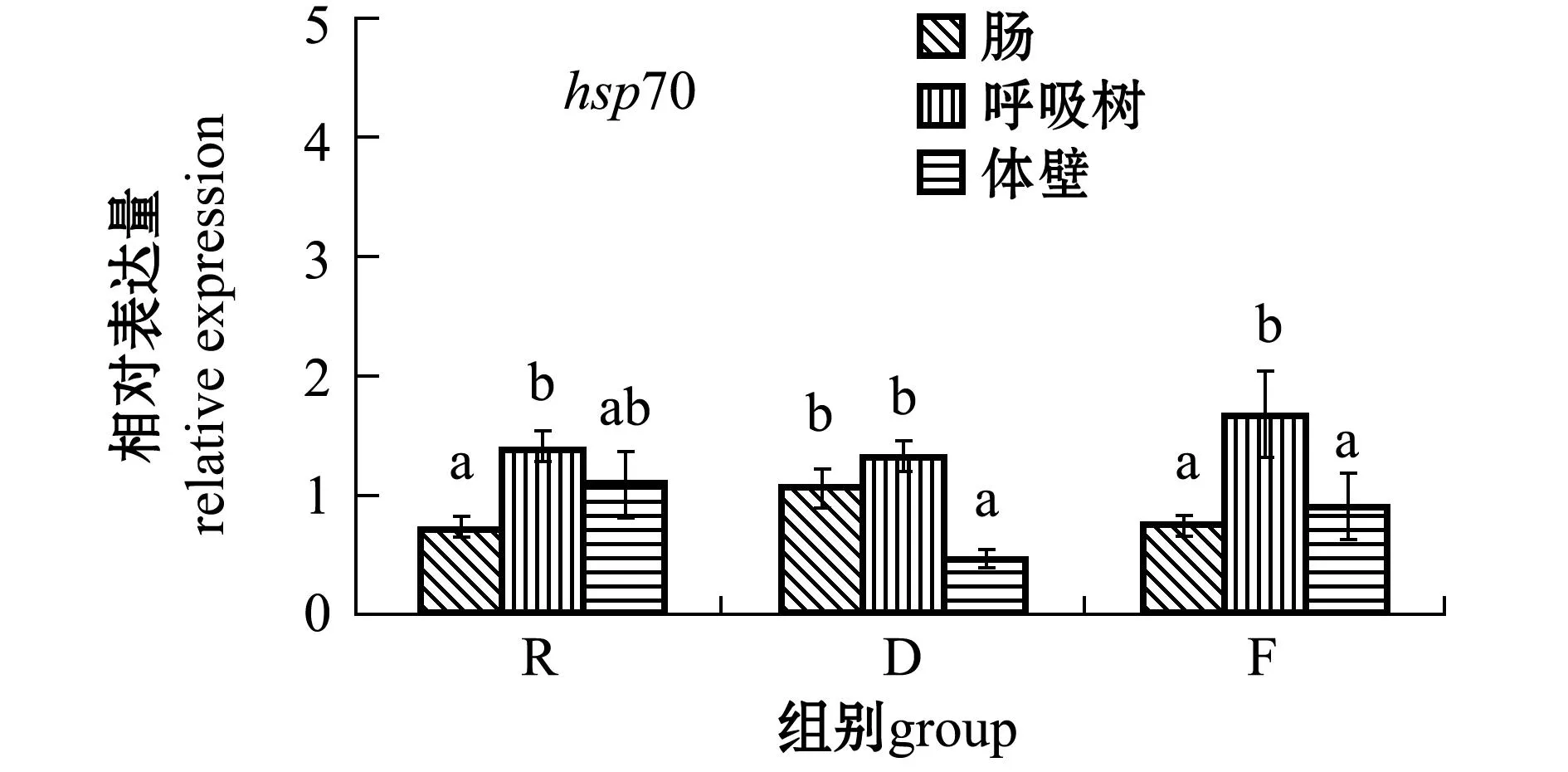
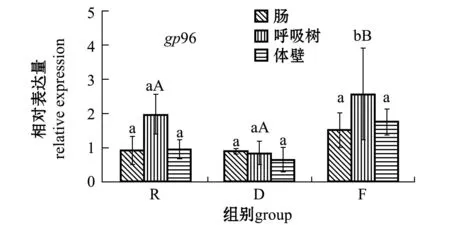
注:标有不同大写字母者表示不同水温组相同组织间有显著性差异(P<0.05),标有不同小写字母者表示同一水温组不同组织间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同 Note:The means with different capital letters in the same tissues within different temperature groups are significantly different at the 0.05 probability level, with different letters in the different tissues within the group being significantly different at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia 图2 hsp70和gp96基因在刺参不同组织中的表达 Fig.2 Relative expression of hsp70 and gp96 genes in different tissues of sea cucumber Apostichopus japonicus
2.3.2UQCRFS1基因从图3可见:3个水温组刺参各组织中UQCRFS1基因的表达量均呈现出呼吸树中最高,且显著高于肠和体壁(P<0.05);俄罗斯水温组呼吸树中的表达量(25.72)约为肠中表达量(9.92)的3倍、体壁中表达量(4.33)的6倍,且俄罗斯水温组刺参各组织中的表达量均高于其余两个水温组;3个水温组肠组织间的表达量有显著性差异(P<0.05),俄罗斯水温组刺参呼吸树中的表达量显著高于其他两个水温组(P<0.05),俄罗斯水温组刺参体壁中的表达量显著高于大连水温组(P<0.05)。
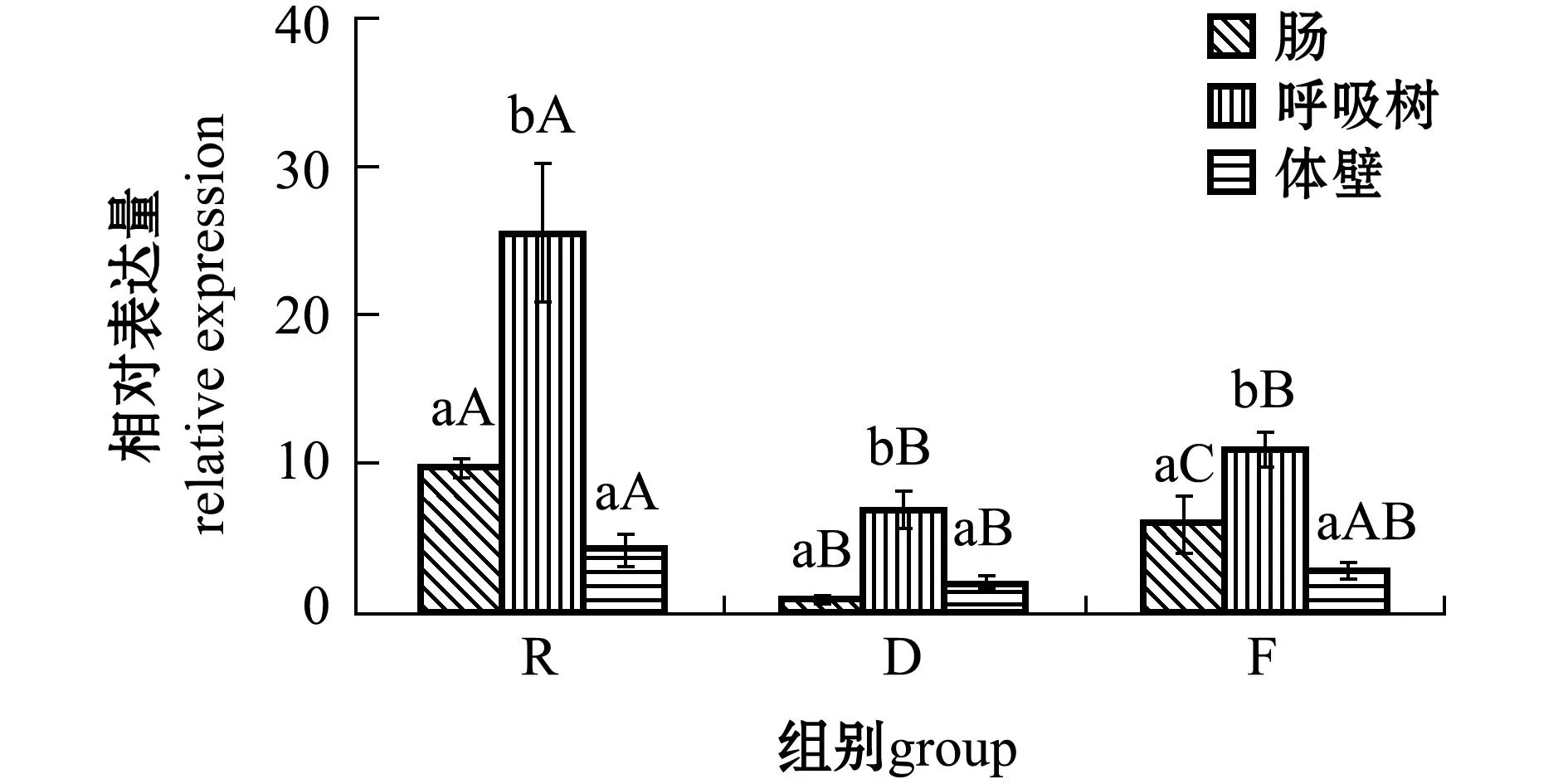
图3 UQCRFS1基因在刺参不同组织中的表达 Fig.3 Relative expression of UQCRFS1 gene in different tissues of sea cucumber Apostichopus japonicus
2.3.3ferritin基因从图4可见:俄罗斯水温组刺参各组织中ferritin基因的表达量均有显著性差异(P<0.05),而大连水温组刺参各组织间的表达量无显著性差异(P>0.05);3个水温组中,俄罗斯水温组刺参体壁中的表达量显著高于其他两个水温组(P<0.05),福建水温组刺参肠中的表达量显著高于俄罗斯水温组(P<0.05),福建水温组刺参呼吸树中的表达量显著高于大连水温组(P<0.05)。
2.3.4lysozyme基因从图5可见:3个水温组刺参各组织中lysozyme基因的表达量均呈现出呼吸树中最高,且显著高于肠和体壁(P<0.05);福建水温组刺参各组织中的表达量均高于大连水温组;随着整体水温的升高,刺参肠中的表达量逐渐增加;俄罗斯水温组刺参呼吸树中的表达量显著高于其他两个水温组(P<0.05)。

图4 ferritin基因在刺参不同组织中的表达 Fig.4 Relative expression of ferritin gene in different tissues of sea cucumber Apostichopus japonicus
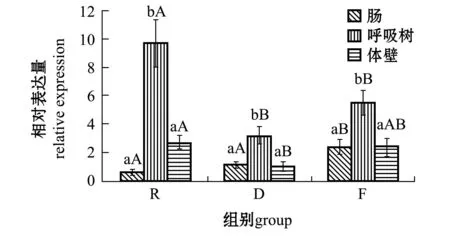
图5 lysozeme基因在刺参不同组织中的表达 Fig.5 Relative expression of lysozeme gene in different tissues of sea cucumber Apostichopus japonicus
2.3.5mtLSU基因从图6可见:3个水温组刺参各组织中mtLSU基因的表达量均呈现出体壁中最高,且显著高于肠和呼吸树(P<0.05),而肠与呼吸树中的表达量则无显著性差异(P>0.05);3个水温组中,俄罗斯水温组和福建水温组刺参体壁中的表达量比大连水温组刺参体壁中略高(P>0.05)。

图6 mtLSU基因在刺参不同组织中的表达 Fig.6 Relative expression of mtLS gene in different tissues of sea cucumber Apostichopus japonicus
2.3.6proeintl(2)efl基因从图7可见:俄罗斯和福建水温组刺参各组织中proeintl(2)efl基因的表达量均呈现出呼吸树中最高,且显著高于肠和体壁(P<0.05),而大连水温组刺参也呈现出呼吸树中最高,但仅显著高于体壁(P<0.05);3个水温组中,俄罗斯水温组刺参体壁中的表达量显著高于其他两个水温组(P<0.05)。
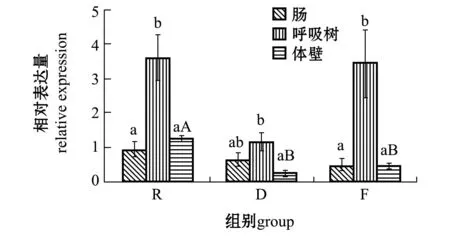
图7 proeintl(2)efl基因在刺参不同组织中的表达 Fig.7 Relative expression of proeintl(2)efl gene in different tissues of sea cucumber Apostichopus japonicus
3讨论
3.1 水温对 hsp70、 gp96和 proeintl(2) efl基因表达的影响
热休克蛋白HSP70和GP96作为分子伴侣参与免疫相关活动。相关研究表明,当生物体处于环境胁迫状态时,机体通过提高HSPs的表达量来增强机体的应激耐受性,以减少机体在应激过程中所受的伤害。hsp70基因的表达量与温度刺激时间长短有关,不同温度刺激前后刺参组织样品中hsp70的表达量变化差异很明显[10-12]。Dong等[10]证明了刺参hsp70的表达量受高温胁迫的影响。吉成龙等[13]报道,高温(28 ℃)诱导刺参使其体壁中hsp70 的表达量增加。Ji等[5]证实了当环境温度保持在26 ℃时,hsp70的表达水平为先增加后降低。本研究中每个月的温度控制是恒定的,结果显示,hsp70在不同水温组刺参同一组织中的表达量无显著性差异(P>0.05),由此可推测,恒定温度的累积作用对hsp70在刺参组织中表达的影响不明显,但在同一水温组刺参各组织中的表达量有差异且部分显著(P<0.05),说明hsp70基因在刺参中具有明显的组织差异性。
GP96参与细胞的热耐受过程,对细胞的生长、发育具有一定的调节作用[14]。本研究中,gp96基因在3个水温组刺参组织中的表达量均为呼吸树中最高,并且福建水温组刺参各组织中的表达量整体上均高于其他两组。推测gp96在相对较高的水温条件下更容易参与免疫调节过程,且在刺参呼吸树中最为明显。
致死必需蛋白的氨基酸序列与已知果蝇的小热休克蛋白高度相似。在果蝇胚胎发育与幼体阶段,proeintl(2)efl基因一直都有表达,这与小热休克蛋白的功能很相似[15]。孙国华等[6]发现,高温刺激刺参后该基因的表达量增加,并推测该基因属于刺参小热休克蛋白。但与同为热休克蛋白家族的hsp70和gp96两个基因相比,其表达趋势既有相同之处又有其自身特性。本研究中,在3个水温组中,gp96基因在呼吸树中的表达量均显著高于肠和体壁(P<0.05),存在组织差异性。但在不同水温组刺参肠和呼吸树中的表达量变化不明显,而在体壁中的表达量变化显著(P<0.05),这可能与体壁最先接触到环境温度有关。
3.2 水温对 UQCRFS1基因表达的影响
UQCRFS1蛋白是线粒体呼吸链复合体Ⅲ中的一个亚单位,对线粒体呼吸链的电子传递起着重要作用。呼吸链是需氧生物获取和储存能量的关键,呼吸链位于线粒体内膜,而线粒体一般分布在细胞功能旺盛的区域,以及心肌细胞、肾脏细胞等大量耗能细胞中[16]。张婷等[17]发现,UQCRFS1基因在大鼠的心脏组织中表达量较高,在脑和肺组织中表达量稍低。本试验中亦发现,在俄罗斯水温组刺参各组织中UQCRFS1基因的表达量均高于其他两个水温组,且在3个水温组刺参呼吸树中的表达量显著高于肠和体壁 (P<0.05),推测在相对较低的水温条件下刺参呼吸树中的能量消耗相对较大。
3.3 水温对 ferritin基因表达的影响
Ferritin具有调节代谢平衡、抗氧化等功能。Ferritin是主要的贮铁库,而铁属于微量元素,与动物的携氧、产能等过程密切相关。从本试验结果中可知,ferritin基因在刺参肠、呼吸树、体壁组织中均有表达。在其他水生动物中,ferritin基因在不同组织中也均有表达,如在凡纳滨对虾Litopenaeusvannamei的肌肉、鳃、眼柄和心脏中ferritin基因均有表达,且在血淋巴中表达量最高[18];在合浦珠母贝Pinctadafucata的外套膜、鳃、消化道和肌肉中ferritin基因都有表达,并且ferritin基因在外套膜、消化腺和肌肉中的表达较高[19]。本研究中,俄罗斯水温组刺参各组织中ferritin的表达量差异显著,且在体壁中的表达量最高。有研究表明,养殖环境的不同对铁蛋白基因在刺参某些组织中的表达水平有影响,但在南方和北方养殖仿刺参呼吸树中铁蛋白基因的表达水平没有明显差异[20]。而福建水温组刺参呼吸树中ferritin的表达量却显著高于大连水温组(P<0.05),这可能与3个水温组的养殖环境只有温度不同有关,ferritin的表达模式可能受多种环境因素互相作用的影响。Giorgi等[21]在南极硬骨鱼冷训化过程中发现,ferritin在低温条件下最容易发挥作用。Yamashita等[22]发现,在虹鳟中,ferritin在免疫代谢和耐寒训练中发挥着双重作用。本研究中,俄罗斯水温组刺参体壁中ferritin基因的表达量最高,与上述观点相符。
3.4 水温对 lysozyme基因表达的影响
溶菌酶作为机体先天免疫系统中一个重要的效应分子,参与多种免疫反应。水产动物中溶菌酶活性受温度的影响。许友卿等[23]指出,温度影响近江牡蛎i-型溶菌酶基因表达,从而调节其免疫功能。Pascoli等[24]在鲈Dicentrarchuslabrax中发现,在低温条件下溶菌酶的活性很低。Li等[25]在冷刺激条件下,地中海贻贝Mediterraneanmussel和紫贻贝Mytilusgalloprovincialis血细胞中lysozyme基因表达量整体下降。Yu[26]指出,温度变化会影响Mactraveneriformis的溶菌酶活性,且20 ℃时溶菌酶活性高于10 ℃。本研究中也发现,在福建水温组刺参肠组织中lysozyme基因的表达量显著高于其他两个水温组,福建水温组刺参各组织中的表达量均高于大连水温组,这可能是因为福建水温组的水温条件刺激机体的免疫防御系统,使机体释放更多的溶菌酶参与免疫调控。3个水温组刺参各组织中lysozyme基因在刺参呼吸树的表达量最高,并且俄罗斯水温组刺参呼吸树中的表达量显著高于其他两组,推测在俄罗斯水温组刺参呼吸树中lysozyme基因对温度的敏感程度相对较高。
3.5 水温对 mtLSU基因表达的影响
本研究中,3个水温组刺参体壁中mtLSU基因的表达量均最高,且显著高于呼吸树和肠中的表达量, 这与吉成龙等[13]的mtLSU基因在刺参体壁中的表达量高于纵肌、呼吸树和消化道的结论基本一致。mtLSU基因在呼吸树和肠中的表达量基本相等,这两个组织均在刺参体腔内,推测该基因可能与刺参机体的能量代谢机制有关。mtLSU基因是刺参中新发现的基因,对其表达机制的研究较少,尚需进一步的研究证实。
本研究中所选的差异基因均为相对短暂的高低温胁迫条件下刺参组织中表达差异的基因,而本试验中每个月温度控制是恒定的,故在本试验条件下刺参各组织中有些差异基因的表达量无显著性差异。这些基因的表达机制及其对刺参养殖和产量的影响还需进一步探索。本研究结果有助于今后结合每种基因的组织表达差异性及其功能进行针对性的研究,为提高刺参产量和扩大养殖地域可提供基础依据。
参考文献:
[1]常亚青,隋锡林,李俊.刺参增养殖业现状、存在问题与展望[J].水产科学,2006,25(4):198-201.
[2]常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004:67-76.
[3]Xie X,Zhao W,Yang M.Combined influence of water temperature,salinity and body size on energy budget in the sea cucumberApostichopusjaponicas(Selenka)[J].Fisheries Science,2013,79(4):639-646.
[4]农业部渔业局.中国渔业统计年鉴[M].北京:中国农业出版社,2012:34.
[5]Ji T T,Dong Y W,Dong S L.Growth and physiological responses in the sea cucumber,ApostichopusjaponicusSelenka:aestivation and temperature[J].Aquaculture,2008,283:180-187.
[6]孙国华,吉成龙,杨建敏,等.刺参(Apostichopusjaponicus)高温胁迫应答基因应激表达特性的分析[J].海洋与湖沼,2013,44(1):182-187.
[7]于姗姗,王青林,孟宪亮,等.盐度骤变对仿刺参hsp70及hsp90基因表达的影响[J].中国海洋大学学报:自然科学版,2012,42(9):22-27.
[8]李成泽,常亚青,丁君,等.刺参主要卵黄蛋白MYP1、MYP2 在不同幼体发育阶段、成体组织及温度胁迫条件下的相对定量表达[J].水产学报,2014,38(2):193-199.
[9]杨爱馥,周遵春,孙大鹏,等.仿刺参铁蛋白ferritin 基因的序列分析及表达[J].水产学报,2010,34(6):710-717.
[10]Dong Y,Dong S,Meng X.Effects of thermal and osmotic stress on growth,osmoregulation and Hsp70 in sea cucumber (ApostichopusjaponicusSelenka)[J].Aquaculture,2008,276(1):179-186.
[11]Wang F Y,Yang H S,Gao F,et al.Effect of acute temperature or salinity stress on the immune response in sea cucumber,Apostichopusjaponicas[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2008,151(4):491-498.
[12]李成泽,王晓燕,丁君,等.刺参耐寒基因筛选 cDNA 文库的构建与分析[J].大连海洋大学学报,2013,28(6):522-527.
[13]吉成龙,孙国华,杨建敏,等.刺参高温胁迫消减cDNA文库的构建与分析[J].海洋与湖沼,2011,42(1):60-66.
[14]陈伟才,贾晓娟,孟颂东,等.gp96蛋白的免疫学及其临床应用研究进展[J].生物工程学报,2011,27(5):704-711.
[15]Morrow G,Tanguay R M.Heat shock proteins and aging inDrosophilamelanogaster[J].Cell & Developmental Biology,2003,14(5):291-299.
[16]张飞,周强军,孙吉,等.线粒体呼吸链膜蛋白复合体的结构[J].生命科学,2008,20(4):566-578.
[17]张婷,黄青松,范雪晖.大鼠UQCRFS1基因的克隆及其表达模式分析[J].湖北农业科学,2013,52(9):2174-2177.
[18]Hsieh S L,Chiu Y C,Kuo C M.Molecular cloning and tissue distribution of ferritin in Pacific white shrimp(Litopenaeusvannamei)[J].Fish & Shellfish Immunol,2006,21(3):279-283.
[19]Zhang Y,Meng Q,Jiang T,et al.A novel ferritin subunit involved in shell formation from the pearl oyster(Pinctadafucata)[J].Comp Biochem Physiol Part B:Biochem Mol Biol,2003,135(1):43-54.
[20]李成华,崔静,李晔,等.南移养殖仿刺参(StichopusjaponicusSelenka)铁蛋白基因的克隆及表达特征分析[J].海洋与湖沼,2011,42(4):567-572.
[21]Giorgi A,Mignogna G,Bellapadrona G,et al.The unusual co-assembly of H-and M-chains in the ferritin molecule from the AntarcticteleostsTrematomusbernacchiiandTrematomusnewnesi[J].Archives of Biochemistry and Biophysics,2008,478(1):69-74.
[22]Yamashita M,Ojima N,Sakamoto T,et al.Molecular cloning and cold-inducible gene expression of ferritin H subunit isoforms in rainbow trout cells[J].The Journal of Biological Chemistry,1996,271:26908-26913.
[23]许友卿,吴卫君,丁兆坤,等.近江牡蛎i-型溶菌酶基因分析及温度对基因表达的影响[J].热带海洋学报,2012,31(6):69-75.
[24]Pascoli F,Lanzano G S,Negrato E,et al.Seasonal effect on hematological and innate immune parameters in sea bass(Dicentrarchuslabrax)[J].Fish & Shellfish Immunology,2011,31(6):1081-1087.
[25]Li H,Parisi M G,Toubiana M,et al.Lysozyme gene expression and hemocyte behaviour in the Mediterranean mussel,Mytilusgalloprovincialis,after injection of various bacteria or temperature stresses[J].Fish & Shellfish Immunology,2008,25:143-152.
[26]Yu J H,Song J H,Choi M C,et al.Effects of water temperature change on immune function in surf clams,Mactraveneriformis(Bivalvia:Mactridae)[J].Journal of Invertebrate Pathology,2009,102:30-35.
Expression of genes related to temperature in sea cucumber
Apostichopusjaponicasunder the stimulated winter
and spring temperature in different coasts
BAI Xue-qiu, DING Jun, CAO Xue-shun, LI Cheng-ze, CHANG Ya-qing
(Key Laboratory of Mariculture & Stock Enhancement in North China’s Sea, Ministry of Agriculture, Dalian Ocean University, Dalian 116023, China)
Key words:Apostichopusjaponicus; temperature; Real-time fluorescent quantitative PCR; functional gene; differentially expressed
