大气CO 2浓度升高对繁茂膜海绵阻留海水中有机碳功能的影响
2016-01-13徐辉,刘宏文,安宗福等
大气CO2浓度升高对繁茂膜海绵阻留海水中有机碳功能的影响
徐辉1,刘宏文1,安宗福2,袁成玉3,严滨4,杜英侠5,付晚涛2、6
(1.大连市环境监测中心,辽宁 大连116023;2.大连海洋大学 海洋科技与环境学院,辽宁 大连116023;3.辽宁省海洋水产科学研究院,辽宁 大连116023;4. 厦门理工学院 环境科学与工程学院,福建 厦门 361024;5. 大连海洋大学 水产与生命学院,辽宁 大连 116023;6.辽宁省高校近岸海洋环境科学与技术重点实验室,辽宁 大连116023)
摘要:在实验室条件下,研究了大气CO2浓度升高对最低等多细胞动物海绵过滤功能影响。在模拟大气CO2浓度升高的生态系统中,考察了CO2浓度为387、500、750、1000 mg/L的环境下,繁茂膜海绵Hymeniacidon perlevis阻留灭菌海水中总有机碳(TOC)的能力。结果表明:在模拟CO2浓度为387、500、750、1000 mg/L的条件下,繁茂膜海绵在16 h内清除海水中TOC的效率分别为55.8%、67.6%、50.0%和15.4%,在24 h对 TOC 的平均阻留率分别为(1.90±0.20)、(2.13±0.06)、(1.69±0.08)、(0.43±0.11) mg/(h·g海绵),平均清除率分别为(0.025±0.002)、(0.033±0.001)、(0.019±0.001)、(0.004±0.001)mL/(h·g海绵),由此可见,大气CO2浓度从约387 mg/L升高至500 mg/L时,促进了繁茂膜海绵阻留海水中TOC的能力,当浓度升高至750 mg/L时,抑制了繁茂膜海绵阻留TOC的能力,当浓度进一步升高至1000 mg/L时,导致繁茂膜海绵几乎丧失了阻留海水中TOC的能力。本研究结果可为大气CO2浓度升高对潮间带海绵过滤功能影响及其由此可能导致的近岸海域生态问题提供了参考。
关键词:海绵;大气CO2浓度;总有机碳(TOC)
DOI:10.3969/J.ISSN.2095-1388.2015.01.015
文章编号:2095-1388(2015)01-0079-06
中图分类号:P714
文献标志码:A
收稿日期:2014-04-14
基金项目:辽宁省海洋与渔业厅科研计划项目(201215);辽宁省教育厅实验室专项(LS2010024);大连海洋大学2012年校列科研项目(2012HYDX09);福建省科技计划重点项目(2014N0031)
作者简介:徐辉(1963—), 女, 高级工程师。E-mail:xuhui67067@126.com
Abstract:The effects of elevated atmospheric CO2 concentration on removal of total organic carbon (TOC) in sterilized natural seawater (SNSW) by sponge Hymeniacidon perlevis were investigated at CO2 concentration of 387, 500, 750 and 1000 mg/L in a simulated ecological system. The TOC removal was shown to be 55.8% at CO2 concentration of 387 mg/L, 67.6% at CO2 concentration of 500 mg/L, 50.0% at CO2 concentration of 750 mg/L and 15.4% at CO2 concentration of 1000 mg/L at the initial TOC concentrations for 16 h. The average retention rate of TOC within 24 h was (1.90±0.20)mg/(h·g fresh sponge) at CO2 concentration of 387 mg/L, (2.13±0.06)mg/(h·g fresh sponge) at CO2 concentration of 500 mg/L, (1.69±0.08)mg/(h·g fresh sponge) at CO2 concentration of 750 mg/L, and (0.43±0.11)mg/(h·g fresh sponge) at CO2 concentration of 1000 mg/L. The average clearance rate of TOC within 24 h by the sponge was (0.025±0.002)mg/(h·g fresh sponge) at CO2 concentration of 387 mg/L, (0.033±0.001)mg/(h·g fresh sponge) at CO2 concentration of 500 mg/L, and (0.019±0.001)mg/(h·g fresh sponge) at CO2 concentration of 750 mg/L and (0.004±0.001)mg/(h·g fresh sponge) at CO2 concentration of 1000 mg/L. It was found that rising atmospheric CO2 concentration from 387 mg/L to 500 mg/L led to promote the retention rate of TOC. However, the rising atmospheric CO2 concentration to 750 mg/L resulted in suppression of the removal ability of TOC in SNSW ability, even no removal ability of TOC in SNSW ability, was observed at CO2 concentration of 1000 mg/L. The findings provide a few cognition of influence of rising atmospheric CO2 levels on filtering capacity of intertidal sponge, thus leading to ecological issues in coastal waters.
进入工业化社会后,人类消耗大量化石能源,导致大气中CO2浓度从100多年前的280 mg/L上升至目前的387 mg/L左右,打破了保持至少几千万年的大气CO2浓度稳定状态[1],驱动海洋生态系统发生着不可逆的变化[2-4]。据最近研究估计,大气CO2浓度超过450 mg/L及与之相伴随的海水酸化和海水温度升高(比工业化前平均温度高2 ℃)是海洋生态灾难发生的阈值[5]。2007年联合国政府间气候变化委员会报告,大气CO2浓度将进一步增高,预计2100年大气CO2浓度可能达到800~1000 mg/L[1]。海洋生态系统是地球生物圈最大的固碳系统,因此,大气CO2浓度升高对海洋生物,尤其是在生态上、经济上具有重要价值的海洋生物的影响是人类需要迫切认知的科学问题。
近几十年来,大气CO2浓度升高对海洋动物影响的研究已经取得很多进展,如大气CO2浓度升高对近岸海洋无脊椎动物Tripneustesgratilla、Patiriellaregularis、Haliotiscoccoradiata受精的影响[6],以及抑制海胆Tripneustesgratilla幼苗生长[7]、降低牡蛎Saccostreaglomerata幼体的生存率[8]、阻碍马氏珠母贝inctadamartensii幼虫发育[9]、损害海洋鱼类的听觉[10]等。
海绵是目前仍然生存的最低等的多细胞动物[11],在动物界中单独构成多孔动物门[12]。作为滤食性动物,海绵具有极强的主动把海水泵入体内的能力[0.002~0.840 mL/(s·cm3新鲜海绵)][13],进而从海水中滤食溶解性有机质[14]和颗粒有机质[15],包括非生命颗粒有机质[15]和细菌[16]、浮游生物[17]等生命颗粒有机质。海绵分布于几乎所有纬度、所有深度的海水中[11],在海洋生态系统尤其是近岸海洋生态系统中扮演着重要的角色。近50年来,海绵是海洋天然活性产物和药物的最大来源生物[18]。然而,大气CO2浓度升高对在生物进化上、生态上、经济上具有重要价值的海绵的影响却是未知的。本研究中,以广泛分布于中国北黄海和渤海潮间带海域的繁茂膜海绵Hymeniacidonperlevis为模式生物,在实验室条件下,研究了模拟大气CO2浓度升高对繁茂膜海绵滤食功能的影响。
通信作者: 付晚涛(1969—), 男, 博士, 教授。E-mail:fuwantao@dlou.edu.cn
1材料与方法
1.1 材料
繁茂膜海绵采集于大连市黑石礁潮间带海域,在0.5 h内运回实验室,暂养于通气的50 L水族缸中,1 d后用于试验。试验用海水取自大连市黑石礁海域,经煮沸沙滤获得灭菌海水。
海参饵料来自辽宁省海洋水产科学研究院。试验药品除标明外均为分析纯。
试验使用的模拟大气CO2浓度升高影响近岸海洋生物的实验室生态系统(以下简称模拟生态系统),及不同浓度CO2的制备参见文献[19]。
1.2 方法
1.2.1试验设计
(1)在模拟大气CO2浓度为500 mg/L的试验中,设5个模拟生态系统,每个系统中装有冷却至室温的30 L灭菌沙滤海水,并加入海参饵料于灭菌海水中使其浓度为200 mg/L。第一个模拟生态系统,用蠕动泵把大气的气体泵入海水中(大气CO2浓度约为387 mg/L),不放入海绵,作为空白组;第二个模拟生态系统,同样用蠕动泵把大气中的气体泵入海水中,放入约30 g海绵,作为对照组;第三、第四、第五个模拟生态系统,分别用蠕动泵把气囊(CO2浓度为500 mg/L)中的气体泵入海水中,分别放入约30 g海绵,分别作为试验组1、2、3。在试验的0、4、8、12、16、24 h时,分别在上述5个模拟生态系统中取海水20 mL(重复3次),用总有机碳分析仪(TOC-VCPH/CPN,SHIMADZU)检测海水中总有机碳(TOC)的含量。试验开始和试验结束时,称量每组的海绵质量,并监测模拟生态系统中海水的pH值(赛多利斯PB-10酸度计)。
(2)在模拟大气CO2浓度为750 mg/L的试验和1000 mg/L的试验中,除试验组1、2、3中使用CO2浓度分别为750 mg/L和1000 mg/L的气囊外,其他试验条件和过程均与模拟大气CO2浓度为500 mg/L的试验相同。
1.2.2阻留率和清除率的计算阻留率[RR,mg/(h·g海绵)]一般被用于表征水生无脊椎动物[20]尤其是海绵[21]阻留海水中物质的能力。
清除率[CR,mL/(h·g海绵)]一般被用于间接表征水生无脊椎动物[20]尤其是海绵[21]的过滤能力。其计算公式[20]如下:
RR=(C0-Ct)V/(t·W),
(1)
CR=ln (C0/Ct)V/(t·W)。
(2)
其中:C0和Ct分别为初始时刻和t时刻海水中 TOC的浓度(mg/L);V为容器中海水的体积(L);t为试验时间(h);W为海绵鲜质量(g)。
1.3 数据处理
试验数据均采用SPSS 11.0进行统计分析。每次重复取样3次,采用t检验法进行统计学意义检验。
2结果与分析
2.1 模拟生态系统中海水的温度和pH
试验期间,各模拟生态系统中海水温度均保持在15~19 ℃。空白组海水pH为8.09~8.17;对照组海水pH为8.09~8.17;CO2浓度为500、750、1000 mg/L的试验组海水pH分别为7.86~7.93、7.72~7.79、7.54~7.60。
2.2 海绵质量的变化
在模拟大气CO2浓度为500、750、1000 mg/L的试验中,试验结束时海绵质量均比试验初始时有所增加,其中对照组和试验组的平均增长率分别为2.13%和2.93%(CO2浓度500 mg/L)、2.67%和2.64%(CO2浓度750 mg/L)、2.68%和2.37%(CO2浓度1000 mg/L)(表1)。结果显示,在模拟大气CO2浓度为500 mg/L的试验中,试验组海绵生物量的增长率大于对照组;CO2浓度为750 mg/L的试验中,试验组与对照组海绵生物量的增长率几乎相同;CO2浓度为1000 mg/L的试验中,试验组海绵生物量的增长率小于对照组。
2.3 大气CO 2 浓度升高背景下海绵阻留海水中TOC的动力学过程
在模拟大气CO2浓度升高的生态系统中,繁茂膜海绵阻留海水中TOC的动力学过程见图1-A、B、C,海绵的清除率见图1- D、E、F。在模拟大气CO2浓度500、750、1000 mg/L的3个独立试验中,初始时海水中TOC含量分别为(109.97±11.05)、(123.05±12.03)、(117.23±10.27)mg/L;加入海绵、通入大气(CO2浓度约387 mg/L)的对照组,海水中TOC含量随时间的延长而降低;加入海绵、通入高浓度CO2气体的试验组,除CO2浓度为1000 mg/L组外,其他两个浓度组海水中TOC含量也随时间的延长而降低;未加海绵、通入大气的空白组在24 h试验期间,海水中TOC含量虽有波动,但无显著性差异(P>0.05)(图1-A、B、C)。可见,海绵滤食作用可导致对照组和试验组海水中TOC含量降低。
表1模拟大气CO2浓度500、750、1000 mg/L试验中海绵的生长
Tab.1Growth of marine spongeHymeniacidonperlevisin simulated atmospheric CO2concentration of 500,750,
and 1000 mg/L
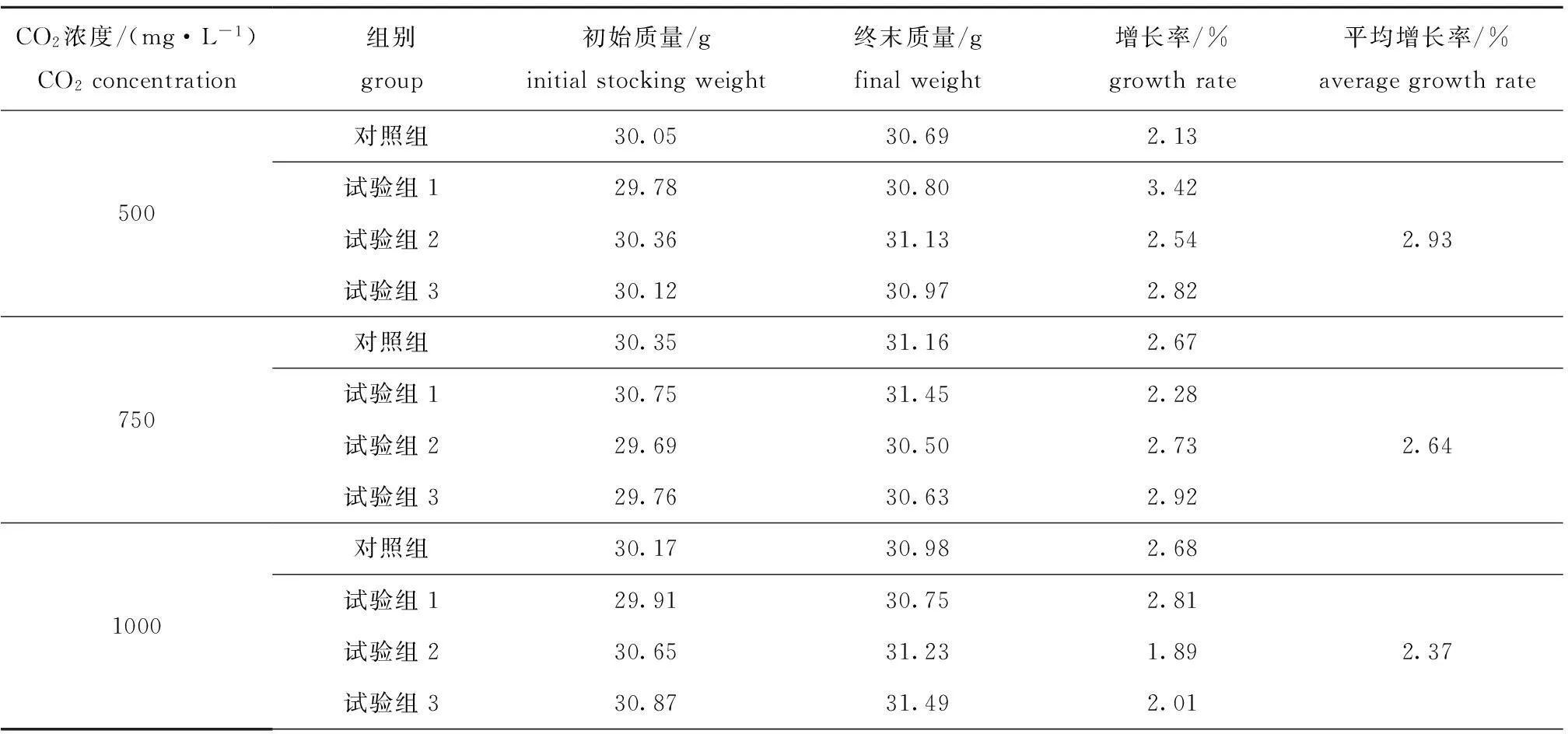
CO2浓度/(mg·L-1)CO2concentration组别group初始质量/ginitialstockingweight终末质量/gfinalweight增长率/%growthrate平均增长率/%averagegrowthrate500对照组30.0530.692.13试验组129.7830.803.42试验组230.3631.132.542.93试验组330.1230.972.82750对照组30.3531.162.67试验组130.7531.452.28试验组229.6930.502.732.64试验组329.7630.632.921000对照组30.1730.982.68试验组129.9130.752.81试验组230.6531.231.892.37试验组330.8731.492.01
从表2可见:模拟大气CO2浓度为500 mg/L的试验中,试验1、2、3组繁茂膜海绵在24 h时对TOC的阻留率和清除率均高于对照组;在CO2浓度为750 mg/L的试验中,试验1、2、3组繁茂膜海绵在24 h时对TOC的阻留率和清除率低于对照组,也低于大气CO2浓度为500 mg/L试验中海绵的阻留率和清除率;在CO2浓度为1000 mg/L试验中,试验1、2、3组繁茂膜海绵在24 h时对TOC的阻留率和清除率明显低于对照组,也低于大气CO2浓度750 mg/L试验中海绵的阻留率和清除率。
在CO2浓度为387、500、750、1000 mg/L时,在16 h内,海绵清除海水中TOC的效率分别为55.8%、67.6%、50.0%、15.4%。可见,大气CO2浓度从387 mg/L上升至500 mg/L时,增强了繁茂膜海绵阻留功能,当CO2浓度上升至750 mg/L时,反而降低了繁茂膜海绵的阻留功能,当CO2浓度上升至1000 mg/L时几乎导致繁茂膜海绵丧失了阻留功能。
表2模拟大气CO2浓度500、750、1000 mg/L试验中24 h时海绵对TOC的阻留率和清除率
Tab.2Retention rate and clearance rate of marine spongeHymeniacidonperlevisin simulated atmospheric CO2concentration of 500,750,and 1000 mg/L for 24 h

CO2浓度/(mg·L-1)CO2concentration组别group阻留率/(mg·h-1·g-1)retentionrate清除率/(mL·h-1·g-1)clearancerate500对照组1.720.023试验组12.180.034试验组22.070.032试验组32.150.034试验组平均值2.13±0.060.033±0.001750对照组2.120.027试验组11.610.018试验组21.780.020试验组31.680.019试验组平均值1.69±0.080.019±0.0011000对照组1.850.024试验组10.320.003试验组20.430.004试验组30.550.006试验组平均值0.43±0.110.004±0.001

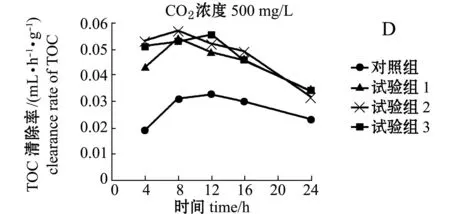
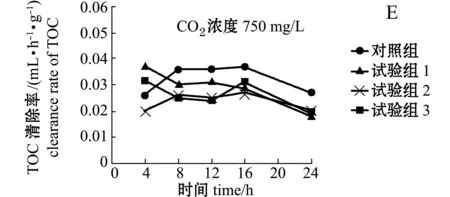

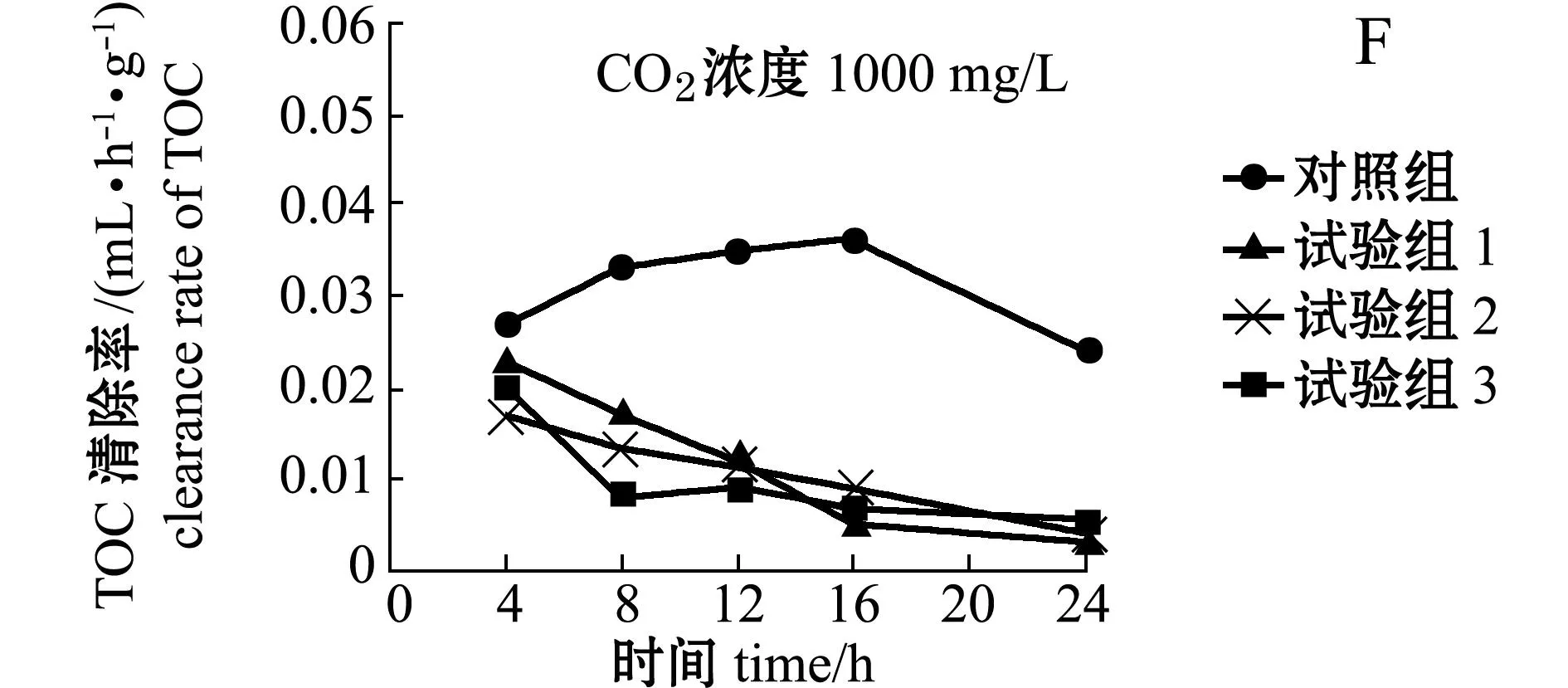
图1 大气CO 2浓度500、750、1000 mg/L对繁茂膜海绵过滤功能影响
Fig.1Influence of atmospheric CO2concentration of 500,750,and 1000 mg/L on filtering capacity of marine
spongeHymeniacidonperlevis
3讨论
海绵属滤食性动物,是构成海洋底栖种群中的重要组成部分[21-22],尤其是在近海生态系统中扮演着至关重要的角色[16,23-25]。繁茂膜海绵广泛分布于中国北黄海、渤海的潮间带,已经展示了其在水产养殖生态系统[15-16,26-27]、近岸海域生态系统[28-29]中滤食大肠杆菌、弧菌等病原微生物、浮游微藻、有机质等的重要作用。
在模拟大气CO2浓度升高对繁茂膜海绵过滤功能影响试验的对照组(CO2浓度约387 mg/L)中,海绵清除20 L海水体系中TOC的动力学过程呈现出典型的逻辑斯蒂模型,即在第一阶段(约16 h),海水中TOC浓度显著降低,而在第二阶段(16~24 h),海水中TOC浓度相对稳定。这种现象与繁茂膜海绵在0.5 L海水中呈现的现象一致[15],也与0.5 L海水体系中繁茂膜海绵的过滤效果相同[15],繁茂膜海绵清除20 L海水体系中的TOC含量时,在24 h时海水中TOC浓度从开始的约120 mg/L降至约50 mg/L。在健康状况下,海绵主动泵入海水的效率是相对稳定的[30-31]。本研究中,3个独立试验的对照组海绵的阻留率分别为1.72、2.12、1.85 mg/L,与0.5 L海水体系中繁茂膜海绵的阻留率几乎一致(2.04 mg/L)[15],也与生长于西太平洋印度海域的海绵Theonellaswinhoei[9]和生长于热带海域的3种海绵Mycalesp.、Verongiagigantea、Tethyacrypta[32]的阻留率相当。
在模拟大气CO2浓度升高对繁茂膜海绵过滤功能影响试验的试验组(CO2浓度500、750、1000 mg/L)中,海绵清除20 L海水体系中TOC的动力学过程同样呈现出典型的逻辑斯蒂模型,除了大气CO2浓度1000 mg/L组外。其中,大气CO2浓度为500 mg/L时促进了海绵的阻留效率,在24 h海绵的平均阻留率和平均清除率均高于对照组;大气CO2浓度为750 mg/L时抑制了海绵的阻留效率,在24 h海绵的平均阻留率和平均清除率均低于对照组和大气CO2浓度为500 mg/L的试验组;大气CO2浓度升高至1000 mg/L时,海绵的阻留效率几乎丧失,试验组海绵的阻留率和清除率远低于CO2浓度为750 mg/L的组。在健康状况下,海绵具有相对稳定的泵水效率[25-26]。而当大气CO2浓度升高至500 mg/L时,可能促进了海绵细胞的活力,提升了海绵泵水效率,也即增强了海绵的阻留效率。当大气CO2浓度升高至750 mg/L,其造成的海水酸化可能损害了海绵细胞的功能,导致海绵阻留效率下降;当大气CO2浓度进一步升高至1000 mg/L,海绵的阻留过滤功能几乎完全丧失,也就意味着近岸海域海绵不再具有阻留滤食海水中有机质、细菌、浮游生物等的能力。
4结语
本研究中研究了大气CO2浓度升高对潮间带海绵过滤功能的影响。大气CO2浓度从约387 mg/L升高至500 mg/L时,促进了繁茂膜海绵阻留海水中TOC的能力;大气CO2浓度升高至750 mg/L时,抑制了繁茂膜海绵阻留TOC能力;大气CO2浓度进一步升高至1000 mg/L时,导致繁茂膜海绵几乎丧失了阻留海水中TOC能力。对于在近海基岩底质占据主导位置的海绵种群,大气CO2浓度升高将改变海绵过滤功能,进而显著影响近海生态系统。若大气CO2浓度升高至750 mg/L以上,则可能导致近海生态灾害发生。
为了阐明大气CO2浓度升高对海绵过滤机制的影响,今后需要从以下几方面进行研究:(1)海绵健康状况的变化;(2)海绵细胞活力的变化;(3)海绵分子的相应机制与适应机制及其变化。
参考文献:
[1]IPCC.Climate Change 2007[R].Cambridge:Cambridge University Press,2007.
[2]Hoegh G O,Bruno J F.The impact of climate change on the world’s marine ecosystems[J].Science,2010,328:1523-1528.
[3]Harley C D G,Randall H A,Hultgren K M,et al.The impacts of climate change in coastal marine systems[J].Ecology Letters,2006,9(2):228-241.
[4]Feely R A,Sabine C L,Lee K,et al.Impact of anthropogenic CO2on the CaCO3system in the oceans[J].Science,2004,305:362-366.
[5]Rockström J,Steffen W,Noone K,et al.A safe operating space for humanity[J].Nature,2009,461:472-475.
[6]Byrne M,Soars N A,Ho M A,et al.Fertilization in a suite of coastal marine invertebrates from SE Australia is robust to near-future ocean warming and acidification[J].Marine Biology,2010,157(9):2061-2069.
[7]Brennand H S,Soars N,Dworjanyn S A,et al.Impact of ocean warming and ocean acidification on larval development and calcification in the sea urchinTripneustesgratilla[J].PLoS One,2010,5(6):1-7.
[8]Watson S A,Southgate P C,Tyler P A,et al.Early Larval development of the Sydney rock oysterSaccostreaglomerataunder near-future predictions of CO2-driven ocean acidification[J].Journal of Shellfish Research,2009,28(3):431-437.
[9]何盛毅,林传旭,何毛贤,等.海洋酸化对马氏珠母贝胚胎和早期幼虫发育的影响[J].生态学杂志,2011,30(4):747-751.
[10]Munday P L,Dixsona D L,Donelsona J M,et al.Ocean acidification impairs olfactory discrimination and homing ability of a marine fish[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(6):1848-1852.
[11]Nicholss S,Worheide G.Sponges:new views of old animals[J].Integrative and Comparative Biology,2005,45(2):333-334.
[12]刘瑞玉.中国海洋生物名录[M].北京:科学出版社,2008.
[13]Rutzler K.Associations between Caribbean sponges and photosynthetic organisms[M]//New Perspectives in Sponge Biology.Washington D C:Smithsonian Institution Press,1990:455-466.
[14]Yahel G,Sharp J H,Marie D,et al.In situ feeding and element removal in the symbiont-bearing spongeTheonellaswinhoei:bulk DOC is the major source for carbon[J].Limnology and Oceanography,2003,48(1):141-149.
[15]Fu W T,Wu Y C,Zhang W,et al.Efficient bioremediation of total organic carbon (TOC) in integrated aquaculture system by marine spongeHymeniacidonperleve[J].Biotechnology and Bioengineering,2007,97(6):1387-1397.
[16]Fu W T,Sun L M,Zhang W,et al.Potential of the marine spongeHymeniacidonperleveas a bioremediator of pathogenic bacteria in integrated aquaculture ecosystems[J].Biotechnology and Bioengineering,2006,93(6):1112-1122.
[17]付晚涛,张卫,金美芳,等.繁茂膜海绵滤食养殖水体中过剩饵料的研究[J].海洋环境科学,2006,25(3):29-32.
[18]Blunt J W,Copp B R,Munro M H,et al.Marine natural products[J].Natural Product Reports,2010,27(2):165-237.
[19]付晚涛,刘佳,张菊林,等.大气CO2浓度升高对大型海藻孔石莼生长和色素含量的影响[J].大连海洋大学学报,2013,28(5):481-486.
[20]Coughlan J.The estimation of filtering rate from the clearance of suspensions[J].Marine Biology,1969,2:356-358.
[21]Simpson T L.The cell biology of sponges[M].New York:Springer,1984.
[22]Vacelet J.La place des spongiaires dans les systemes trophiques marins[M]//Biologie des Spongiaires.Paris:Editions du CNRS,1979:259-270.
[23]Officer C B,Smayda T J,Mann R.Benthic filter feeding:a natural eutrophication control[J].Marine Ecology Progress Series,1982,9:203-210.
[24]Gili J M,Coma R.Benthic suspension feeders:their paramount role in litteroal marine food webs[J].Tree,1998,13:316-321.
[25]Ribes M.Sponges and ascidians control removal of particulate organic nitrogen from coral reef water[J].Limnology and Oceanography,2005,50(5):1480-1489.
[26]付晚涛,张菊林,曹淑清,等.“海参苗-海绵-大型海藻”循环养殖技术[J].水产科学,2013,32(10):559-566.
[27]Zhang X C,Zhang W,Xue L Y,et al.Bioremediation of bacteria pollution using the marine spongeHymeniacidonperlevisin the intensive mariculture water system of turbotScophthalmusmaximus[J].Biotechnology and Bioengineering,2010,105(1):59-68.
[28]刘宏文,徐辉,付晚涛.繁茂膜海绵滤除天然海水中病原细菌研究[J].环境科学与技术,2013,36(12M):32-36.
[29]赵权宇,邓麦村,曲传宇,等.两种黄海潮间带海绵的元素与氨基酸成分分析[J].海洋科学,2004,28(3):27-31.
[30]Reiswig H M.In situ pumping activities of tropical demospongiae[J].Marine Biology,1971,9:38-50.
[31]Reiswig H M.Water transport,respiration and energetics of three tropical marine sponges[J].Journal of Experimental Marine Biology and Ecology,1974,14:231-249.
[32]Reiswig H M.Particle feeding in natural populations of three marine demosponges[J].The Biological Bulletin,1971,141:568-591.
Influence of rising atmospheric CO2concentration on
removal of total organic carbon in seawater by
spongeHymeniacidonperlevis
XU Hui1, LIU Hong-wen1, AN Zong-fu2, YUAN Cheng-yu3,
YAN Bin4, DU Yin-xia5, FU Wan-tao2,6
(1.Center of Environment Monitoring of Dalian, Dalian 116023, China; 2.College of Marine Science and Environment, Dalian Ocean University, Dalian 116023, China; 3. Institute of Ocean and Fisheries Science Research in Liaoning Province, Dalian 116023, China;4. School of Environmental Science and Engineering, Xiamen University of Technology, Xiamen 361024, China; 5. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023, China; 6. Key Laboratory of Nearshore Marine Environmental Science and Technology of Liaoning Province’s University, Dalian 116023, China)
Key words:Hymeniacidonperlevis; atmospheric CO2level; total organic carbon(TOC)
