胎盘生长因子基因沉默对人脐静脉内皮细胞炎症因子表达的影响
2016-01-12李海芳,苏卫东,刘传丽等
胎盘生长因子基因沉默对人脐静脉内皮细胞炎症因子表达的影响
李海芳1,苏卫东1,刘传丽2,徐晨1,邱丽君1
(1天津市第四中心医院,天津300140;2武警后勤学院附属医院)
摘要:目的观察沉默胎盘生长因子(PGF)基因对脂多糖(LPS)诱导的人脐静脉内皮细胞(HUVECs)炎性因子表达的影响。方法体外培养HUVECs细胞至第3代,分为A、B、C、D、E组。A组转染siRNA-NC质粒(为非特异性沉默对照质粒),B组转染siRNA-PGF质粒,C组转染siRNA-NC+pcDNA3质粒(为NF-κB过表达对照质粒),D组转染siRNA-PGF+pcDNA3质粒,E组转染siRNA-PGF+pcDNA3-NF-κB质粒。上述各组转染24 h后与100 ng/mL的LPS共孵育24 h,收集各组细胞及细胞上清液,分别用于相关细胞因子mRNA(实时荧光定量PCR法)及蛋白(ELISA法)的检测。结果与A组相比,B组MCP-1、IL-1、IL-6、TNF-α、NF-κB mRNA和蛋白的表达均明显下降,两组相比,P均<0.05。与D组相比,E组MCP-1、IL-1、TNF-α mRNA和蛋白的表达均上升,两组相比,P均<0.05。结论 沉默PGF基因可以通过NF-κB信号通路的介导在mRNA和蛋白水平上抑制HUVECs炎症因子MCP-1、IL-1、TNF-α的表达,从而减轻炎症反应。
关键词:胎盘生长因子;基因沿默;脂多糖;动脉粥样硬化;人脐静脉内皮细胞;炎性因子
doi:10.3969/j.issn.1002-266X.2015.43.009
中图分类号:R543;Q78 文献标志码:A
基金项目:天津市第四中心医院博硕基金资助项目。
收稿日期:(2015-07-16)
通信作者:邱丽君
动脉粥样硬化(AS)是由炎症因子和趋化因子介导的全身炎症及免疫反应性疾病[1]。内皮细胞功能失调(尤其是炎症反应)被认为是AS发病机制中的一个关键性环节。炎性因子脂多糖(LPS)能诱导内皮细胞产生炎症反应[2]。研究[3,4]发现,胎盘生长因子(PGF)能够在血管新生、侧支血管生成、造血、肿瘤发生、炎症反应动和AS等方面发挥作用,但其作用机制尚不明确。2015年1月,我们观察了沉默PGF基因对LPS诱导的人脐静脉内皮细胞(HUVECs)炎性因子表达的影响,探讨PGF在AS发病中的作用机制。
1材料与方法
1.1LPS的配置将10 mg的LPS加入1 mL的PBS,配制成10 g/L的LPS母液,分装后置-20 ℃保存,使用前用DMEM培养液配制成终浓度为10 mg/L的LPS培养液。
1.2HUVECs的培养及鉴定取新鲜人脐带(由武警后勤学院附属医院提供,离体时间不超过2 h,产妇知情同意),长约20 cm,无菌PBS洗净后灌注0.2%胰蛋白酶20 mL,血管钳夹闭其两端,置37 ℃孵箱中10 min。收集HUVECs,1 200 r/min离心10 min,弃上清,加入培养基,置37 ℃、5% CO2孵箱中培养24 h。PBS洗涤,加入含有10%胎牛血清培养基中继续培养,2~3 d换液1次,至贴壁细胞70%~80%融合时消化传代。倒置相差显微镜下观察细胞呈单层鹅卵石样排列,Ⅷ因子免疫荧光染色阳性,即确定为HUVECs。
1.3HUVECs分组、PGF基因沉默及其炎症因子mRNA和蛋白的检测① HUVECs分组:取第3代HUVECs接种到12孔板,待细胞长满时随机分组,分别为A、B、C、D、E组,每组6孔。②基因质粒转染:首先构建PGF沉默质粒(siRNA-PGF)且实验结果表明该质粒可有效干扰HUVECs的PGF表达。构建NF-κB过表达质粒(pcDNA3-NF-κB)且实验结果表明该质粒可明显升高HUVECs的NF-κB表达。A组转染siRNA-NC质粒,B组转染siRNA-PGF质粒,C组转染siRNA-NC+pcDNA3质粒,D组转染siRNA-PGF+pcDNA3质粒,E组转染siRNA-PGF+pcDNA3-NF-κB质粒。其中,siRNA-NC为非特异性沉默对照质粒,pcDNA3为NF-κB过表达对照质粒。上述各组转染不同基因质粒24 h后与100 ng/mL的LPS共孵育24 h。分别收集各组细胞及细胞上清液,用于相关细胞因子mRNA及蛋白的检测。A组和B组检测单核细胞趋化蛋白-1(MCP-1)、白细胞介素1(IL-1)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)及核因子κB(NF-κB)的mRNA和蛋白;C、D、E组检测MCP-1、IL-1、IL-6、TNF-α的 mRNA和蛋白。③HUVECs炎症因子mRNA检测:采用实时荧光定量PCR法。抽提各组HUVECs总RNA,逆转录得到cDNA后进行实时荧光定量PCR。PCR反应体系20 μL,其中含SYBR Premix EX Taq II(2×)10 μL 、ROX Reference Dye II(50×)0.4 μL 、反转录产物4 μL 、上下游引物各0.5 μL、dH2O 3.6 μL。PCR反应条件为90 ℃ 12 min进行预变性,然后两步法进行扩增,95 ℃ 10 s、58 ℃ 40 s,共42个循环。将目的基因的Ct值用GAPDH的Ct值进行标准化,并以此作为目的基因的相对表达量。④HUVECs培养上清液中炎症因子蛋白检测:采用ELISA法。按照ELISA试剂盒说明书进行操作,在实验板内每孔加标准品及待测HUVECs上清液,37 ℃反应120 min;甩去板内液体,洗板;每孔加酶标抗体工作液,37 ℃反应60 min;甩去板内液体,洗板;每孔加入底物工作液,37 ℃暗处反应15 min;最后加入终止液,用酶标仪在450 nm处测吸光度值。
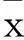
2结果
2.1A、B组炎症因子mRNA和蛋白的表达比较A、B组炎症因子mRNA和蛋白的表达见表1、2。表1、2显示,与A组相比,B组转染siRNA-PGF沉默PGF的表达后,HUVECs 的MCP-1、IL-1、IL-6、TNF-α、NF-κB mRNA和蛋白表达量均减少。

表1 A、B组炎症因子mRNA的表达比较
注:与A组相比,*P<0.05。
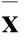
表2 A、B组炎症因子蛋白的表达比较(吸光度值, ± s)
注:与A组相比,*P<0.05。
2.2C、D、E组炎症因子mRNA和蛋白的表达比较C、D、E组炎症因子mRNA和蛋白的表达见表3、4。表3、4显示,过表达NF-κB可挽救沉默PGF导致的HUVECs的MCP-1、IL-1、TNF-α表达下降,而对IL-6的表达没有明显影响,表明PGF可以通过NF-κB信号通路的介导调节HUVECs 的MCP-1、IL-1、TNF-α表达。
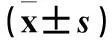
表3 C、D、E组炎症因子mRNA的表达比较
注:与C组相比,*P<0.05;与D组相比,#P<0.05。
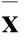
表4 C、D、E组炎症因子蛋白的表达比较(吸光度值, ± s)
注:与C组相比,*P<0.05;与D组相比,#P<0.05。
3讨论
AS斑块的主要组成细胞为单核细胞、血管内皮细胞及血管平滑肌细胞[5~7]。内皮功能异常及内皮细胞的激活是血管病变的早期表现,在炎症、高血糖、高血脂、高胰岛素血症等影响下,各种黏附分子及趋化因子的表达增加,募集各种细胞向动脉内膜迁移,导致AS的形成[8]。LPS属于促炎症细胞因子,可刺激内皮细胞和白细胞释放一系列炎症介质,如趋化因子、氧自由基、细胞因子等,这些炎症介质可造成血管内皮细胞损伤、内皮细胞间隙增大、血管基膜暴露、中性粒细胞和单核细胞等迁移至内皮下,加剧炎症反应[9]。
MCP-1属趋化因子家族中的β亚家族,由于其氨基端含两个半胱氨酸,以Cys-Cys方式排列,因此也称为CC趋化性细胞因子,可由多种细胞合成分泌。Hoogeveen等[10]在研究血浆MCP-1水平与外周动脉疾病或冠状动脉粥样硬化性心脏病之间关系时发现,MCP-1水平随冠状动脉粥样硬化程度增加而升高,抑制MCP-1的生成或者应用MCP-1拮抗剂不仅可限制粥样斑块的进展,而且能稳定斑块。IL-1主要由活化的巨噬细胞、内皮细胞、平滑肌细胞和成纤维细胞产生,可以促进白细胞和血小板黏附于受损的内皮细胞以及血小板活化,是一种敏感和特异的急性期炎性指标。IL-6在免疫应答和炎症反应中发挥重要作用,是一种重要的炎症因子,主要作用是诱导B淋巴细胞、T淋巴细胞分化和产生抗体,诱导多种急性期蛋白质合成和分泌等。NF-κB为具有多向转录调节作用的蛋白质,与许多基因特别是免疫炎症相关基因(如各种细胞因子、趋化因子和黏附分子等)的转录调控密切相关,而这些因子又对相应细胞的活化、增殖、浸润、趋化和分泌功能起着直接的调控作用。AS斑块处的血管内皮细胞中存在NF-κB的激活[11]。
非活化的NF-κB通常在细胞胞质中与抑制性卡巴蛋白(κB)结合,炎症因子的刺激通过多种信号转导途径使IκB磷酸化,在蛋白水解酶作用下发生降解,释放NF-κB并转运至核内,诱导炎症因子如TNF、IL-6、MCP-1等表达[12]。有研究者[13]在血管紧张素Ⅱ诱导的小鼠胚胎成纤维细胞中过表达PGF后,用ELISA检测到NF-κB的表达明显增加,同时发现IL-6、TNF-α表达也增加。本研究发现,在沉默PGF基因后,HUVECs的MCP-1、IL-1、IL-6、TNF-α、NF-κB mRNA及蛋白表达均明显减少,表明沉默PGF基因能从基因和蛋白水平抑制LPS引起的HUVECs炎症因子的表达。进一步实验发现,过表达NF-κB可以挽救沉默PGF基因诱导的MCP-1、IL-1、TNF-α的表达下降。但是,本研究并未发现NF-κB介导PGF对IL-6的调控,可能是由于不同的细胞模型所导致的。
总之,本研究结果表明,沉默PGF基因可以通过NF-κB信号通路的介导而从mRNA和蛋白水平上抑制HUVECs炎症因子MCP-1、IL-1、TNF-α的表达,从而减轻炎症反应,这有可能成为AS潜在的治疗靶点。
参考文献:
[1] Roncal C, Buysschaert I, Gerdes N, et al. Short-term delivery of anti-PlGF antibody delays progression of atherosclerotic plaques to vulnerable lesions [J]. Cardiovasc Res, 2010,86(1):9-36.
[2] 张肇林,韩雪莹,邓景惕,等.辛伐他汀对脂多糖诱导的人脐静脉内皮细胞炎性反应抑制作用[J].中国现代普通外科进展,2011,14(11):841-845.
[3] Desai J, Holt-Shore V, Torry RJ, et al. Signal transduction and biological function of placenta growth factor in primary human trophoblast [J]. Biol Reprod, 1999,60(4):887-892.
[4] Yoo SA, Yoon HJ, Kim HS , et al. Role of placenta growth factor and its receptor flt-1 in rheumatoid inflammation: a link between angiogenesis and inflammation[J]. Arthritis Rheum, 2009,60(2):345-354.
[5] Ross R. Atherosclerosis is an inflammatory disease [J]. Am Heart J, 1999,138(5 Pt 2):419-420.
[6] Kartinen M, van der Wal AC, van der Loos CM, et al. Mast cell infiltration in acute coronarysyndromes: implications for plaque rupture [J]. J Am Coll Cardiol, 1998,32(3):606-612.
[7] van der Wal AC, Piek JJ,de Boer OJ, et al. Recent activation of the plaque immune response in coronary lesions underlying acute coronary syndromes [J]. Heart, 1998,80(1):14-18.
[8] Zhao J, Yan HM, Li Y, et al. Pitavastatin calcium improves endothelial function and delays the progress of atherosclerosis in patients with hypercholesterolemia [J]. Biomedic Biotechnol, 2015,16(5):380-387.
[9] 周信,张小容,张秋燕,等.生半夏及其炮制品对小鼠主动脉内皮细胞炎性因子分泌的影响[J].中国实验方剂学杂志,2013,19(10): 261-265.
[10] Hoogeveen RC, Morrison A, Boerwinkle E, et al. Plasma MCP-1 level and risk for peripheral arterial disease and incident coronary heart disease: atherosclerosis risk in communities study [J]. Atherosclerosis, 2005,183(2):301-307.
[11] 段岩,李杰,陶杰,等.E1A激活基因阻遏子对抗肿瘤坏死因子α引起的血管内皮细胞炎性损伤[J].中国动脉硬化杂志,2011,19(9): 721-726.
[12] Ghanim H, Garg R, Aljada A, et al. Suppression of nuclear factor-κB and stimulation of inhibitor κB by troglitazone: evidence for an anti- inflammatory effect and a potential[J]. J Clin Endocrinol Metab, 2001,86(3):1306-1312.
[13] Kitasato L, Tojo T, Hashikata T, et al. Vascular fibrosis enhanced by embryonic signal switching: a novel mechanism of placental growth factor-induced coronary artery sclerosis[J]. Euro Heart J,2013,34(Suppl 1):4167.
