基于活度系数模型的含离子液体体系相平衡研究
2016-01-12孙德章李文秀胡盎然张志刚
孙德章, 李文秀, 胡盎然, 张志刚
(沈阳化工大学 化学工程学院, 辽宁 沈阳 110142)
甲醇和丙酮均是极为重要的有机化工原料,在现代化工生产中有着十分广泛的应用.在工业生产中,丙酮与甲醇常以混合物的形式存在,如:在煤改油技术的费托合成工艺中;糠醛的生产工艺中等.然而在常压下甲醇与丙酮形成最低共沸物,共沸点为甲醇88 %(质量分数),丙酮12 %(质量分数),共沸温度为55.5 ℃[1].一般的精馏无法进行有效的分离,因此需要采用一些特殊的精馏方法来分离丙酮甲醇物系.常见的特殊精馏方式有:萃取精馏;变压精馏;加盐精馏;恒沸精馏[2]等.本文主要研究萃取精馏方法对丙酮-甲醇共沸物系的分离.众所周知,在萃取精馏过程中,萃取剂的选择至关重要.高选择性,低能耗,低污染是重要的考虑因素.在前期的研究中,水[3],单乙醇胺[4],氯苯[5]等传统有机溶剂已作为溶剂用于丙酮-甲醇共沸物系的相平衡研究.但是,传统有机溶剂存在溶剂损失大,能耗大等缺点.近年来随着离子液体研究的兴起,离子液体作为萃取剂用于萃取精馏逐渐有取代传统有机溶剂的趋势.
离子液体[6]作为一种新型的绿色有机溶剂有许多独特的物理化学性质,如:无可测蒸汽压;高选择性与溶解性;可设计性;高热稳定性和化学稳定性[7]等.目前,离子液体作为萃取剂用于研究丙酮-甲醇共沸物系的有Vincent Liebert[8]的1-乙基-3-甲基咪唑硫酸氢盐和1-乙基-3-甲基咪唑硫酸甲酯盐;A. Vicent Orchilles[9-11]的1-丁基-3-甲基咪唑三氟甲磺酸盐;1-丁基-3-甲基吡啶三氟甲磺酸盐;1-乙基-3-甲基咪唑二氰铵盐等.这些测定的气液相平衡数据必定符合基本的热力学原理,即可用一般的热力学模型进行关联,而活度系数模型是描述体系相平衡的常用模型[12].本文主要通过实验测得的离子液体1-乙基-3-甲基咪唑醋酸盐和单乙醇胺醋酸盐与甲醇、丙酮的二元汽液相平衡数据,基于常用的热力学模型(Wilson和NRTL)对含离子液体体系的相平衡数据进行计算,并比较哪一种活度系数模型更加合适含离子液体体系的汽液相平衡.结合上述的热力学模型通过非线性拟合的方法,求得离子液体与共沸组分的二元能量交互参数.考察不同离子液体对丙酮-甲醇共沸物系的相平衡行为的影响,为离子液体的工业化应用提供一定的理论基础.
1 实验部分
1.1 药品与仪器
实验用化学试剂如表1所示.
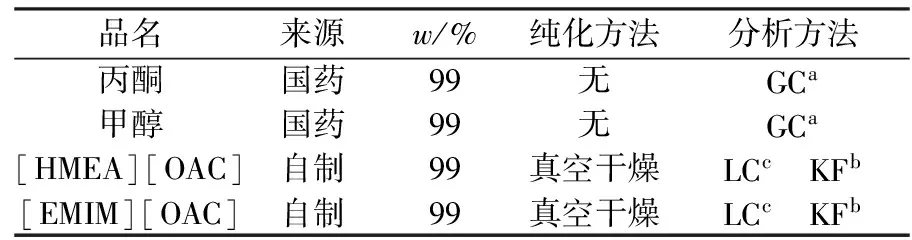
表1 化学试剂说明
注:a气相色谱仪;b卡尔-费休水分测定仪;c液相色谱仪.
1.2 实验过程
在全玻璃动力循环平衡釜[13]中进行离子液体+共沸组分的二元等压汽液相平衡实验,每个离子液体与共沸组分的二元汽液相平衡数据实验点都是通过不断往原始试样中添加离子液体得到的,原始试样中共沸组分(丙酮、甲醇)的含量最高.将原始试样加入到沸点仪中加热到沸腾后,观察温度计示数,若温度保持不变且气相冷凝在2~3滴/s,则认为达到平衡,保持2 h后进行取样分析.
1.3 样品分析
实验样品由上海天美公司出品的气相色谱仪(GC-7890A)测得.气相色谱仪配有长30米,外径2.5 μm,厚2.5 μm的SP-7800型毛细管色谱柱和一个FID检测器,载气为N2.分析条件为:进样口温度170 ℃;柱箱温度40 ℃;检测器温度200 ℃;电子分析天平(CAV264C奥斯USA)最小偏差为0.000 1 g;石英温度计偏差为0.05 ℃.
由于离子液体的不挥发性,在气相中没有离子液体,气相色谱中无离子液体的峰值出现,因此只需测定液相中离子液体的含量.液相中的离子液体含量采用称重法进行测定,具体步骤为:取已知质量的离子液体+挥发组分混合物,放入真空干燥箱中直至试样瓶中混合物的质量不再发生变化为止,此时剩余物的质量即为离子液体的质量,称重进而求得离子液体在液相中的质量分数.
2 结果与讨论
2.1 实验数据
为验证本实验中相平衡仪的可靠性,对该设备进行校核.在该平衡釜中进行丙酮-甲醇二元相平衡实验,得到在本实验室条件下丙酮-甲醇的实验二元相平衡数据.通过与前人实验数据[8]的对比,二者数据具有良好的一致性,结果如图1所示. 因此,认为该相平衡釜可靠,可以进行相平衡实验研究.

图1 101.3 kPa下的丙酮(1)+甲醇(2)二元等压汽液平衡数据
通过上述称重法测定不同离子液体与共沸组分:丙酮(1)+[EMIM][OAC](3);甲醇(2)+[EMIM][OAC](3);丙酮(1)+[HMEA][OAC](3)和甲醇(2)+[HMEA][OAC](3)的二元相平衡数据.结果如表2~表5所示.
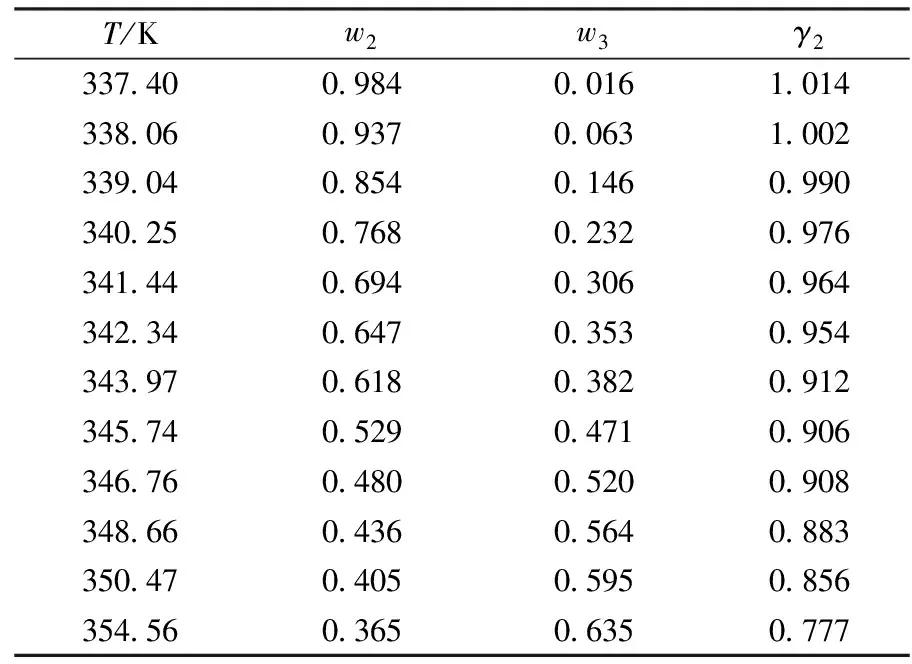
表2 101.3 kPa下[HEMA][OAC](3)+甲醇(2)的二元汽液相平衡数据

表3 101.3 kPa下[HEMA][OAC](3)+丙酮(1)的二元汽液相平衡数据

表4 101.3 kPa下[EMIM][OAC](3)+甲醇(2)的二元汽液相平衡数据

表5 101.3 kPa下[EMIM][OAC](3)+丙酮(1)的二元汽液相平衡数据
表2~表5中:w1,w2,w3分别表示液相中丙酮、甲醇、离子液体的质量分数;γ表示组分的活度系数.活度系数由公式

(1)
计算.由于该实验在常压下进行,将气相近似看成是理想气体,则公式(1)可简化为:

(2)

(3)
计算而得.丙酮,甲醇的安托因参数见表6.

表6 纯物质的安托因参数
注:a参数来自 Aspen Plus数据库
由拉乌尔定律可知,活度系数的大小代表实际物系偏离理想物系的程度.从表6可知:不同离子液体与丙酮、甲醇形成的混合物其偏离理想物系的程度不同.对于离子液体-丙酮体系,离子液体对丙酮的气化有促进作用.活度系数越大,即说明离子液体使得丙酮更易挥发.对于离子液体-甲醇体系,离子液体与甲醇分子以吸引力为主,将甲醇分子进行“捆绑”使其抑制在液相中难以挥发,活度系数越小,“捆绑”的强度越大.
2.2 相平衡计算
非随机双液相(NRTL)活度系数模型是由Renon和Prausnitz[14]在1968年提出;Wilson模型由Wilson[15]在1964年提出.二元物系的NRTL方程和Wilson方程如下所示.
NRTL方程:



(4)
其中:τ12(g12-g22)/RT,G12=exp(-α12τ12),τ21=(g21-g11)/RT,G21=exp(-α12τ21).
Wilson方程:
lnγ1=-ln(x1+Λ12x2)+

(5)
lnγ2=-ln(x2+Λ21x1)-
中国一些互联网公司也遵循这样的定律,有些年轻企业家几年就把公司做到几十亿美金,但是上市两年后估值还能维持不跌的就已经是少数了,再过三四年市值还能增长突破到百亿美金以上的几乎就是绝无仅有。我对未来有信心,我对今天就会越来越有信心,这就是58到家的哲学观。在湖畔大学上课的时候,很多同学的公司按市值比较都比58到家成功一个量级,但我们往往会讨论一个观点,你能保证5年后比今年更牛吗?58到家可以回答这个问题,5年后一定比现在更强大。


γ1和γ2由(3)式的拉乌尔定律简化式计算可得.关联结果,如图2~图5所示.在图2~图5中,x3为丙酮、甲醇在液相中的摩尔分数.由图2~图5可知:NRTL模型和Wilson模型对于两种离子液体都有较好的拟合效果.但在有机物的高浓度范围内,NRTL模型的拟合效果更好.这说明Wilson模型难以准确地描述具有混合间隙特征的离子液体体系.综上可以明显看出,NRTL模型更加适合关联含离子液体体系的二元及三元汽液相平衡数据.

图2 丙酮+[HEMA][OAC]二元体系的x3-γ1图

图3 甲醇+[HEMA][OAC]二元体系的x3-γ2图

图4 丙酮+[EMIM][OAC]二元体系的x3-γ1图

图5 甲醇+[EMIM][OAC]二元体系的x3-γ2图
采用的目标函数,对研究中的体系在不同温度下的汽液平衡数据进行迭代和回归,得表7与表8所示的离子液体与丙酮、甲醇在NRTL模型和Wilson模型中的模型参数.


表7 NRTL模型中组分之间的二元能量交互参数
注:a参数来自参考文献[8]

表8 Wilson模型中的模型参数
2.3 误差分析
由图2~图5 的结果及理论分析,大致可知:由于二元体系的组成及离子液体浓度的不同,NRTL与Wilson活度系数模型的拟合效果不尽相同.为了定量的评价两种离子液体的拟合效果,利用已迭代出的模型参数,由公式

计算出各自的平均相对误差,结果如表9所示.
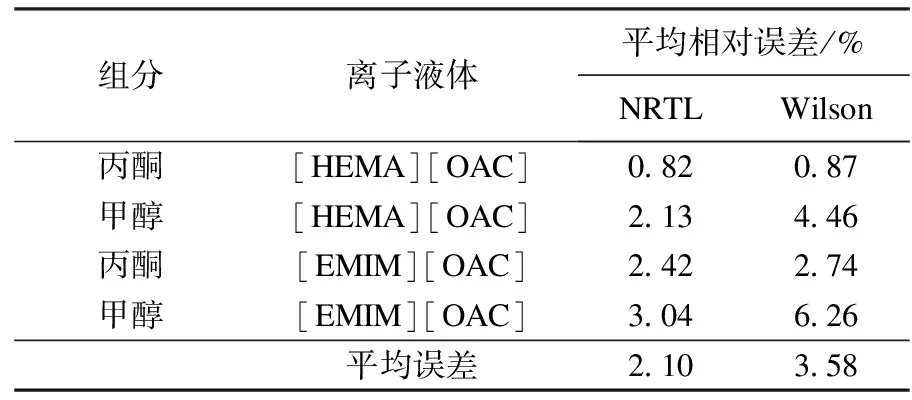
表9 NRTL与Wilson的回归平均相对误差比较
表9列出了含离子液体体系的活度系数实验值与不同活度系数模型拟合值得平均相对误差.对于[HEMA][OAC]+丙酮体系而言,NRTL模型和Wilson模型的误差最小,而含甲醇体系的误差均较大,Wilson模型几乎是NRTL模型的两倍.说明NRTL模型更合适于含离子液体的二元体系相平衡研究.
3 结 论
实验测定了101.3 kPa下甲醇(1)+丙酮(2)+[HEMA][OAC]与[EMIM][OAC]的二元相平衡数据.并通过NRTL模型和Wilson模型与实验数据进行了关联,结果表明,实验值与NRTL模型计算值的误差比Wilson模型更小.因此,将离子液体看作中性分子的电解质或非电解质NRTL模型更合适用于含离子液体体系的相平衡研究.同时回归迭代出来的能量交互参数也为离子液体作为萃取剂用于分离工程提供了一定的理论基础.
符号说明:
x——液相
y——汽相
Δg——NRTL方程交互作用参数,J·mol-1
T——平衡温度/K
Λ——Wilson模型参数
上角标
exptl——实验值
calcdl——计算值
下角标
i,j——组分变量
1——丙酮
2——甲醇
3——离子液体
[1] HIAK T,KURIHARA K,KOJIMA K.Vapor-liquid Equilibria for Acetone+Chloroform+Methanol and Constituent Binary Systems at 101.3 kPa[J].J.Chem.Eng.Data,1994,39(4):714-719.
[2] COOK R A,FVRTER W F.Extractive Distillation Employing a Dissolved Salt as Separating Agent[J].Can J Chem.Eng,1968,46(2):119-123.
[4] HARRIS R A,RAMJUGERNATH D,LETCHER T M,et al.Monoethanolamine as an Extractive Solvent for then-Hexane+Benzene,Cyclohexane+Ethanol,and Acetone+Methanol Binary Systems[J].J.Chem.Eng.Data,2002,47(4):781-787.
[5] ORGE B,IGLESIS M,DOMINGUEZ A,et al.Vapor-liquid Equilibria for the Ternary System Acetone+Methanol+Chlorobenzene at 101.325 kPa[J].J.Chem.Eng.Data,1995,40(6):1203-1205.
[6] 邓友全.离子液体:性质、制备与应用[M].北京:中国石化出版社,2006:4-8.
[7] 李汝雄.绿色溶剂:离子液体的合成与应用[M].北京:化学工业出版社,2005:20-27.
[8] MATSUDA H,LIEDERT V,TOCHIGI K,et al.Influence of Sulfate-based Anion Ionic Liquids on the Separation Factor of the Binary Azeotropic System Acetone+Methanol[J].Fluid Phase Equilib ria,2013,340:27-30.
[9] ORCHILLES A V,MIGUEL P J,VERCHER E,et al.Ionic Liquids as Entrainers in Extractive Distillation: Isobaric Vapor-liquid Equilibria for Acetone+Methanol+1-Ethyl-3-methylimidazolium Trifluoromethanesulfonate[J].J.Chem.Eng.Data,2007,52(1):141-147.
[10] ORCHILLES A V,MIGUEL P J,LLOPIS F J,et al.Influence of Some Ionic Liquids Containing the Trifluoromethanesulfonate Anion on the Vapor Liquid Equilibria of the Acetone+Methanol System[J].J.Chem.Eng.Data,2011,56(12):4430-4435.
[11] ORCHILLES A V,MIGUEL P J,GONZALEZ-ALFARO V,et al.1-Ethyl-3-methylimidazolium Dicyanamide as a Very Efficient Entrainer for the Extractive Distillation of the Acetone+Methanol System[J].J.Chem.Eng.Data,2012,57(2):394-399.
[12] 王皓,陆康,彭璇.基于Wilson、UNIQUAC和NRTL活度系数模型的离子液体体系的相平衡比较[J].北京化工大学学报(自然科学版),2013,40(1):10-15.
[13] HUNSMANN W.Verdampfungsgleichgewicht von Ameisensäure/Essigsäure-und von Tetrachlorkohlenstoff/Perchloräthylen-gemischen[J].Chem.Ing.Tech.,1967,39(19):1142-1145.
[14] RENON H,PRAUSNITZ J M.Local Compositions in Thermodynamic Excess Functions for Liquid Mixtures[J].AIChE Journal,1968,14(1):135-144.
[15] WILSON G M.Vapor-liquid Equilibrium.Ⅺ.A New Expression for the Excess Free Energy of Mixing[J].J.Am.Chem.Soc.,1964,86(2):127-130.
