不同厂家瑞舒伐他汀钙片溶出度比较
2016-01-12侯娟,徐琪琳,张瑞杰
不同厂家瑞舒伐他汀钙片溶出度比较
侯娟徐琪琳张瑞杰
项目来源:河北省医学科学研究重点课题(编号:20110124)
作者单位: 050011石家庄市,河北医科大学第四医院(侯娟); 河北医科大学药学院2013届本科生(徐琪琳);河北省秦皇岛市妇幼保健院(张瑞杰)
【摘要】目的测定不同厂家瑞舒伐他汀钙片的溶出度,对其进行质量评价,为临床选药提供依据。方法采用《中国药典》2010年版中规定的篮法测定溶出度,紫外分光光度法测定溶液吸光度,计算各厂家的累积溶出百分率并对各厂家的溶出度进行比较。结果5个厂家的瑞舒伐他汀钙片均能在规定的时间溶出完全,但溶出曲线稍有差异。结论各厂家的瑞舒伐他汀钙片溶出度均符合药典规定,国内与国外制剂基本一致,质量可靠。
【关键词】瑞舒伐他汀钙;紫外分光光度法;溶出度
doi:10.3969/j.issn.1002-7386.2015.20.051
【中图分类号】R 917
收稿日期:(2015-05-18)
原研药与仿制药的质量存在较大差异[1], 2013年国家食品药品监督管理总局首次通知对国内75个仿制药品种开展与原研药品质量一致性评价,以提升中国仿制药的水平。计划到2020年,全面完成基本药物的质量一致性审查。仿制药的质量一致性评价包括三方面:体外药学参数、体内生物利用度及临床疗效[2]。口服固体制剂的体外药学参数主要指溶出度,如仿制药体外多条溶出曲线均与原研药一致,可基本判定两者内在品质一致,体内生物利用度一致、临床疗效也基本一致[2],可见溶出度是体现仿制药质量的重要因素。瑞舒伐他汀钙是新一代HMG-COA还原酶抑制剂,较其他他汀类药物有更强的调脂效果,并能逆转动脉粥样硬化的进程,促使斑块消退,减少心血管事件发生率和死亡率,被医药界誉为“超级他汀”,临床应用广泛。瑞舒伐他汀钙片(可定)由阿斯利康公司研发,2011年底进入中国,目前在国内上市的瑞舒伐他汀钙仿制药品有六个厂家。对于不同厂家药品质量一致性的比较研究未见相关报道。本文收集到五个厂家的瑞舒伐他汀钙片,其中包括原研药,希望通过体外溶出行为的比较,客观反映片剂质量,特别是国产药与进口药是否存在差异,为临床选药提供依据。
1仪器与试药
1.2试药瑞舒伐他汀钙对照品(中国药品生物制品检定所,批号:101028-201001,规格:100 mg),瑞舒伐他汀钙原料药(南京正大天晴制药有限公司),瑞舒伐他汀钙片(厂家A:批号:120301,规格:5 mg;厂家B:批号:100901,规格:5 mg;厂家C:批号:1111051,规格:10 mg;厂家D:批号:111003 规格:10 mg;厂家E:批号:115449 规格:10 mg),交联聚维酮(北京风礼商贸有限责任公司),硬脂酸镁(天津市永昌盛化工有限公司),乳糖(天津市化学试剂一厂),甘露醇(北京索莱宝科技有限公司),盐酸(天津市风船化学试剂科技有限公司),醋酸钠(天津博迪化工股份有限公司),冰醋酸(石家庄市有机化工厂),磷酸二氢钾(天津博迪化工股份有限公司),氢氧化钠(天津市化学试剂一厂),其余试药略。
1.3方法[3,4]
1.3.1紫外检测波长的确定:精密称取150 mg瑞舒伐他汀钙原料药至50 ml量瓶中,超声15 min,待溶解后加水稀释至刻度。再精密量取1 ml稀释液置于250 ml量瓶中,加水定容至刻度备用。另取处方量辅料适量至100 ml量瓶中,加水超声溶解后过0.45 μm微孔滤膜,取续滤液5 ml,置于50 ml容量瓶中加水至刻度,摇匀后得空白辅料溶液。将上述两种溶液分别在200~400 nm波长范围内进行光谱扫描。
1.3.2标准曲线的确立:精密称取瑞舒伐他汀钙对照品10 mg至100 ml量瓶中,加适量水超声溶解,以水定容至刻度,摇匀备用。精密量取备用液0.5 ml、1.0 ml、1.5 ml、2.0 ml、2.5 ml、3.0 ml,置于25 ml量瓶中,加水稀释至刻度。以241 nm为测定波长,采用紫外分光光度法测定上述溶液的吸光度。以浓度(C)对吸光度(A)做直线回归,绘制标准曲线。
1.3.3回收率试验:精密称取瑞舒伐他汀钙6 mg、10 mg、13 mg至100 ml量瓶中,补充相应处方量辅料,加适量水超声溶解后再稀释至刻度。精密量取稀释液1 ml 至10 ml量瓶中,以水定容至刻度后过滤,滤液于241 nm处测定吸光度,重复测定3次,计算回收率。
1.3.4精密度试验:将1.2.3项下制备的高、中、低3个浓度样品分别在1 d内(早、中、晚)重复测定3次吸光度,连续测定3 d,计算日内和日间精密度。
2011年11月,白玛群宗勇挑重责,把年幼的孩子送到父母身边,主动担负起驻村任务,在海拔4580米的小村庄,积极为驻村点谋发展、找出路,带动群众摆脱贫穷落后现状。这期间,她争取到资金150万元,为驻村点修建了道路桥梁,添置了村委会设备,并邀请医疗专家为群众进行免费义诊。
1.3.5溶液稳定性考察:称取瑞舒伐他汀钙10 mg至100 ml量瓶中,加适量水超声溶解,再以水稀释至刻度。量取稀释液5 ml,置于50 ml量瓶中,加水定容至刻度备用。平行配制12组溶液,分为避光组与不避光组进行实验,分别在0、1、2、3、4、8时测定吸光度。
1.3.6溶出介质的确定[5-8]:初步确定水、0.1 mol/L盐酸、pH值4.0醋酸盐缓冲液和pH值6.8磷酸盐缓冲液作为溶出介质,考察瑞舒伐他汀钙在四种溶液中的溶解性质。
1.3.7溶出度测定:按《中国药典》2010年版二部附录第一法(篮法)[9],对五个厂家的瑞舒伐他汀钙片进行体外溶出行为考察,分别在5 min、10 min、15 min、20 min、25 min、30 min时取样10 ml,同时补充等量等温新鲜介质。将所取样品(厂家规格为10 mg样品稀释1倍)经0.45 μm微孔滤膜过滤,取续滤液于241 nm 波长处测定吸光度,计算不同时间点的累积溶出百分率。
2结果
2.1紫外检测波长的确定光谱扫描结果显示瑞舒伐他汀钙在241 nm处有最大吸收,而辅料在此处吸收可忽略不计,对主药测定无影响,因此确定241 nm为测定波长。光谱扫描曲线见图1、2。
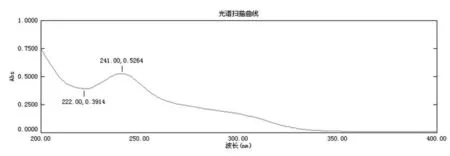
图1 瑞舒伐他汀钙光谱扫描曲线
图2 空白辅料光谱扫描曲线
2.2标准曲线的确立 将各浓度对照溶液以浓度(C)对吸光度(A)做直线回归,得回归方程A=0.038C-0.002,r = 0.9998。线性范围2.22 ~ 13.32 μg/ml,线性关系良好。见图3。
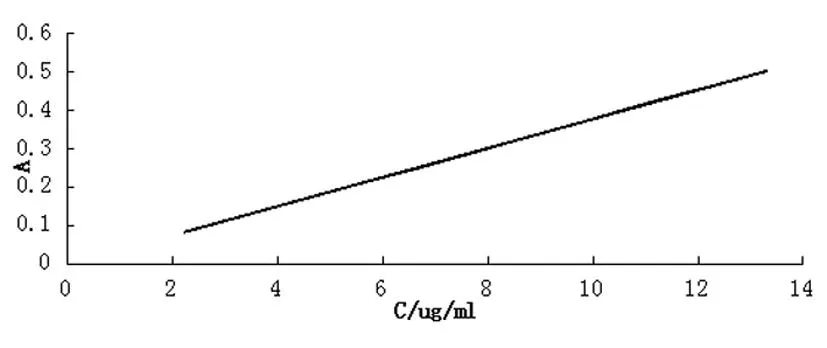
图3 瑞舒伐他汀钙对照溶液的标准曲线
2.3回收率试验经计算,高、中、低浓度的回收率及RSD均符合要求。见表1。
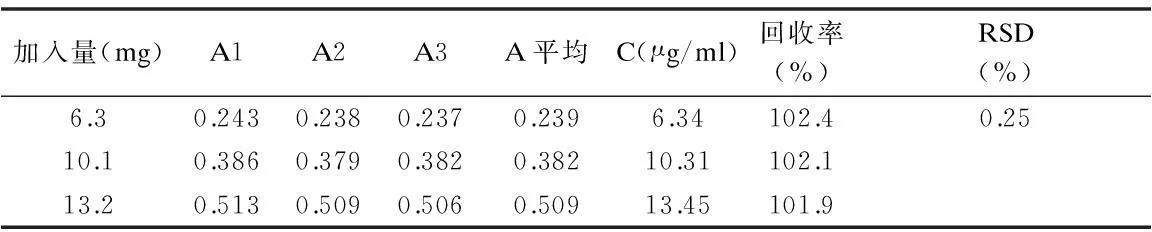
表1 不同浓度瑞舒伐他汀钙的回收率
2.4精密度试验经计算,低、中、高三种浓度的日内精密度和日间精密度良好。见表2。
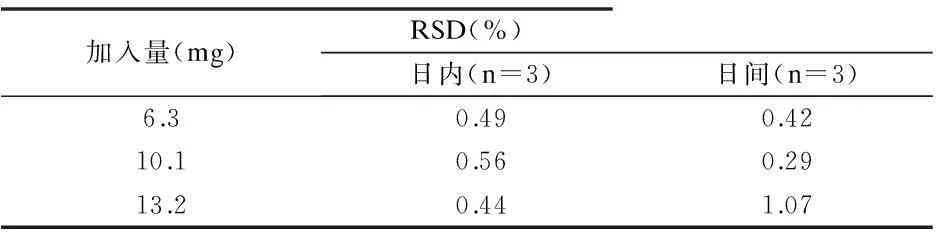
表2 不同浓度瑞舒伐他汀钙的精密度
2.5溶液稳定性考察实验发现避光与不避光对于瑞舒伐他汀钙溶液的吸光度值差异不大,避光组吸光度值的RSD为0.45%(n=6),不避光组吸光度值的RSD为0.34%(n=6)。提示瑞舒伐他汀钙溶液在避光或不避光环境8h内均稳定性良好,光照对瑞舒伐他汀钙的稳定性无影响。
2.6溶出介质的确定实验显示,在0.1 mol/L盐酸溶液、pH值4.0醋酸盐缓冲液和pH值6.8磷酸盐缓冲液中,瑞舒伐他汀钙粉末难以溶解,而且在0.1 mol/L盐酸溶液和pH值4.0醋酸盐缓冲液中聚集成一球团,无法作为溶出介质进行实验,因此确定水为瑞舒伐他汀钙片的溶出介质。
2.7溶出度测定采用《中国药典》2010年版二部附录第一法(篮法),以1 000 ml水作为溶出介质,转速为100 r/min,溶出温度为37℃。检测方法为紫外分光光度法,检测波长为241 nm。见表3、图4。
表3 不同厂家瑞舒伐他汀钙片体外溶出行为比较 n=6,%, ±s
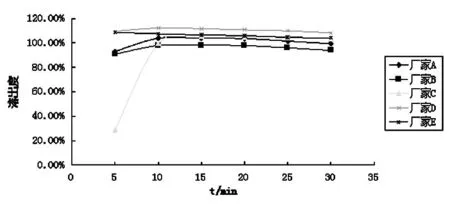
图4 各厂家瑞舒伐他汀钙片溶出曲线图
3讨论
溶出度是模拟药品在胃肠中溶出过程的体外检测法。虽然不能完全反映药品在体内的真实溶解吸收过程,但由于具有一定相关性,而且方法简便可行,仍是常用的一种质量控制测定方法。通过比较不同厂家同种药品的溶出行为可以在一定程度上反映药品质量差异。
本研究选取上市瑞舒伐他汀钙片五个厂家(A、B、C、D为国产厂家,E为进口厂家)进行溶出度考察。从溶出曲线可看到,各厂家片剂的溶出速率均较快。其中厂家D、E片剂5 min累积溶出即达98%以上,厂家A、B也在90%以上。虽然厂家C片剂5 min时累积溶出较其他四种产品低,但10 min后各厂家片剂累积溶出都达95%以上,溶出行为良好。中国药典(2010年版)规定片剂或硬胶囊制剂在45 min内的溶出度应大于70%,从以上结果可以看到,五个厂家瑞舒伐他汀钙片溶出度均符合药典规定,特别是厂家D与进口原研药有着同样快速的溶出效果,其他厂家的药品虽略逊一筹,但同样快速溶出,国内与国外制剂在溶出度方面具有质量一致性。
在所查阅的文献中,有资料表明瑞舒伐他汀钙对光不稳定,易分解[6,8],然而在本课题研究过程中,由稳定性试验结果表明瑞舒伐他汀钙在避光与不避光情况下吸光度几无差异。光照对瑞舒伐他汀钙的稳定性影响不大。
多条溶出曲线是指在不同溶出介质下同一药品的溶出曲线,能够客观反映原研药与仿制药,仿制药与仿制药,甚至不同批次间药品溶出行为的一致性。多种溶出介质下的溶出曲线比较能够较好地反映药物体内疗效。本研究原计划在不同溶出介质中评价各厂家片剂的溶出行为,但由于瑞舒伐他汀钙在0.1 mol/L盐酸、pH值4.0醋酸盐缓冲液和pH值6.8磷酸盐缓冲液中溶解度差,并且在以0.1 mol/L HCL溶液和pH值4.0醋酸盐缓冲液、pH值6.8磷酸盐缓冲液为溶出介质做精密度试验时,随着时间的延长,高、中、低不同浓度的吸光度都随着时间的延长吸光度变化较大,提示瑞舒伐他汀钙在0.1 mol/L HCL溶液和pH值4.0醋酸盐缓冲液、pH值6.8磷酸盐缓冲液中不稳定。因此本研究仅选择水作为溶出介质,虽有一定的局限性,也能客观反映片剂质量。
参考文献
1许明哲,牛剑钊,陈华,等.浅谈仿制药质量一致性评价过程管理的原则及政策依托. 中国新药杂志,2013, 21:2475-2478.
2谢沐风.解读“口服固体制剂仿制药一致性评价技术手段——多条溶出曲线”. 中国医药工业杂志, 2013, 4:411-414.
3侯娟,王静,张妮妮,等.瑞舒伐他汀钙口腔崩解片的制备工艺优化. 中国药房,2013, 45:4270-4272.
4张瑞杰,王静,侯娟.瑞舒伐他汀钙口腔崩解片的制备及溶出度测定方法.河北医药,2015,37:1411-1413.
5孙俊. 瑞舒伐他汀钙片的含量及溶出度测定.中国药业,2010, 3:30-31.
6林兰,牛剑钊,许明哲,等.国外仿制药一致性评价比较分析.中国新药杂志,2013,21:2470-2473.
7沈淑媛,吴赟,王成港,等.复方美托洛尔-氨氯地平双层片体外释放度方法研究.中国医药导报,2012,27:118-120.
8吴定伟,陈洁. 不同厂家替米沙坦制剂的体外溶出度比较. 中国现代应用药学,2010,12:1116-1118.
9中华人民共和国国家药典委员会文编.中国药典.二部.北京:化学工业出版社,2010.附录85-87.
·护理研究·
