溶酶体膜蛋白Sidt2对血糖代谢的影响
2016-01-12王李卓,章尧,余翠等
溶酶体膜蛋白Sidt2对血糖代谢的影响
王李卓1,2,章尧1,2,余翠2,3,熊钱颖2,3,谭凤彪1,2,蒋雪2,陆晓华4,夏礼斌3,陆美琴3,陈月平3,张斌华3,凌烈峰1,高家林2,3
(1.皖南医学院生物化学教研室,安徽芜湖241002;2.皖南医学院活性生物大分子研究安徽省重点实验室,安徽芜湖241002;3.皖南医学院第一附属医院 弋矶山医院内分泌科,安徽芜湖241001;4.皖南医学院机能实验中心,安徽芜湖241002)
【摘要】目的:通过模式动物研究溶酶体膜蛋白Sidt2与糖代谢的关系。方法:利用LoxP-Flox-LoxP系统,通过基因重组及打靶技术获得Sidt2剔除小鼠模型。检测成年小鼠的空腹血糖及葡萄糖耐量,评估Sidt2基因剔除对小鼠糖代谢的影响。同时通过HE染色观察Sidt2-/-小鼠胰岛形态结构改变。结果:通过对Sidt2剔除模型小鼠的Sidt2 mRNA及蛋白水平鉴定,确定Sidt2基因剔除小鼠模型成功构建。对小鼠末梢血糖检测发现,Sidt2-/-成年小鼠表现出空腹血糖增高及糖耐量受损的糖尿病表现。对Sidt2-/-小鼠胰岛形态检测发现,其胰岛出现结构紊乱,胰岛空泡变性及部分细胞出现肥大等病理改变。结论:溶酶体膜蛋白Sidt2与糖代谢密切相关。
【关键词】溶酶体膜蛋白;Sidt2;糖代谢;糖尿病
【文献标识码】【中图号】R 587.1A
DOI【】10.3969/j.issn.1002-0217.2015.06.002
文章编号:1002-0217(2015)06-0522-04
基金项目:安徽省高等学校自然科学研究
收稿日期:2015-07-03
作者简介:刘磊(1978-),男,副主任医师,硕士,(电话)13625528388,(电子信箱)bbmcll@163.com;
通讯作者杨丽娟,女,讲师,硕士,(电子信箱)@163.com,.
Effects of lysosomal membrane proteins Sidt2 on glucose metabolismWANGLizhuo,ZHANGYao,YUCui,XIONGQianyin,TANFengbiao,JIANGXue,LUXiaohua,XIALibin,LUMeiqin,CHENYueping,ZHANGBinhua,LINGLiefeng,GAOJialin
Department of Biochemistry,Wannan Medical College,Wuhu 241002,China
Abstract【】Objective:To discover the relationship between lysosome membrane protein Sidt2 and glucose metabolism through model animal.Methods:Sidt2 knockout mouse models were obtained by using LoxP-Flox-LoxP system,which based on the technologies of genetic recombination and gene targeting.By Fasting glucose and glucose tolerance test,the effects of Sidt2 deficiency on glucose metabolism were observed in Sidt2-/- mice.Furtherly,we analyzed the morphology change in Sidt2-/- mice islets,by hematoxylineosin staining.Results:Sidt2 knockout mice were produced successfully and verified by the analyzing the mRNA and protein expression of Sidt2.By peripheral blood glucose detecting,adult Sidt2-/- mice showed increased fasting glucose and impaired glucose tolerance.The pathology changes including disorder structure itself,islet cavity change and hypertrophic islet cells were also shown in Sidt2-/- deficiency mice at 12 months age,whereas the cotemporary controls showed normal islets.Conclusion:Lysosomal membrane protein Sidt2 is closely related to the glucose metabolism.
【Key words】 lysosome membrane proteins;Sidt2;glucose metabolism;diabetes mellitus
传统观点一直认为溶酶体只是细胞的垃圾处理厂,参与细胞对老旧物质的消化和处理,并将处理后产物重新输出,为细胞新陈代谢所用[1- 2]。后来随着对溶酶体认识的深入,我们发现溶酶体的作用远不止如此,其还参与细胞的信号转导,参与细胞外膜的修复,参与凋亡、自噬的调控[3]。但对于溶酶体与糖尿病及胰岛β细胞的关系,一直少有人研究。Sidt2(SID1 transmembrane family,member 2)是我们前期新发现的溶酶体膜蛋白[4],对其功能一直不清楚[5]。通过模式动物模型的建立,可以很好地去研究某个蛋白质或基因的功能。本研究我们通过条件性基因剔除技术,建立了Sidt2基因剔除小鼠模型,并发现作为溶酶体膜蛋白,Sidt2与血糖代谢密切相关。
1材料与方法
1.1实验动物实验所用129Sv小鼠购自上海斯莱德动物中心;Cre小鼠购自南京大学模式动物研究所。所有动物实验均得到皖南医学院弋矶山医院动物伦理委员会的批准。
1.2Sidt2剔除小鼠模型制备小鼠Sidt2基因由小鼠基因文库得到。其背景资料如下:Sidt2 Ensembl Gene ID:ENSMUSG00000034908,http://www.ensembl.org/index.html。利用pBR322质粒构建Sidt2-ABRLFn-pBR322打靶载体。打靶载体融合进可被Cre酶识别的LoxP-Flox-LoxP系统(Flox区为Sidt2基因2号外显子),经酶切分析和测序正确无误后,将Not Ⅰ线性化的载体电转化入小鼠胚胎干细胞(ES,CJ17)。挑选经G418和Ganciclivor筛选的阳性克隆并经鉴定后,通过囊胚腔显微注射操作制备嵌合体小鼠(由上海南方模式动物中心协助完成)。嵌合雄鼠通过进一步繁育得到杂合子小鼠,并通过与Cre小鼠交配可得到Sidt2基因2号外显子缺失的杂合Sidt2-/+小鼠,子代进一步繁育可得Sidt2-/-纯合子小鼠,用于后续实验,鉴定至少用到2对引物。
1.3RNA和蛋白水平检测Sidt2基因mRNA水平检测,通过RT-PCR(逆转录PCR)检测,方法参见文献[4]。引物序列:上游引物,5′-ATGTGGTGGTGGTAGTGAAG-3′;下游引物,5′-AGATACACCACCACCATCAC- 3′,退火温度56°。Sidt2蛋白水平检测,利用特异性抗Sidt2的多克隆抗体(Abcam)进行western blotting免疫印迹检测,方法参见文献[4]。
1.4胰岛HE染色 采用病理学常规石蜡切片,同龄同窝出生野生小鼠为对照,染色方法参照常规HE染色步骤,具体参见文献[6]。
1.5小鼠末梢血糖监测及葡萄糖耐量实验空腹血糖检测:小鼠第1晚10点后禁食,第2天上午8点,采用美国强生(稳豪型)血糖仪检测小鼠鼠尾末梢血糖。空腹时间参照前述。IPGTT(经腹注射的葡萄糖耐量实验)在小鼠空腹10~12 h时进行,按1.5 g/kg,根据体质量给予腹腔注射葡萄糖,并分别在注射后0 min、30 min、60及120 min时间段检测鼠尾末梢血糖。
1.6统计学分析所有计量资料用均数±标准差表示。各组不同时点比较采用F检验,两组间同一时点数据比较采用t检验。P<0.05表示统计学有差异。
2结果
2.1Sidt2基因剔除小鼠模型构建小鼠Sidt2基因(Ensembl Gene ID:ENSMUSG00000034908),定位于染色体9A5.2区带,在哺乳动物中高度保守,有26个外显子,分别编码853,832个氨基酸残基的多重跨膜蛋白质,其中2号外显子为两种可变剪切所共有。所以本模型以2号外显子为剔除对象,利用同源重组及基因打靶技术,在2号外显子两端插入可被Cre酶特异性识别的LoxP序列图(图1A),得到杂合子后,利用Sidt2Flox/-小鼠与Cre小鼠交配,得到2号外显子缺失的Sidt2-/+杂合子小鼠,杂合子小鼠之间雌雄相互交配可得到Sidt2-/-纯合子剔除小鼠。当2号外显子缺失后,会造成移码突变而阻止Sidt2蛋白的翻译,达到基因敲除的目的。本研究通过前面的技术成功构建了Sidt2Flox/-模型小鼠(图1B),并进一步通过Cre酶作用得到了Sidt2-/+小鼠(图1B),在此基础上进一步利用Sidt2-/+小鼠互交得到子代Sidt2-/-小鼠(图1C)。经RNA(图1D)和蛋白质(图1E)水平验证,Sidt2基因剔除小鼠模型成功建立。

A.打靶载体构建策略;B.Sidt2Flox/- 及Sidt2+/-尾基因型鉴定;
C.纯合子Sidt2-/-小鼠尾基因鉴定;D.RNA水平验证;E.蛋白质水平验证
图1Sidt2基因剔除小鼠模型建立及鉴定
Fig 1Generation and verification of Sidt2 conditional knockout mice
2.2Sidt2剔除后对小鼠糖代谢的影响Sidt2基因剔除小鼠获得后,我们进行了一系列的表型分析,结果发现Sidt2剔除小鼠的一个重要特点是对糖代谢的影响。我们通过末梢血糖检测,发现在3月龄左右成年小鼠表现出明显的空腹血糖增高和葡萄糖耐量减低,在雄性Sidt2-/-小鼠,其空腹血糖为(6.06±0.93)mmol/L,而对照组Sidt2+/+小鼠为(4.90±0.48)mmol/L,差异具有统计学意义(t=-3.023,P<0.05),见图2。同样通过经腹腔注射葡萄糖负荷实验检测表明,在雄性Sidt2-/-小鼠糖负荷后0 min、30 min、60及120 min 血糖分别为(5.82±1.0) mmol/L、(16.9±3.13) mmol/L、(13.2±2.27) mmol/L及(9.8±1.32) mmol/L(F=35.75,P<0.001),较对照的Sidt2+/+小鼠组的(4.68±0.76) mmol/L、(12.1±2.28) mmol/L、(9.0±1.47)mmol/L及(6.3±1.38) mmol/L(F=30.96,P<0.001)血糖水平均明显增高,差异具有统计学意义(P<0.05,或P<0.01),见表1。
表1两组小鼠IPGTT糖负荷结果比较(mmol/L,n=7)
Tab 1The analysis of IPGTT in Sidt2-/- and Sidt2+/+ mice(mmol/L,n=7)

组别0min30min60min120minF值P值实验组5.82±1.016.9±3.1313.2±2.279.8±1.3235.750.000对照组4.68±0.7612.1±2.289.0±1.476.3±1.3830.960.000t值2.403.274.104.90P值0.0340.0070.0010.000
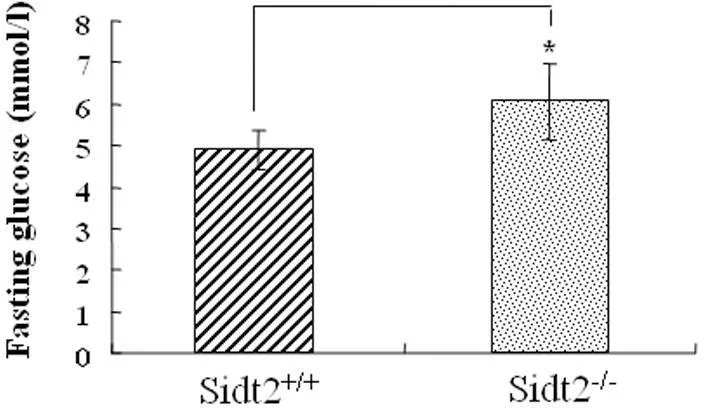
与sidt2+/+比较,*P<0.05,**P<0.01,n=7
图2Sidt2剔除小鼠的空腹末梢血糖分析(3月龄小鼠)
Fig 2The analysis of fasting peripheral blood glucose in Sidt2 deficiency mice(three months age)
2.3Sidt2基因剔除后胰岛形态变化Sidt2基因剔除后,是否会对小鼠胰岛形态产生影响。为此我们从2月龄开始分别检测了不同年龄Sidt2-/-小鼠胰岛的形态变化,有趣的是,在早期3~6月龄Sidt2-/-小鼠,胰岛形态主要表现出肥大(结果另文待发表),而对更年长的12月龄以上的小鼠胰岛观察,结果发现Sidt2-/-小鼠胰岛表现出形状欠规则,结构紊乱。在Sidt2-/-小鼠胰岛,可见外分泌腺向胰岛内入侵增加,胰岛细胞排列紊乱,透明变性增加(三角箭头示,图3B-1),并可见肥大的细胞(图3A-1,箭头示),具体见图3A-1、3B-1。而野生同龄对照组小鼠则未发现上述改变(图3A-2、3B-2)。
3讨论
随着社会经济的发展,糖尿病的发病率正逐年提高,据世界卫生组织不完全统计,截止到2013年,全球已确诊糖尿病人数超过3亿人[7],糖尿病已成为仅次于肿瘤、心脑血管疾病之后,严重威胁人类健康的第三大类疾病。目前对糖尿病的治疗,仍停留在控制血糖,控制症状的三级治疗水平[8],而且治疗效果有时并不理想。因此如果想在糖尿病的治疗领域有所突破,必须要深入了解糖尿病发病机制,从而有可能为我们对糖尿病提出更为有效精准的分型,以利于我们的精准化、个体化治疗,提高糖尿病的综合治疗效果。

A.小鼠胰岛HE染色(1为Sidt2-/-小鼠,2为 Sidt2+/+小鼠,×200);B.为局部放大的图片(× 400)
图3小鼠胰岛形态学检测
Fig 3Morphological detection of mice islet
可喜的是,目前对糖尿病发病机制的研究已经取得了一定的进展,其机制的研究已经深入到分子和基因水平。现在,对部分类型糖尿病的发病机制已经较为清楚,比如线粒体基因突变糖尿病[9-10],成人发病型糖尿病(maturity onset diabetes in young,MODY)[11],但是对于2型糖尿病和1型糖尿病,其发病机制仍未弄清。目前认为胰岛素抵抗和胰岛素受体及受体后效应的缺陷可能是2型糖尿病的发病主因。而受体前的研究却较少引人关注,这部分其实包含了一个广阔的信号链,如胰岛素的合成,胰岛素分泌颗粒(分泌小泡)的包装,分泌小泡与膜的融合,胞吐等环节,上述环节的变化也会直接影响到胰岛素分泌并导致血糖代谢紊乱。此外胰岛细胞自身的凋亡、自噬也开始引起学界的关注,但仍缺乏系统性的阐述。
溶酶体作为细胞的亚细胞器,对细胞的代谢尤为重要。传统的观念认为,溶酶体只是细胞处理废弃物的一个垃圾场,对其作用的重要性有所忽略[1]。其实越来越多的研究表明溶酶体不仅参与细胞代谢废物的处置,也参与到细胞的信号转导、膜的修复以及参与物质的交换。同样,溶酶体在糖尿病中的作用,以及在胰岛β细胞功能中的作用也一直被忽视。在形态上,溶酶体与胰岛分泌小泡(胰岛素分泌颗粒)有着极高的相似性,比如他们都是单层膜包绕,都需要酸性的pH值环境才能发挥作用。在发生上,两者也都是从内质网出膜形成,更为重要的是,它们都在细胞内参与了物质的运输。而在糖尿病的发病机制研究中,溶酶体与胰岛素分泌小泡的这种相似性却很少引起关注,溶酶体及溶酶体相关膜蛋白与糖尿病的关系也被学界长期忽视。事实上,已有研究表明,有溶酶体相关蛋白的功能障碍会导致小鼠出现糖尿病[12-13],这无疑提醒了我们这两者之间可能存在的特殊关系。
Sidt2是我们前期新发现的溶酶体膜蛋白,但对于其功能一直不清楚[4]。本研究中,基于条件性基因剔除技术[14-15],我们通过基因打靶及同源重组获得了Sidt2Flox/-小鼠,并通过与Cre小鼠繁育得到了Sidt2+/-杂合子小鼠,进一步通过子代繁育出Sidt2-/-小鼠模型,并通过基因及蛋白质水平验证表明Sidt2剔除模型成功建立。利用该模式小鼠,我们发现Sidt2对血糖代谢尤为重要,在成年Sidt2-/-小鼠(3月龄左右),其血糖代谢明显受到影响,其空腹血糖及糖负荷后血糖较同龄对照组小鼠明显增高(图2、表1)。形态影响功能,既然Sidt2-/-小鼠糖代谢表现出异常,那么其胰岛是否有形态学的变化呢,我们对此也做了观察,在早期3~6月龄,剔除小鼠胰岛表现出肥大(结果另文待发表),而在12月龄以后,则表现出胰岛细胞的排列紊乱,空泡变性增多,以及部分肥大的胰岛细胞(图3),这也正好解释了Sidt2-/-小鼠血糖升高的原因。因此,通过本研究,我们可以看出作为一个新发现的溶酶体膜蛋白,Sidt2与糖代谢密切相关。而溶酶体及相关膜蛋白与糖尿病及胰岛细胞的关系更需要我们进一步深入发掘,这将为我们对糖尿病的发病机制研究增加新的内容和活力,有利于从发病机制对糖尿病进行精准的分型并指导治疗。
【参考文献】
[1]Saftig P,Klumperman J.Lysosome biogenesis and lysosomal membrane proteins:trafficking meets function [J].Nature reviews Molecular cell biology,2009,10:623-635.
[2]Gao J,Xia L,Lu M,etal.TM7SF1 (GPR137B):a novel lysosome integral membrane protein [J].Molecular biology reports,2012,39:8883-8889.
[3]Alves S,Cormier-Dequaire F,Marinello M,etal.The autophagy/lysosome pathway is impaired in SCA7 patients and SCA7 knock-in mice [J].Acta neuropathologica,2014,128:705-722.
[4]Jialin G,Xuefan G,Huiwen Z.SID1 transmembrane family,member 2 (Sidt2):a novel lysosomal membrane protein [J].Biochemical and biophysical research communications,2010,402:588-594.
[5]Ren R,Xu X,Lin T,etal.Cloning,characterization,and biological function analysis of the SidT2 gene from Siniperca chuatsi [J].Developmental and comparative immunology,2011,35:692-701.
[6]Bordone L,Motta MC,Picard F,etal.Sirt1 regulates insulin secretion by repressing UCP2 in pancreatic beta cells [J].PLoS biology,2006,4:e31.
[7]Gao J,Xiong Q,Miao J,etal.Analysis of alternatives for insulinizing patients to achieve glycemic control and avoid accompanying risks of hypoglycemia [J].Biomedical reports,2015,3:284-288.
[8]高家林,夏礼斌,王李卓,等.皖南地区2 型糖尿病住院患者微血管病变及其相关危险因素分析[J].皖南医学院学报,2014,34(1):27-31.
[9]Frederiksen AL,Kyvik KO,Andersen PH.Mitochondrial diabetes with a focus on maternally inherited diabetes and deafness [J].Ugeskrift for laeger,2004,166:2785-2788.
[10] Tabebi M,Mkaouar-Rebai E,Mnif M,etal.A novel mutation MT-COIII m.9267G>C and MT-COI m.5913G>A mutation in mitochondrial genes in a Tunisian family with maternally inherited diabetes and deafness (MIDD) associated with severe nephropathy [J].Biochemical and biophysical research communications,2015,459:353-360.
[11] Tattersall R.Maturity-onset diabetes of the young:a clinical history [J].Diabetic medicine,1998,15:11-14.
[12] Waters PJ,Flynn MD,Corrall RJ,etal.Increases in plasma lysosomal enzymes in type 1 (insulin-dependent) diabetes mellitus:relationship to diabetic complications and glycaemic control [J].Diabetologia,1992,35:991-995.
[13] Salehi A,Henningsson R,Mosen H,etal.Dysfunction of the islet lysosomal system conveys impairment of glucose-induced insulin release in the diabetic GK rat [J].Endocrinology,1999,140:3045-3053.
[14] Zheng B,Sage M,Sheppeard EA,etal.Engineering mouse chromosomes with Cre-loxP:range,efficiency,and somatic applications [J].Molecular and cellular biology,2000,20:648-655.
[15] Kos CH.Cre/loxP system for generating tissue-specific knockout mouse models [J].Nutrition reviews,2004,62:243-246.
·基础医学·
