CXCR4在乳腺癌组织芯片中的表达及其临床意义
2016-01-12张杨王成昆彭波朱欢张志杰
张杨 王成昆 +彭波 朱欢 张志杰
[摘要] 目的 检测趋化因子受体4(CXC chemokinereceptortype4,CXCR4)在各种乳腺癌组织及相应正常乳腺组织中的表达并分析其临床病理意义。 方法 组织芯片中标本收集于2010年5月—2014年9月,应用免疫组化法检测组织芯片中204例乳腺癌组织和36例正常乳腺组织CXCR4蛋白的表达,以棕色颗粒为阳性标准计算染色强度和阳性细胞占总细胞数的百分比进行半定量处理。结果 CXCR4蛋白主要表达于细胞膜和细胞浆,在相应正常乳腺组织、小叶原位癌、导管内原位癌和浸润性导管癌中的阳性表达率依次升高,分别为8.3%(3/36)、25.0%(1/4)、10.0%(5/50)、72.0%(108/150),4组间差异有统计学意义(P<0.001);在I、II和III级以上分级的乳腺癌组织中,CXCR4蛋白的阳性表达率分别为18.2%(2/11)、80.4%(78/97)、69.8%(30/43),3组间差异有统计学意义(P<0.001);CXCR4蛋白在有转移的肿瘤组织和无转移的乳腺癌组织中的阳性率分别为88.4%(61/69)和11.1%(15/135)。结论 CXCR4在部分乳腺癌组织中高表达,且与乳腺癌组织类型及乳腺癌组织侵袭转移能力密切相关。
[关键词] CXCR4;乳腺癌;组织芯片;免疫组织化学法
[中图分类号] R5 [文献标识码] A [文章编号] 1674-0742(2015)11(c)-0014-03
[Abstract] Objective To detect the expression of CXC chemokine receptor 4 (CXCR4) in various breast cancer tissues and normal breast tissues and analyze its clinical pathological significance. Methods Immunohistochemistry was used to detect the expression of CXCR4 protein in 204 cases of breast cancer tissues and 36 cases of normal breast tissues in the tissue microarray samples collected from May 2010 to September 2014. Using brown granules as the positive standard, staining intensity and percentage of positive cells in the total cell number were calculated for semi-quantitative treatment. Results CXCR4 protein was mainly expressed in cell membrane and cytoplasm. The positive expression rate of CXCR4 in normal breast tissues, lobular carcinoma in situ, intraductal carcinoma in situ, infiltrating ductal carcinoma was gradually increased, which was respectively 8.3%(3/36), 25.0%(1/4), 10.0%(5/50) and 72.0%(108/150), and there was a significant difference between these 4 groups(P<0.001). The positive expression rate of CXCR4 protein in the breast cancer tissues of stage I, II, III and over III was 18.2%(2/11), 80.4%(78/97) and 69.8%(30/43), respectively, there was significant difference between the 3 groups(P<0.001). The positive rate of CXCR4 protein in metastatic tumor tissues and non-metastatic breast cancer tissues was 88.4%(61/69) and 11.1%(15/135), respectively. Conclusion CXCR4 is highly expressed in some breast cancer tissues, and is closely related to the type of breast cancer and the invasion and metastasis of breast cancer.
[Key words] CXCR4; Breast cancer; Tissue microarray; Immunohistochemistry
乳腺癌是女性最常见的恶性肿瘤之一,近年来其发病率和死亡率在我国呈上升趋势。远端器官转移是乳腺癌失败的主要原因之一,然而学界对于乳腺癌转移的分子机制仍然不甚清楚。许多研究表明,肿瘤转移与炎症细胞趋化有着类似的过程。趋化因子可活化炎症细胞并为之提供迁移信号、趋化其移动并使之准确定位于高浓度的炎症因子区域。SDF-1(sclerotic stroma-derived factor 1)是骨髓基质细胞产生一种细胞因子,是趋化因子CXC家族的一员。研究显示肿瘤组织间质中含较高浓度的SDF-1,并且在部分肿瘤细胞培养上清中也发现SDF-1的高表达[1]。
CXCR4是SDF-1已知的唯一受体。SDF-1/CXCR4轴的活化可介导多种恶性肿瘤细胞的运动能力。研究发现在多种肿瘤组织中CXCR4的表达与肿瘤的转移率呈正相关关系[2];基因过表达技术发现乳腺癌细胞高表达CXCR4后其侵袭转移能力明显高于亲本细胞。有研究发现CXCR4在不同类型和分期的乳腺癌组织中表达存在差异,但是由于样本来源单一,统计结果难免偏颇[3-4];其次,CXCR4在乳腺癌中的差异表达与是否转移之间的关系不甚明晰。因此,2010年5月—2014年9月该研究拟以多中心来源的乳腺癌组织制作的组织芯片为检测对象,运用免疫组织化学法检测CXCR4在乳腺癌组织芯片中的表达,分析CXCR4表达量与乳腺癌组织分型分期以及淋巴结转移的相关关系。
1 材料与方法
1.1 组织芯片
3套乳腺癌组织芯片购自西安艾丽娜生物科技有限公司,编号分别为BR10010c,BR8011和BC081120a。标本收集于2010年5月—2014年9月,共有正常乳腺组织36例和肿瘤组织204例,其中浸润性导管癌组织150例、导管内原位癌组织50例、小叶原位癌组织4例;其中淋巴结转移的病例69例;年龄27~81岁,平均年龄(47.9±10.5)岁。
1.2 方法
浓缩型羊抗人CXCR4抗体购自Santa Cruz公司。超敏SP(抗羊)试剂盒和DAB显色试剂购自福州迈新公司。组织切片经二甲苯脱蜡、水化后,PBS洗3次各5 min;每张切片加100 μL 3%过氧化氢,孵育10 min,PBS冲洗3次,3 min/次,除去PBS液;滴加正常山羊血清封闭液,室温20 min;每张切片加100 μL的CXCR4抗体(1:200稀释),在4℃下孵育过夜。37℃复温45 min,PBS冲洗3次,3 min/次。滴加羊抗鼠Ⅱ抗100 μl,孵育1 h;PBS洗3次各5 min;DAB显色1~5 min,在显微镜下掌握染色程度;PBS或自来水冲洗10 min;苏木精复染2 min,盐酸酒精分化;自来水冲洗10~15 min;脱水、透明、封片、照相。结果判定:综合染色强度和阳性细胞占总细胞数的百分比进行半定量处理:无染色(-)为0分,染色弱(+)为1分,染色强呈棕黄色(++)为2分,染色很强深棕色(+++)为3分;阳性细胞数10%~50%者为2分,51%~80%者为3分,﹥80%者为4分。上述两项评分相乘:不管其染色强度,阳性细胞数﹤10%为(-),3分为(+),4~5分为(++),6~9分为(+++)。
1.3 统计方法
用SPSS 15.0统计软件分析数据,计数资料采用百分比(%)表6示,采用χ2检验,以P <0.05为差异有统计学意义。
2 结果
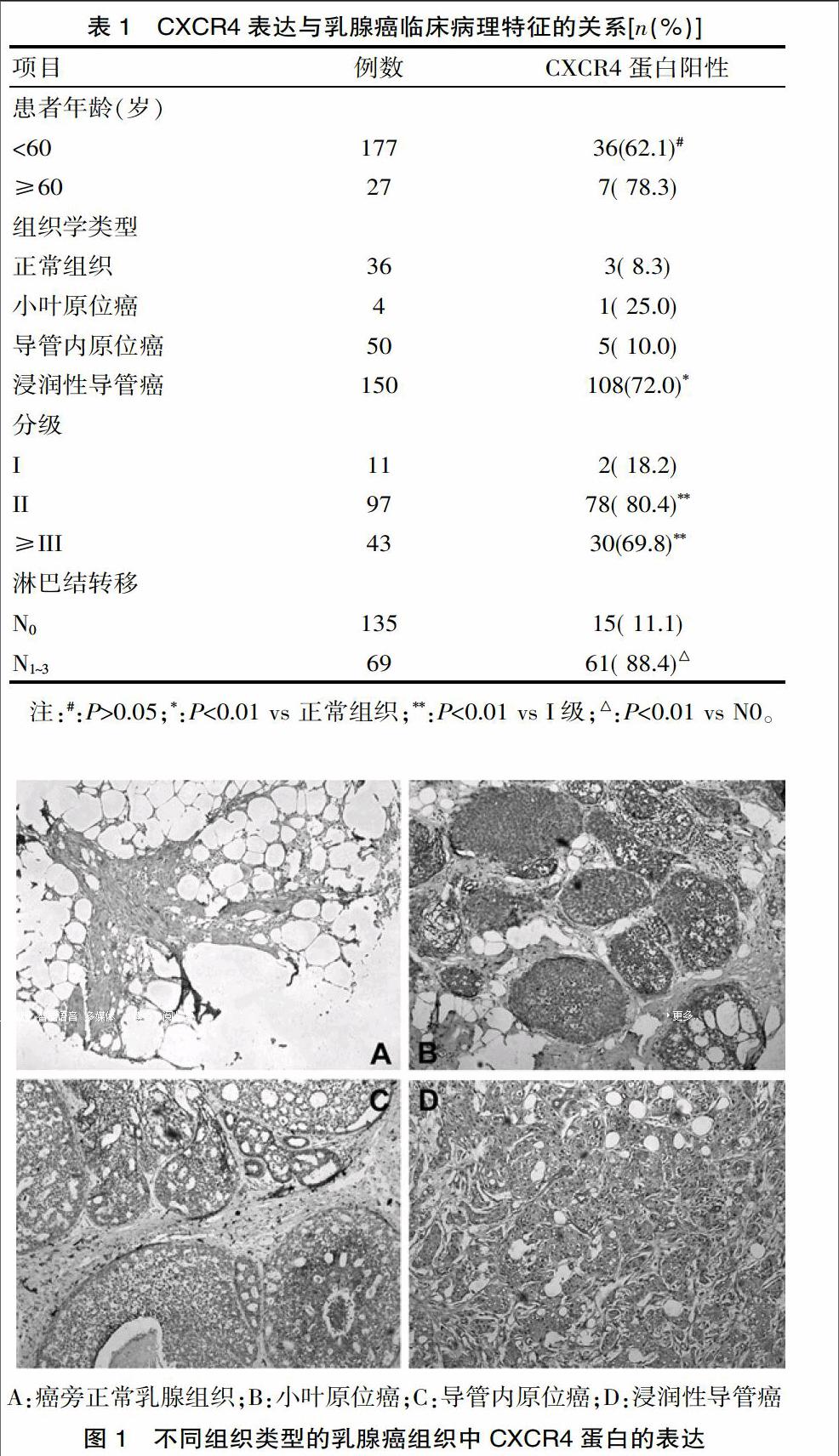
CXCR4在正常乳腺组织、导管内原位癌组织、小叶原位癌组织、浸润性导管癌组织(图1)中的阳性表达率分别为8.3%(3/36)、25.0%(1/4)、10.0%(5/50)、72.0%(108/150),4组间阳性表达率的差异有统计学意义(P=0.000)。CXCR4蛋白在不同级别的乳腺癌组织中的阳性率分别为I级18.2%(2/11)、II级80.4%(78/97)、III级以上69.8%(30/43),3组间阳性表达率的差异有统计学意义(P=0.000);CXCR4蛋白在有转移的肿瘤组织和未发现临床转移证据的乳腺癌组织中的阳性率分别为88.4%(61/69)和11.1%(15/135),两组间阳性表达率的差异有统计学意义(P=0.000);但CXCR4蛋白的表达在不同年龄(<60岁或≥60)的乳腺癌患者中的差异无统计学意义(P>0.05)。见表1。
3 讨论
SDF-1的趋化作用由CXCR4来介导。CXCR4在正常乳腺组织、乳腺、卵巢、前列腺表达很弱,但在乳腺癌和结肠癌中高表达[5],同时在乳腺癌中也发现CXCR4表达,并且在转移性乳腺癌细胞株和转移性乳腺癌细胞株中具有高表达[6]。对前列腺癌组织研究发现CXCR4蛋白表达升高与肿瘤的转移正相关[7]。表达CXCR4的肿瘤细胞在SDF-1的作用下从原发部位游走出来后通过血道和淋巴道向远端组织转移并形成转移灶。在前列腺癌、乳腺癌研究发现,CXCR4阳性的肿瘤细胞沿着SDF-1浓度梯度向高浓度迁徙,形成转移灶。因此普遍认为,CXCR4的表达不仅是上皮细胞恶性程度的主要特征之一,也可作为肿瘤转移能力的判断指标[8]。CXCR4与SDF-1结合,可以增加肿瘤细胞黏附能力和侵袭性,并分泌多种血管生成因子[9]。Tamamura等[10]发现SDF-1/CXCR4轴在乳腺癌转移发生中具有明显作用。在体外培养的乳腺癌细胞中加入SDF-1,癌细胞的增殖和侵袭力明显加强,并且转移能力也明显上升;用CXCR4单抗处理后,癌细胞增殖、侵袭、转移能力都受到抑制。
既往曾有几项研究关注CXCR4的表达与乳腺癌转移以及患者预后生存的关系,并指出CXCR4的表达与乳腺癌淋巴结转移密切相关,且SDF-1/CXCR4轴的激活与患者预后成负相关[11-12]。但是,我们注意到这些研究的标本来源比较单一,为一个市级地区患病人群;虽然样本量有上百例,但仍然有数据偏畸可能。因此该研究一改既往从地区医院取材的限制[13],转而采用西安艾莉娜公司的多张乳腺癌组织芯片进行研究,这些芯片来源于多个地区的多个医疗机构,总样本量达到204例,符合多中心研究的基本要求。该研究发现CXCR4蛋白在不同年龄和性别的乳腺癌组织中的表达差异无统计学意义。但是,CXCR4蛋白在不同病理类型的乳腺癌中存在表达差异:浸润性导管癌组织>导管内原位癌组织>小叶原位癌组织;其中在浸润性导管癌组织中的阳性表达率最高(72%);在不同级别的乳腺癌组织中CXCR4蛋白的表达也存在差异,在分化程度较低的组织中表达较高,提示CXCR4蛋白的表达可能与乳腺癌组织学分级呈正相关关系。最后,该研究对CXCR4蛋白表达与乳腺癌侵袭转移的关系进行了分析,结果提示在有淋巴结转移的乳腺癌组织中CXCR4的表达比率明显高于无淋巴结转移的乳腺癌组织,其差异有统计学意义。
该研究检测了CXCR4在各类型乳腺癌组织表达差异并分析了CXCR4的表达与病理类型和肿瘤转移之间的关系,为研究CXCR4在肿瘤侵袭与转移中所起作用并为进一步探索乳腺癌侵袭转移机制提供了新的实验依据。
[参考文献]
[1] Zeelenberg IS, Ruuls-Van SL, Roos E. The chemokine receptor CXCR4 is required for outgrowth of colon carcinoma micrometastases[J].Cancer Res,2003,63(13):3833-3839.
[2] Platt D, Amara S, Mehta T, et al. Violacein inhibits matrix metalloproteinase mediated CXCR4 expression: potential anti-tumor effect in cancer invasion and metastasis[J].Biochem Biophys Res Commun,2014,455(1-2):107-112.
[3] Douglass S, Meeson AP, Overbeck-Zubrzycka D, et al. Breast cancer metastasis: demonstration that FOXP3 regulates CXCR4 expression and the response to CXCL12[J].J Pathol,2014,234(1): 74-85.
[4] hang Z, Ni C, Chen W, et al. Expression of CXCR4 and breast cancer prognosis: a systematic review and meta-analysis[J].BMC Cancer,2014(14):49.
[5] Oliveira FV, Rubie C, Ghadjar P, et al. Changes in CXCL12/CXCR4-chemokine expression during onset of colorectal malignancies[J].Tumour Biol,2011,32(1):189-196.
[6] Hinton CV, Avraham S, Avraham HK. Role of the CXCR4/CXCL12 signaling axis in breast cancer metastasis to the brain[J].Clin Exp Metastasis,2010,27(2): 97-105.
[7] Akashi T, Koizumi K, Tsuneyama K, et al. Chemokine receptor CXCR4 expression and prognosis in patients with metastatic prostate cancer[J].Cancer Sci,2008,99(3):539-542.
[8] Ehtesham M, Stevenson CB, Thompson RC. Preferential expression of chemokine receptor CXCR4 by highly malignant human gliomas and its association with poor patient survival[J].Neurosurgery,2008,63(4):820.
[9] Wang J, Wang J, Sun Y, et al. Diverse signaling pathways through the SDF-1/CXCR4 chemokine axis in prostate cancer cell lines leads to altered patterns of cytokine secretion and angiogenesis[J].Cell Signal,2005,17(12): 1578-1592.
[10] Tamamura H, Hori A,Kanzaki N, et al. T140 analogs as CXCR4 antagonists identified as anti-metastatic agents in the treatment of breast cancer[J].FEBS Lett,2003,550(1-3): 79-83.
[11] 孔令禹,余之刚,薛梅,等.乳腺癌组织SDF-1/CXCR4表达与预后相关性分析[J].中华肿瘤防治杂志,2014(8): 605-611.
[12] 刘凤磊,赵凤辉,王金穗,等. 乳腺癌CXCL12及其受体CXCR4的表达及意义[J].诊断病理学杂志,2013(6): 336-339.
[13] 张杨,黄丽,杨齐,等.CXCR4在肺癌组织芯片中的表达及其临床意义[J].中国医药指南,2012,10(36): 448-450.
(收稿日期:2015-08-27)
