盐胁迫发菜胞外多糖的抗氧化活性
2016-01-11陈雪峰王贵春
陈雪峰, 王贵春, 刘 宁, 王 宁
(陕西科技大学 生命科学与工程学院, 陕西 西安 710021)
盐胁迫发菜胞外多糖的抗氧化活性
陈雪峰, 王贵春, 刘宁, 王宁
(陕西科技大学 生命科学与工程学院, 陕西 西安710021)
摘要:通过对液体培养发菜细胞进行盐胁迫处理,研究了盐胁迫对发菜胞外多糖化学结构及抗氧化活性的影响.在光照强度60 μmol·m-2s-1、光暗比12∶12、温度白天25 ℃及夜晚10 ℃等条件下,采用BG-110培养液培养发菜细胞,0.3 mol/L的NaCl胁迫处理发菜细胞,水溶醇沉法提取正常及盐胁迫下发菜胞外多糖,经纯化后进行红外光谱分析和抗氧化活性测定,并分析了发菜胞外多糖对盐胁迫的响应.结果表明:红外光谱分析两种发菜胞外多糖样品,其特征吸收峰基本一致;两种培养条件下的胞外多糖抗氧化能力均呈现量效关系,且YEPS活性高于NEPS.
关键词:发菜; 胞外多糖; 盐胁迫; 抗氧化活性
0引言
多糖是一类具有多种生物活性的大分子物质,具有保湿、抗菌、抗氧化、抗肿瘤等功能,已有将各种多糖应用于食品、医药中的研究报道.例如,普鲁兰多糖、黄原胶、香菇多糖等作为天然活性成分用于食品、药品行业[1-3].发菜是发状念珠蓝细菌(Nostoc Flagelliforme)的俗称,是一种重要的陆生蓝藻.发菜胞外多糖由发状念珠蓝细菌在生长过程中向胞外分泌,包裹于细胞及藻丝体外,对细胞起到保护作用,使其能抵御外部恶劣的生长环境,同时还具有抗肿瘤、抗病毒、抗氧化等生物活性[4],具有极高的药用价值和开发潜力.
近年来,发状念珠蓝细菌对逆境胁迫的响应备受国内外学者的重视.藻细胞在逆境胁迫条件下,其形态、功能及抗逆活性物质等产生了相应变化.Han等[5]研究了不同波长对发菜荚膜多糖和胞外多糖产生的影响,两类多糖产量明显增加,但其单糖组成等在不同光波长下存在显著性差异;赵学敏等[6]对发状细胞进行了不同浓度的盐胁迫处理,研究结果显示其正常生理活性受到抑制而表现出一定的抗逆能力,对盐胁迫具有一定的耐受性;进一步的研究表明,发菜光合速率与叶绿素荧光强度随NaCl浓度的升高先增加后降低,向培养液中添加外源硝酸盐后可以缓解NaCl对发菜细胞培养物的生理胁迫效应,增强其抗盐性.
目前,就发菜细胞盐胁迫的报道主要集中在盐胁迫对细胞形态和光合作用的影响,而发菜胞外多糖对盐胁迫的响应则有待深入研究.本课题组前期研究表明,发菜细胞处于盐胁迫环境时,胞外多糖的分泌量较常规培养增加了50.3%.基于此,本文以液培发菜细胞为材料,研究了盐胁迫对发菜胞外多糖化学结构及抗氧化活性的影响,从而为生产高活性的生物多糖提供了新方法、新思路.
1材料与方法
1.1实验材料
(1)主要仪器:Varioskan Flash全波长扫描式多功能读数仪,美国Thermo Scientific公司;紫外-可见分光光度计,上海美谱达仪器有限公司;VERTE70型傅立叶红外光谱分析仪,德国Bruker公司.
(2)主要试剂:偶氮二异丁脒盐酸盐(AAPH),美国Sigma公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),美国Sigma公司;过硫酸钾(K2S2O8),天津市科密欧试剂有限公司;2,6-二叔丁基-4-甲基苯酚(BHT),美国Sigma公司;水溶性维生素E(Trolox),美国Sigma公司;荧光素钠盐(FL),美国Sigma公司.
1.2实验方法
1.2.1发菜盐胁迫处理
无菌条件下离心收集指数生长末期的发状念珠蓝细菌细胞,重新接种于氯化钠浓度为0.3 mol/L的BG-110培养液中.对照组不含氯化钠.在光照强度60μmol·m-2s-1、光暗比12∶12、温度白天25 ℃及夜晚10 ℃条件下,连续培养6天.
培养结束后,参照陈雪峰等[7]的研究方法,对两种环境下发菜胞外多糖进行提取纯化、冷冻干燥后,得白色絮状多糖样品.正常环境及盐胁迫环境下发菜胞外多糖纯化物分别命名为NEPS、YEPS,用于红外光谱分析及活性测定.
1.2.2红外光谱分析
称取多糖样品,与充分干燥的溴化钾混合压片,在4 000~600 cm-1区间内进行红外光谱扫描.
1.2.3发菜胞外多糖清除氧自由基能力(ORAC值)
抗氧化能力指数(Oxygen Radical Absorbance Capacity,ORAC),是目前抗氧化研究领域中为人们所关注的一个评价方法.该方法以偶氮类化合物AAPH作为过氧自由基来源、荧光素钠作为荧光指示剂、维生素E水溶性类似物Trolox作为定量标准,使用酶标仪进行分析[8-10].
在96孔板的各微孔中分别加入缓冲溶液、样品(4 mg/mL)及FL各20μL后,在37 ℃下孵育15 min,迅速在各孔中加入新配制的12.8 mmol/L的AAPH 140μL启动反应;将96微孔板放入酶标仪后运行程序,在37 ℃下以激发波长485 nm、发射波长538 nm 进行连续测定,每2 min 测定一次各孔荧光强度,测定120 min;以不添加自由基的FL荧光自然衰减(-AAPH)和不添加抗氧化剂的自由基荧光自然衰退(+AAPH)为空白对照,计算抗氧化剂保护面积AUC,用AUC 值与Trolox 浓度建立线性回归方程[10],再根据线性回归方程计算ORAC值,ORAC值以μmol Trolox /mg 表达.
1.2.4发菜胞外多糖清除ABTS自由基能力
ABTS自由基储备液的制备可参照卢茳虹等[9]的实验方法.ABTS自由基储备液的制备过程是:将ABTS和K2S2O8分别用去离子水溶解并混合,使其终浓度分别为14 mmol/L和4.9 mmol/L,室温避光条件下静置12~16 h.测定时,以50%乙醇稀释ABTS自由基储备液,使其在734 nm处吸光值A0为0.702,形成ABTS自由基测定液.取2.9 mL ABTS自由基测定液,各加入0.1 mL不同浓度发菜胞外多糖溶液,混匀后反应20 min ,测定734 nm处吸光值Ax.以不同浓度BHT对ABTS自由基的清除作用作为阳性对照.
发菜胞外多糖对ABTS自由基清除能力用清除率R表示:
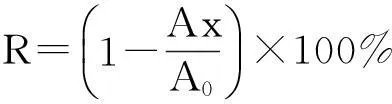
IC50值是自由基清除率R为50%时样品的浓度.
1.2.5发菜胞外多糖还原力的测定
取0.4 mL不同浓度待测液、1.0 mL pH 6.6的磷酸盐缓冲液及1.0 mL 1%铁氰化钾溶液,迅速混匀,避光条件下,50 ℃水浴保温反应20 min,然后加入1.0 mL 10%三氯乙酸溶液,混匀后10 000 r/min离心5 min,取2.5 mL上清液,再加入2.5 mL超纯水和0.5 mL 0.1%FeCl3,常温静置反应5 min后,于700 nm处测定其吸光值.超纯水替代0.1%FeCl3作为空白对照[11,12].
2结果与讨论
2.1盐胁迫对发菜胞外多糖红外光谱的影响
红外吸收光谱是目前解析糖类化合物结构的重要手段之一.根据糖类化合物红外光谱图上呈现的特殊吸收,可以判断糖链上的主要取代基、官能团类型、糖环构型和糖苷键连接方式等结构信息.红外光谱工作范围是4 000~400 cm-1,常见官能团均能在该区域产生吸收带.一般而言,3 600~3 200 cm-1区为糖类分子内羟基O-H键的特征吸收峰;1 600 cm-1附近的吸收峰为CHO中C=O的吸收;1 400 cm-1附近的吸收峰为C-H 的变角振动吸收,是糖类化合物的特征吸收峰,是判断未知化合物是否为糖类的重要依据;全谱中最强的吸收峰出现在1 200~1 000 cm-1区间,由C-O-H和糖环C-O-C的两种C-O键伸缩振动所引起的;1 000 cm-1以下为指纹区,用于判断糖聚物的类型和构型[13-15].
图1为不同培养条件下发菜胞外多糖红外光谱图,两种发菜胞外多糖样品分析结果如表1所示.由此可知,NEPS与YEPS的特征吸收峰基本一致,两者在810 cm-1、1 614 cm-1附近的吸收峰相似,可以断定均有α-D-吡喃甘露糖及糖醛酸的存在.此外,在1 240 cm-1和1 140 cm-1处无S=O和S-O-S基团的特征吸收峰,说明NEPS与YEPS均为非硫酸化多糖.
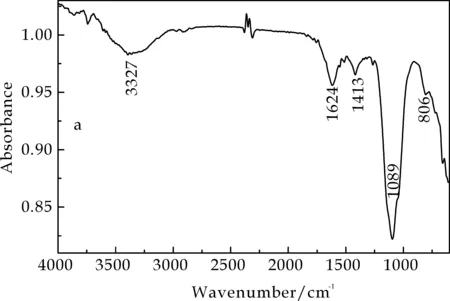
(a) NEPS红外光谱图
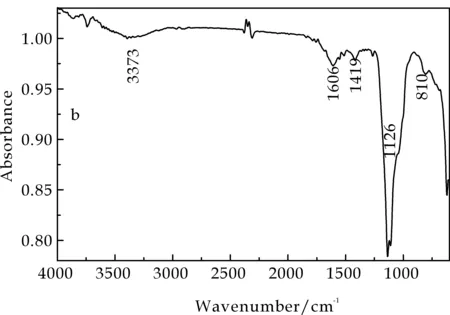
(b)YEPS红外光谱图图1 不同环境下发菜胞外多糖红外光谱图
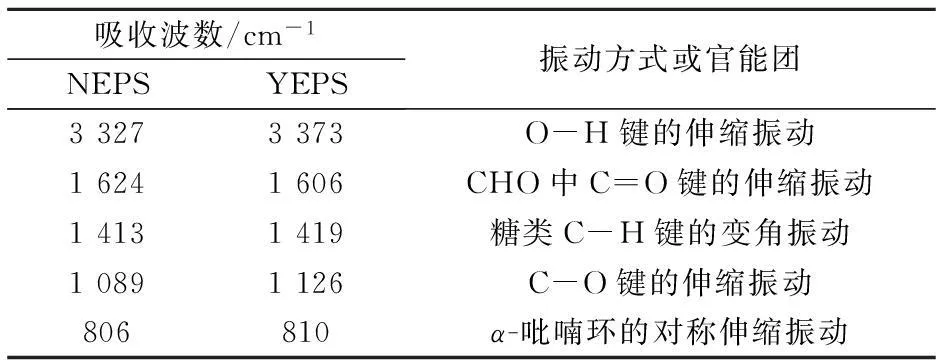
吸收波数/cm-1NEPSYEPS振动方式或官能团33273373O-H键的伸缩振动16241606CHO中C=O键的伸缩振动14131419糖类C-H键的变角振动10891126C-O键的伸缩振动806810α-吡喃环的对称伸缩振动
2.2盐胁迫对发菜胞外多糖抗氧化活性的影响
2.2.1盐胁迫对发菜胞外多糖氧自由基清除能力(ORAC值)的影响
比较不同培养条件下发菜胞外多糖NEPS与YEPS氧自由基清除能力,其结果如图2所示.根据计算可得,NEPS与YEPS的ORAC 值分别为39.68μmol Trolox/mg和98.96μmol Trolox/mg.两种培养条件下发菜胞外多糖均具有较好的氧自由基清除能力,但YEPS的ORAC 值明显高于NEPS,约为NEPS的2.5倍.这说明盐胁迫处理可以明显提高发菜胞外多糖清除氧自由基的能力.
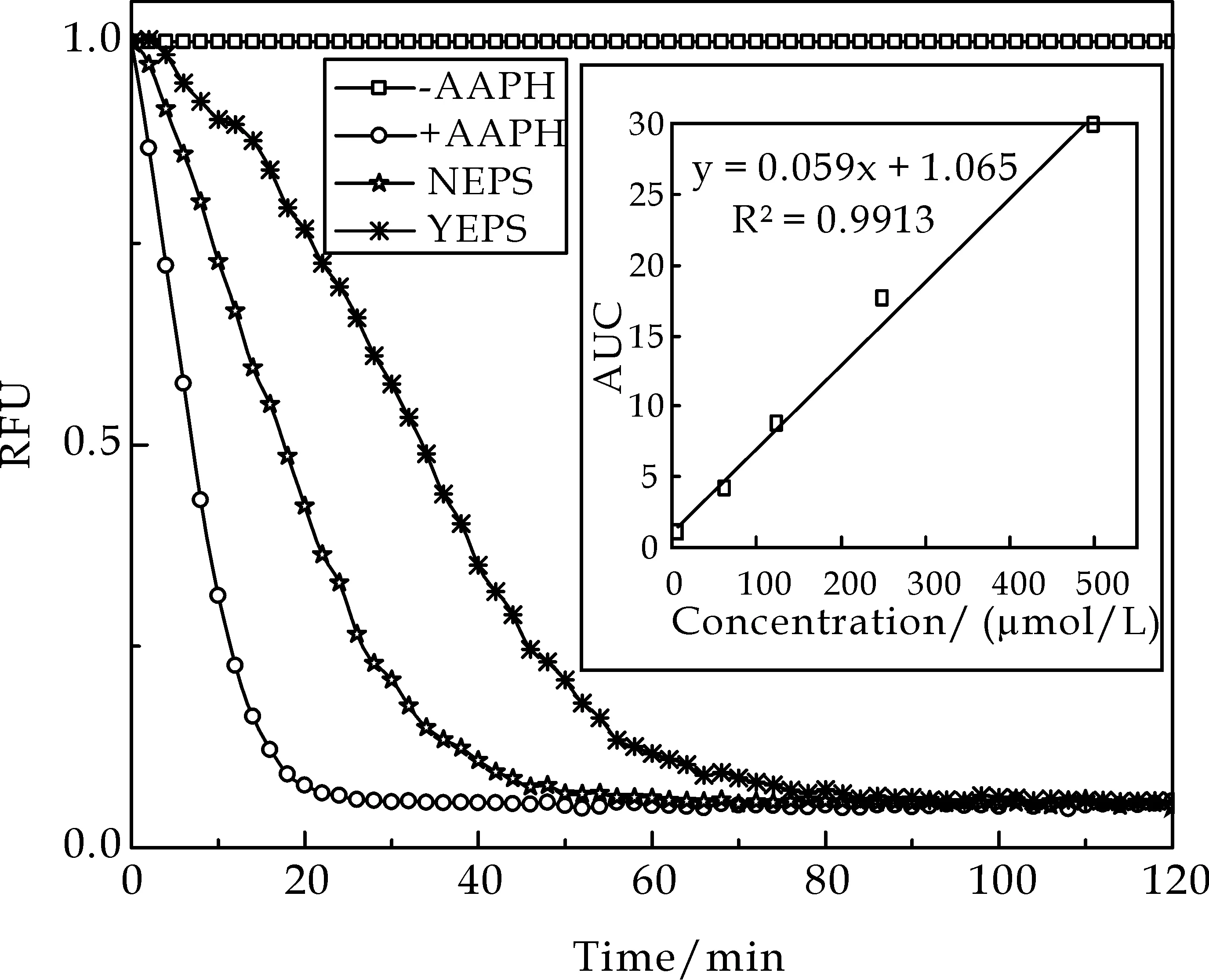
图2 NEPS与YEPS清除氧自由基的能力
2.2.2盐胁迫对发菜胞外多糖ABTS自由基清除能力的影响
比较不同培养条件下发菜胞外多糖NEPS与YEPS的ABTS自由基清除能力,其结果如图3所示.可以看出,NEPS与YEPS均具有清除ABTS自由基的能力,且与多糖浓度成正相关性.当多糖浓度为4.0 mg/mL 时,NEPS与YEPS的ABTS自由基清除能力分别为50.43%和57.55%.抗氧化剂BHT显示出了极高的清除ABTS自由基能力,在浓度为0.25 mg/mL时,ABTS自由基清除能力已达99.43%.
比较BHT及样品的ABTS自由基清除能力IC50值可知,BHT(其IC50 值为0.13 mg/mL)的自由基清除能力最强;其次是YEPS(其IC50值为2.68 mg/mL);最弱为NEPS(其IC50值为3.76 mg/mL).通过样品的ABTS自由基清除能力IC50值可以看出,盐胁迫处理可以明显提高发菜胞外多糖清除ABTS自由基能力.
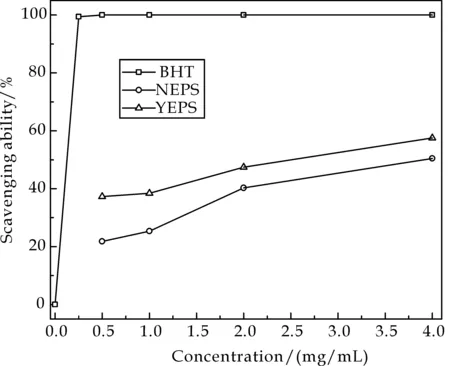
图3 NEPS与YEPS清除ABTS自由基的能力
2.2.3盐胁迫对发菜胞外多糖还原力的影响
抗氧化剂能够通过自身的还原作用给出电子使自由基变成稳定的分子,从而失去活性[16];还原力越强,反应液吸光值越大,抗氧力就越强.因此,可根据反应液吸光值的大小来评价样品的抗氧化能力.
如图4所示,NEPS与YEPS的还原力与多糖浓度有一定的相关性,两者均随着浓度的增加而增强.当多糖样品浓度为4.0 mg/mL时,NEPS与YEPS的还原力分别为0.331、0.365,盐胁迫处理下得到的发菜胞外多糖还原力增加了10.3%.造成两种培养条件下胞外多糖具有不同抗氧化活性的原因,与其具有不同的化学结构有关,糖苷键连接方式、单糖组成等都会对抗氧化活性产生影响.
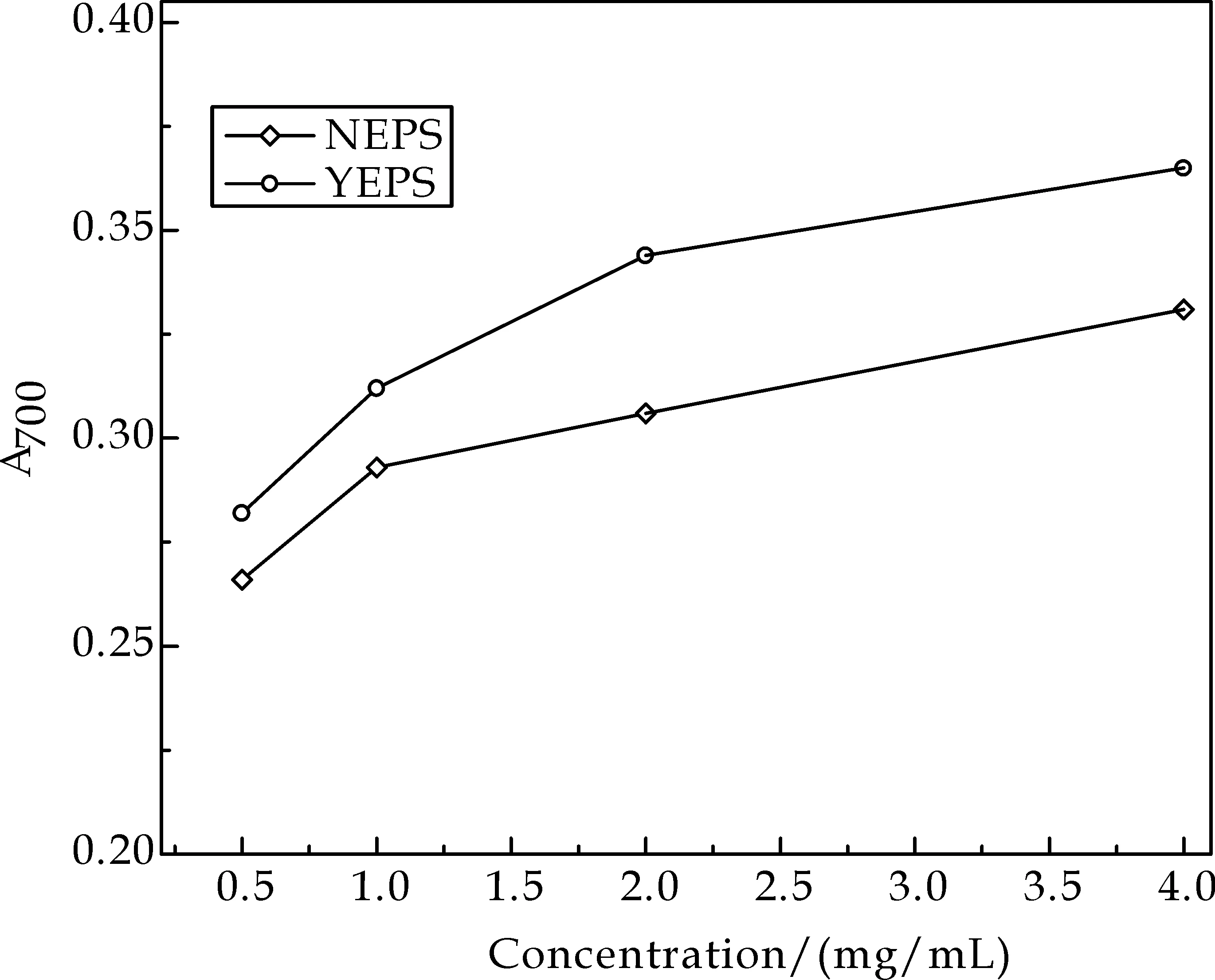
图4 NEPS与YEPS的还原力
3结论
通过对盐胁迫及正常环境培养的发菜胞外多糖进行提取纯化,研究了盐胁迫对发菜胞外多糖化学结构及抗氧化活性的影响.
红外光谱分析表明,两者的特征吸收峰基本一致,均有α-D-吡喃甘露糖及糖醛酸的存在,且为非硫酸化多糖;抗氧化活性研究结果显示,NEPS与YEPS均具有一定的抗氧化活性,但YEPS的抗氧化活性明显高于NEPS.这说明盐胁迫处理可以明显提高发菜胞外多糖的抗氧化活性,为获取高活性的微生物多糖提供了新的思路和方法.
参考文献
[1] 成媛媛,刘永乐,王建辉,等.普鲁兰多糖在草鱼鱼肉保鲜中的应用[J].食品科学,2012,33(2):272-275.
[2] 赖富饶,吴晖,牛晨艳,等.黄原胶的流变特性及其在食品工业中的应用[J].现代食品科技,2006,22(4):274-276.
[3] 宁书年,张桂.生物多糖类物质对人体的作用[J].食品科学,2005,26(9):613-614.
[4] Kanekiyo K.,Lee J.B.,Hayashi K.,et al.Isolation of an antiviral polysaccharide,Nostoflan,from a terrestrial cyanobacterium N.flagelliforme[J].J.Nat. Prod,2005,68(7):1 037-1 041.
[5] Han Pei-pei,Sun Ying,Jia Shi-ru,et al.Effects of light wavelengths on extracellular and capsular polysaccharide production by Nostoc flagelliforme[J].Carbohydrate Polymers,2014,105:145-151.
[6] 赵学敏,毕永红,秦山,等.发菜细胞培养物对盐胁迫的响应[J].西北植物学报,2005,25(11):2 234-2 239.
[7] 陈雪峰,李一当,贾士儒.发菜多糖的提取、纯化鉴定及理化特性研究[J].食品与发酵工业,2008,34(10):174-177.
[8] Hua Y L,Yang B,Tang J,et al.Structural analysis of watersoluble polysaccharides in the fruiting body of dictyophora indusiata and their in vivo antioxidant activities[J].Carbohydrate Polymers,2012,87(1):343-347.
[9] 卢茳虹,林宗毅,崔春.柠檬酸提取海带渣中多糖及其抗氧化活性与结构的研究[J].食品工业科技,2012,33(23):93-96.
[10] 续洁坤,姚新生,栗原博.抗氧化能力指数ORAC测定原理及应用[J].中国药理学通报,2006,22(8):1 015-1 021.
[11] Kumaran A,Karunakaran R J.Antioxidant and free radical scavenging activity of an aqueous extract of Coleus aromaticus[J].Food Chem,2006,97(1):109-114.
[12] 谢丽源,甘炳成,彭卫红,等.评价方法对层孔菌抗氧化能力的影响[J].食品与生物技术学报,2014,33(2):143-150.
[13] 蔡孟深,李中军.糖化学[M].北京:化学工业出版社,2007:402-403.
[14] 梁燕茹,李文权,刘四光.自养小球藻硫酸多糖的红外光谱分析[J].海洋科学,2007,31(11):1-4.
[15] Yin Chen,Wenjun Mao,Yupin Yang,et al.Structure and antioxidant activity of an extracellular polysaccharide fromcoral-associated fungus,Aspergillus versicolor LCJ-5-4[J].Carbohydrate Polymers,2012,87:218-226.
[16] 张春梅,宋海,魏生龙.荷叶离褶伞菌丝体多糖的提取及还原力的研究[J].中国食用菌,2012,31(6):44-48.
The antioxidant activity of nostoc flagelliforme
extracellular polysaccharide under salt stress
CHEN Xue-feng, WANG Gui-chun, LIU Ning, WANG Ning
(College of Life Science and Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
Abstract:The effects of salt stress on the chemical structure and antioxidant activity of nostoc flagelliforme extracellular polysaccharide in liquid culture were demonstrated in this study.The result of nostoc flagelliforme extracellular polysaccharide was analyzed under the stress.The modified BG-110culture medium containing NaCl of 0.3 mol/L was used to cultivate nostoc flagelliforme cell at light intensity of 60 μ mol·m-2s-1,dimming ratio 12∶12,the temperature during the day 25 ℃,10 ℃ at night.The polysaccharide was precipitated by ethanol.Functional groups and antioxidant activity were analyzed.The IR analysis of NEPS and YEPS were basically the same characteristic absorption peaks.The antioxidant of NEPS and YEPS showed dose-effect relationship,and YEPS had higher activity than NEPS.
Key words:nostoc flagelliforme; extracellular polysaccharide; salt stress; antioxidant activity
中图分类号:TS207.3
文献标志码:A
文章编号:1000-5811(2015)01-0122-04
作者简介:陈雪峰(1964-),男,陕西宝鸡人,教授,博士生导师,研究方向:食品功能成分及生物技术
基金项目:国家自然科学基金青年项目(31401633); 陕西科技大学国家基金后补助项目(2014XHBZ-10)
收稿日期:*2014-10-11
