活性炭纤维负载Pd/Sn电催化高浓度硝酸盐废水的优化研究
2016-01-11胡阳阳贾卫华
花 莉, 胡阳阳, 张 庚, 贾卫华
(1.陕西科技大学 资源与环境学院, 陕西 西安 710021; 2.国家林业局 林产工业规划设计院, 北京 100010)
活性炭纤维负载Pd/Sn电催化高浓度硝酸盐废水的优化研究
花莉1, 胡阳阳1, 张庚1, 贾卫华2
(1.陕西科技大学 资源与环境学院, 陕西 西安710021; 2.国家林业局 林产工业规划设计院, 北京100010)
摘要:以活性炭纤维负载Pd/Sn(4∶1)为电催化还原阴极,采用单因素实验与正交试验方法,研究了高浓度硝酸盐废水电催化还原处理过程中NO3--N去除量、N2选择率与电流、初始pH、初始硝酸盐浓度、溶液循环流速等的相关性,并优化了电催化还原工艺参数.实验结果表明,电流、电流与初始pH交互作用为NO3--N去除的主要控制因素,电流、初始硝酸盐浓度为N2选择率的主要控制因素.电流=0.68 A、pH=6.4、初始硝酸盐浓度=250 mg/L为“脱硝产氮气”的最佳反应条件.在此条件下反应6 h,NO3--N从250 mg/L降至200 mg/L以下,N2-N最大生成率超过48%,催化剂活性达到20 mg/(g·h).
关键词:活性炭纤维负载Pd/Sn; 电催化还原; 高浓度硝酸盐废水; NO3--N去除; N2选择
0引言
目前,去除水体中硝酸盐的方法主要有生物脱氮、化学催化还原脱氮,以及电渗析、离子交换、电去离子等物理化学脱氮等三种.其中,物理化学方法可以快速去除水体中硝酸盐,具有操作简便,成本低廉,无需加入化学药品,适用于小规模处理等优点而越来越受到人们的青睐[1-3].上述方法的缺点是会产生一定量不可循环利用的高浓度废水.这些废水可生化性差,处理难度大,远远不能满足污水处理安全性、经济性和可持续发展的要求.因此,有效的高浓度废水处理技术已经成为实现物化处理污水零排放的关键因素之一.
电催化还原方法因其具有安全性、高效性、环保性以及无需添加其它还原剂等优势,正日益受到人们的重视[4].其中,高浓度硝酸盐电催化还原的研究,在近些年已成为水处理技术研究领域的前沿课题[5-7].已有大量实验研究证明,在各种应用于NO3-还原实验的电极催化材料中,贵金属搭配过渡金属电极通常具有较高的催化活性.Pd/Sn合金催化剂在具有高活性的同时还表现出了较好的N2选择性[8,9],但该领域研究短板在于几乎所有实验研究均以控制单因素水平实验为主,未对各控制因素进行相互关联对比优化,也未通过比较各控制因素的内在联系来间接分析催化还原的控制机理.
本研究以自制的Pd、Sn改性的活性炭纤维(ACF)作为阴极催化剂,通过单因素实验联合正交试验,探究电流、初始pH、初始硝酸盐浓度、溶液循环流速等对NO3--N去除和N2选择的影响强度,最终实现电催化还原NO3--N去除量最大化、N2选择率最大化.并通过实验结果,适当探讨了其反应机理.
1实验部分
1.1实验装置与材料
1.1.1实验装置
实验装置为长方体槽体形状,槽体内部为12 cm(宽)×1.2 cm(厚)×20 cm(高).以20 cm(长)×1 cm(宽)×0.1 cm(厚)钛板(宝鸡隆盛)为阳极,将Pd/Sn改性的ACF(活性炭纤维SY-1500,上海索菲亚)裁剪成20 cm(长)×1 cm(宽)的长条10条,用铜粉导电胶(双组份铜导电胶DB2011,武汉双键开姆)粘附于钛板两侧,然后用大孔尼龙网绑缚加固制成阴极.其中,阳极极板5片,阴极极板5片.将阴极阳极极板交替排列于槽体内部,且相邻极板间距保持1 cm[8,10].然后,将阴阳极连接至稳压直流电源(RXN-605D, 深圳兆信).具体如图1所示.

图1 电催化还原实验装置图
1.1.2主要试剂
NaNO3:分析纯(天津天力).
去离子水:电导率为9μS/cm,pH为6.09~6.92,自制.
EDTA(乙二胺四乙酸):分析纯(天津津北).
PdCl2:分析纯(国药).
SnCl2:分析纯(天津科密欧).
NaBH4:分析纯(天津科密欧).
NaOH:分析纯(天津科密欧).
1.2分析与评价方法
定时在储水槽取样,NO3--N每次100μL,NO2--N、NH4+-N每次200μL,忽略取样对反应溶液体积的影响.本实验以NO3--N去除效果、N2的生成量为评价指标,检测计算均以“N”计.
①NO3--N:紫外分光光度法[11].
②NO2--N:N(1-萘基) -乙二胺分光光度法[12].
③NH4+-N:纳氏试剂光度法[13].
④硝酸盐氮的去除量X:
X=(C0-Ct)×V
(1)
其中,C0和Ct分别为硝酸盐氮的起始和电解t时间后的浓度(mg/L);V为溶液的总体积,为1 L.
⑤氮气(以氮计)选择率SR:
SR=(c0-ct-cNO2--N-cNH4+-N)×c0×100%
(2)
其中,cNO2--N和cNH4+-N分别为电解t时间后NO2--N和NH4+-N的浓度(mg/L).
⑥催化剂活性λ:单位时间内单位质量的催化剂去除硝酸盐氮的质量.
λ=mNO3--N/(mPd·t)
(3)
⑦电流效率η:生成反应产物(氮气、氨氮、亚硝酸盐氮)的总电流效率.
η=Σ(mi×ni×F)/Q
(4)
其中,i表示反应产物,mi表示生成的摩尔数,ni表示生成i所需要的电子转移数,F为法拉第常数(96 500 C/mol),Q表示反应中转移的总电量(C).
1.3实验方法
1.3.1负载Pd/Sn的ACF催化剂的制备
采用多步浸渍法在ACF上负载Pd/Sn催化剂[4,5,8,14,15],具体步骤如下:
①将自行裁剪的条形ACF在蒸馏水中煮沸3 h,充分再生,取出再使用蒸馏水冲洗,在105 ℃烘干12 h.
②配置5%EDTA溶液,将①得到的ACF浸泡12 h,充分吸附,再在105 ℃烘干12 h.
③将饱和吸附EDTA的ACF浸泡于0.23%的PdCl2(化学纯)溶液中并60 ℃水浴保持12 h,再从水浴中取出静置12 h.然后缓慢蒸干溶液,直至没有水可以浸出ACF,将ACF取出放入烘箱中于105 ℃干燥24 h.
④将③中烘干的ACF在400 ℃下通氮气,煅烧3 h,冷却至室温取出.
⑤在300 mL的2%NaBH4溶液中还原,然后反复用去离子水清洗,再在105 ℃下烘干12 h.
⑥将负载Pd的ACF使用上述②~⑤的方法进行Sn的负载,然后干燥备用.
1.3.2各处理的单因素实验
水样总体积为1 L,实验反应装置容量为200 mL,采用下进上出的循环流动方式,每次实验进行6 h,定时在储水槽取样.共进行四组单因素实验[4,7,8]:
①NO3--N浓度300 mg/L 、pH为6.4、溶液流速为15 mL/min.电流分别选取0.17 A、0.34 A、0.68 A、1.02 A、1.36 A、1.7 A.
②NO3--N浓度300 mg/L、电流0.68 A、流速15 mL/min.pH分别选取为5.8、6.4、7.4、10.3.
③电流0.68 A、pH为6.4、溶液流速为15 mL/min.NO3--N浓度分别选取为250 mg/L、300 mg/L、350 mg/L、400 mg/L.
④NO3--N浓度300 mg/L、电流0.68 A、pH为7.4.溶液循环流速分别选取为15 mL/min、45 mL/min、60 mL/min.
通过以上实验为正交试验选择最佳“脱硝产氮” 因素.
1.3.34因素2水平正交试验组合设计
试验选取氮气选择最佳两水平作为正交试验因素的两个水平,制作因素水平表(见表1所示).选取L8(27)正交表,进行综合直观分析与方差分析,最终确定最优因素水平.

表1 正交试验因素水平
2结果与讨论
2.1负载Pd/Sn的ACF催化剂扫描电镜图
从图2(a)可以看出,ACF表面上具有很多起伏的褶皱,这为Pd与Sn提供了丰富的负载空间,但改性后的表面还是出现了部分负载金属不均匀的现象.图2(b)显示了单根ACF纤维的负载情况,可以明显地看到ACF表面分布有很多不同粒径的Pd/Sn.这证明催化剂制备成功,从而可以进行硝酸盐的电催化还原反应[8].

(a)×800倍

(b)×15 000倍图2 负载Pd/Sn的ACF催化剂的扫描电镜图谱
2.2单因素实验结果
2.2.1不同电流强度对NO3--N去除及N2选择率的影响
图3显示NO3--N去除量与电流呈正相关,电流为0.17 A时的去除量为20.9 mg,当电流提高至1.7A时,NO3--N去除量达到了31.2 mg;N2-N选择率从0.17 A的51.7%升高到0.34 A的56.1%.之后,随着电流的升高,N2选择率也依次递减,当至1.7A时N2选择率仅为3.35%.电流在0.34 A与0.68 A时的N2选择率为最好,均在54%以上.因此,可以N2选择率为先决因素选择指标,选取0.34 A、0.68 A为正交试验电流的两组水平数.

图3 不同电流强度下NO3--N去除量及N2选择率
2.2.2不同初始硝酸盐浓度对NO3--N去除及N2选择率的影响
如图4所示,随着NO3--N浓度的增加,硝酸盐去除量也随之升高.硝酸盐初始浓度250 mg/L浓度下NO3--N去除量为22.2 mg,当硝酸盐初始浓度为400 mg/L时硝酸盐去除量达到34.7 mg;N2选择率在250 mg/L与300 mg/L时均在40%以上,而350 mg/L与400 mg/L时均低于40%.因此,可以N2选择率为先决因素选择指标,选取250 mg/L与300 mg/L为正交试验初始硝酸盐浓度的两组水平数.
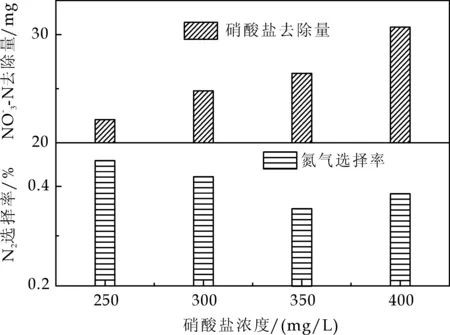
图4 不同初始硝酸盐浓度下NO3--N去除量及N2选择率
2.2.3不同初始pH值对NO3--N去除及N2选择率的影响
图5显示NO3--N去除量与pH呈负相关,当pH为5.8时NO3--N去除量为30.3 mg,pH为10.3时降到了21.5 mg;N2选择率在pH为6.4与7.4时均已超过50%.因此,可以N2选择率为先决因素选择指标,选取6.4与7.4为正交试验pH值的两组水平数.

图5 不同pH值下NO3--N去除量及N2选择率
2.2.4不同流速对NO3--N去除量及N2选择率的影响
流速反应的是溶液对流传质的快慢.如图6所示,随着流速的增加,硝酸盐的去除量与氮气的选择率都是先增后减.在45 mL/min时达到最大值,60 mL/min时次之.因此,可以N2选择率为先决因素选择指标,选取45 mL/min与60 mL/min为正交试验流速的两组水平数.
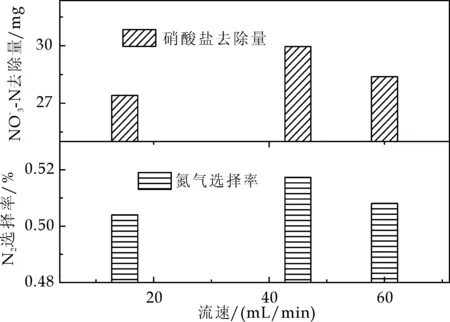
图6 不同流速下NO3--N去除量及N2选择率
2.3正交试验结果
从表2中的极差R分析以及数据的方差分析[16],可以发现:
①各因素对硝酸盐去除量影响的大小依次是:电流(A)>电流与pH交互作用(A×B)>初始硝酸盐浓度(C)>pH(B)>电流与初始硝酸盐浓度交互作用(A×C)>溶液循环流速(D).
方差分析得到因素A与A×B对结果影响极显著(FA=402.21,FA×B=144.21,F0.99(1、2)=
98.5,PA ②各因素对氮气选择率影响的比较:电流(A)>初始硝酸盐浓度(C)>电流与pH交互作用(A×B)>pH(B)>溶液循环流速(D)>电流与初始硝酸盐浓度交互作用(A×C). 因素A与C对结果影响极显著(FA=210 9.61,FC=1 535.93,F0.975(1、1)=647.8,PA 综合上述结果,将A2B1C1D确定为NO3--N去除量及N2选择率的最佳水平组合.溶液循环流速(D)为不显著性因子,其改变对结果没有显著影响,可以随机选取. 表2 L8(27)正交试验结果 注:A×B表示因素A与因素B的交互作用,A×C表示因素A与因素C的交互作用. 2.4优选工艺的验证 通过优化置信区间估值计算,得到最优NO3--N去除量(P<0.01)区间为(44.89 mg、51.51 mg),最优N2-N选择率(P<0.025)区间为(43.14%、50.47%). 以此为评价标准,按最佳因素水平组合为A2B1C1D(其中D随机选取),进行三组验证试验,结果见表3所示.三次验证试验结果均在置信区间内,验证了优选因素水平组合为最佳工艺参数. 表3 优选工艺验证试验 2.5反应机理讨论 经过一系列单因素实验以及进一步正交试验,可发现电流、电流与pH的交互作用是NO3--N去除的决定性因素,而电流与硝酸盐初始浓度是N2选择率的决定性因素. 双电层理论模型认为[17]:氢离子很容易进入阴极电极双电层内部的紧密层,参与还原反应.而NO3-则停留在分散层,H+得到电子变成H后,由于双电层电位需要保持恒定的原则而被挤出双电层内层.Pd对H有很强的吸附性,NO3-会由于Pd/Sn的协同作用,而被吸附于Pd/Sn双金属表面,这样使得H与NO3-接触进而反应.NO3-被还原成NO2-,NO2-进一步与H反应,最终还原为N2,继而达到了去除NO3-的目的.因此,H+与其中的氧离子结合成为H2O,在整段反应中H+作为电子传递的一个载体. 电流与pH的交互作用对硝酸盐去除的影响在其他文献中从未被提及过.仅周丽、范经华等[4,5]曾对硝酸盐去除做了pH的单因素实验,确定出最佳硝酸盐去除的pH为7.3左右. 本文试验研究表明:由于电流与pH有较紧密的交互作用,故pH=7.4时的硝酸盐去除效果较pH=6.4时的效果反而有所降低.但单就pH进行实验研究(表2中B因素所对应的NO3--N去除水平均值T1小于T2)却表明pH在7.4时的效果反而比6.4时更好.这说明在反应中pH与电流对硝酸盐的去除并非协同作用,pH的升高并不利于硝酸盐去除.本研究的这个结论与前人结论相同[4,5].由于电流与pH的交互作用为显著性因素,而pH为非显著性因素,因此,NO3--N的去除由电流与pH的交互作用共同决定,且交互作用为拮抗交互. M.T.De Groot认为[18]:当NO3-浓度低于1 mol/L时,NO3--N的去除需要H+的参与,并且NO3-被还原为NO2-是N2生成速率的决定步骤.因此,H+能否顺利获得是影响速率的一个重要因素.显然,在pH=6.4的溶液中的H+浓度是pH=7.4溶液中的H+浓度的10倍.因此,在低pH条件下,高浓度的H+会显著提高反应速率. 电流与浓度为N2选择率的控制因素.电流的增加为NO3-还原提供了更多的氢原子与电子,从而增加了反应速率.电流的提高可驱使更多的H原子与NO3-中的N接触,导致NH4+的大量生成,NH4+与N2产生竞争,从而降低了N2的选择率[5,6]. NO3-的吸附是反应的控制步骤[7].当NO3-浓度增加时,N2生成量随之提高(浓度由250 mg/L的7.4 mg升高到400 mg/L的9.8 mg).但由于催化活性位点的数量有限,H原子与NO3-中N的接触次数也会显著升高,促进了N-H键合,NH4+-N生成量明显升高(从250 mg/L的6.2 mg升高到400 mg/L的10.3 mg),N2选择率便会下降. 3结论 (1)以活性炭纤维负载Pd/Sn(4∶1)为电催化还原阴极,可以脱出废水中高浓度硝酸盐.NO3--N的最佳去除量与N2的最佳选择率控制因素为:电流0.68 A、pH=6.4、硝酸盐初始浓度250 mg/L,其余因素可随机选取.在此条件下,最大NO3--N去除量超过50 mg,最大N2选择率超过48%,催化剂活性达到20 mg/(g·h). (2)电流、电流与pH的交互作用为NO3--N去除的主要决定因素.电流对整体反应的贡献率为60.41%,电流与pH的交互作用的贡献率为21.47%;电流与硝酸盐初始浓度为N2生成率的主要决定因素.电流的贡献率为42.78%,硝酸盐初始浓度的贡献率为31.11%. (3)在反应中,电流与pH两者之间的交互作用为拮抗交互作用.在一定的合理范围内,电流的增加可以加快NO3-的去除,提高N2选择率;而pH的升高却降低了NO3-去除反应速率,且降低了N2选择率. 参考文献 [1] 冯肖,刘玉忠,陈雪芬,等.电去离子技术去除电镀含铜废水[J].水处理技术,2011,37(7):96-98. [2] 黄万抚,罗凯,李新冬,等.电渗析技术研究现状与进展[J].过滤与分离,2003,13 (4):20-23. [3] 邓旭亮,荣丽丽,张春燕,等.膜滤浓缩液处理技术研究进展[J].工业水处理,2011,31(6):10-13. [4] 周丽,邓慧萍,刘振中,等.多孔钛板负载Pd-Sn电催化去除硝酸盐氮的研究[J].供水技术,2007,1(5):32-36. [5] 范经华,范彬,鹿道强,等.多孔钛板负载Pd-Cu阴极电催化还原饮用水中硝酸盐的研究[J].环境科学,2006,27(6):1 117-1 122. [6] Vooys A.C.A.,Santen R.A.,Veen J.A.R.Electrocatalytic reduction of NO3-on palladium/copper electrodes[J].Mol Catal A:Chem,2000,154(1-2):203-215. [7] Gootzen J.F.E.,Lefferts L.,Veen J.A.R.Electrocatalytic nitrate reduction palladium based catalysts activated with germanium[J].Appl.Catal.A:General,1999,188(1):127-136. [8] Wang Y.,Qu J.H.The electrocatalytic reduction of nitrate in water on Pd/Sn-modified activated carbon fiber electrode[J].Water Res.,2006,40(6):1 224-1 232. [9] Md.Motahar Hossaina,Kou Nakata.Reduction of nitrate on electrochemically pre-reduced tin-modified palladium electrodes[J].J.Electroanal.Chem.,2013,7(7):59-65. [10] 郑国和.电催化降解饮用水中硝酸盐的实验研究[D].西安:陕西师范大学,2009. [11] HJ/T 346-2007,水质硝酸盐氮的测定[S]. [12] GB7493-87,水质亚硝酸盐的检测定[S]. [13] HJ535-2009,水质氨氮的测定[S]. [14] 曹剑瑜,汤佳丽,宋玲政.EDTA对活性炭的功能化处理及其对炭载Pd催化剂电催化性能的影响[J].物理化学学报.2013,29(1):144-150. [15] Berndt H.,Mönnich I.,Lücke B,et al.Tin promoted palladium catalysts for nitrate removal from drinking water[J].Appl.Catal.B:Environmental,2001,30(1-2):111-122. [16] 茆诗松,周纪芗,陈颖,等.试验设计[M].北京:中国统计出版社,2004:119-135. [17] 黄孟健,薛德平,陈荣三,等.无机与分析化学[M].北京:高等教育出版社,2008:61-64. [18] De Groot M.T.,Koper M.T.M.The influence of nitrate concentration and acidity on the electrocatalytic reduction of nitrate on platinum[J].J.Electroanal.Chem.,2004,562(1):81-94. Optimization study of electrocatalytic reduction high concentration nitrate wastewater with activated carbon fiber loaded Pd/Sn HUA Li1, HU Yang-yang1, ZHANG Geng1, JIA Wei-hua2 (1.College of Resources and Environment, Shaanxi University of Science & Technology, Xi′an 710021, China; 2.Survey & Planning Institution of State Forestry Administiation, Beijing 100010, China) Abstract:Activated carbon fiber loaded Pd/Sn (4∶1) was used as cathode in electrocatalytic reduction.Single factor and orthogonal experiments were employed to investigat the relationships between nitrate removal,nitrogen selectivity with current,initial pH,initial nitrate concentration and solution circulating velocity in high concentration nitrate wastewater,and realized optimum reaction condition.Results showed that the current,interaction of current and initial pH were the major controlling factors of NO3--N removal efficiency.The current and initial nitrate concentration were the major controlling factors of N2selectivity.The optimizated reaction conditions were as follows:current 0.68 A, pH=6.4,initial nitrate concentration 250 mg/L.In this conditions for 6 h,the amount of NO3--N removal from 250 mg/L to 200 mg/L,maximum amount of N2-N selectivity beyond 48%,activity of electroeatalytic denitrification was 20 mg/(g·h). Key words:activated carbon fiber loaded Pd/Sn; electric catalytic reduction; high concentration nitrate wastewater; NO3--N removal; N2selectivity 中图分类号:X523 文献标志码:A 文章编号:1000-5811(2015)01-0030-06 作者简介:花莉(1978-),女,贵州兴义人,副教授,博士,研究方向:固体废弃物处理及有机污染物控制 基金项目:国家自然科学基金项目(41003042); 陕西省大学生创新创业训练计划项目(1060) 收稿日期:*2014-11-16

