干扰P2X7R基因对RAW264.7细胞增殖和吞噬的影响
2016-01-11苏程程,张译丹,马永强等
干扰P2X7R基因对RAW264.7细胞增殖和吞噬的影响*
苏程程1,3▲,张译丹1▲,马永强2,陈雪芬1,向国安1,周欣2,彭守春1,林志春2,魏路清1△,姬文婕1△
(1中国人民武装警察部队后勤学院附属医院呼吸与重症医学科,2天津市心血管重塑与靶器官损伤重点实验室,天津 300162;3河北医科大学,河北 石家庄 050017)
[摘要]目的: 应用RNA干扰技术抑制小鼠巨噬细胞RAW264.7细胞P2X7受体(P2X7R)基因的表达,建立稳定干扰细胞株,并观察其对细胞增殖和凋亡的影响。方法: 用脂质体法将P2X7R shRNA重组质粒转染至RAW264.7细胞,经G418筛选后获得稳定干扰细胞株。细胞分为野生型(WT)组、阴性对照(NC)组和干扰(shP2X7R)组。Real-time PCR法检测细胞中P2X7R mRNA的表达,Western blot检测细胞中P2X7R蛋白的表达;CCK-8方法检测细胞生长活性,5-乙炔基-2’-脱氧尿苷(5-ethynyl-2’-deoxyuridine,EdU)掺入实验检测细胞增殖活性;流式细胞术分析细胞周期的分布和吞噬情况。结果: P2X7R shRNA能明显抑制RAW264.7细胞的P2X7R mRNA和蛋白的表达,抑制率在80%以上。48 h后,shP2X7R组细胞的生长速度明显高于NC组和WT组 (P<0.05),增殖期细胞比例明显升高 (P<0.05),说明下调P2X7R基因能明显促进细胞增殖。shP2X7R组的细胞周期出现改变,S期和G2/M期的比例明显上升,增殖指数增高 (P<0.05)。shP2X7R组的细胞吞噬活性明显高于NC组(P<0.05)。结论: 本研究成功构建了稳定干扰P2X7R基因表达的小鼠巨噬细胞株RAW264.7,shP2X7R能够明显促进RAW264.7细胞的增殖,改变了细胞的吞噬活性。
[关键词]P2X7受体; RNA干扰; RAW264.7巨噬细胞; 细胞增殖; 细胞吞噬
[中图分类号]R363[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.023
[文章编号]1000-4718(2015)11-2070-06
[收稿日期]2015-07-20[修回日期] 2015-09-23
[基金项目]*广东省科技社会发展项目(No. 2012B031800030)
通讯作者△Tel: 020-81332309; E-mail: qkchen@21cn.com
Effect ofP2X7R gene silencing by RNA interference on proliferation and phagocytosis of murine macrophage cell line RAW264.7SU Cheng-cheng1, ZHANG Yi-dan1, MA Yong-qiang2, CHEN Xue-fen1, XIANG Guo-an1, ZHOU Xin2, PENG Shou-chun1, LIN Zhi-chun2, WEI Lu-qing1, JI Wen-jie1
(1DepartmentofRespirologyandCriticalCareMedicine,LogisticsUniversityofChinesePeople’sArmedPoliceForces,2TianjinKeyLaboratoryofCardiovascularRemodelingandTargetOrganInjuryInstituteofCardiovascularDiseaseandHeartCenterTianjin300162,China;3HebeiMedicalUniversity,Shijazhuang050017China.E-mail:ji_wenjie@hotmail.com;wei_luqing@hotmail.com)
ABSTRACT[]AIM: To establish a cell line of stable silencing of P2X7 receptor (P2X7R) expression through short hairpin RNA (shRNA)-mediated interference in murine RAW264.7 macrophages, and to investigate the proliferation and apoptosis in the cell line. METHODS: Stable silencing of P2X7R gene in the RAW264.7 cells was achieved by recombinant shRNA plasmid targeting murine P2X7R gene via liposome mediated transfection, followed by G418 selection. The efficacy of plasmid transfection and P2X7R silencing in G418 resistant cells was verified by immunofluorescent microscopy and real-time PCR, respectively. The proliferative activity was analyzed by CCK-8 assay and EdU cell proliferation assay. The cell cycle distribution and apoptosis were evaluated by flow cytometry. RESULTS: The expression of P2X7R at mRNA and protein levels was down-regulated by 80% in shP2X7R group compared with negative control (NC) plasmid transfection. In addition, P2X7R-silencing cells exhibited higher proliferative activity compared with NC and wild-type RAW264.7 cells (P<0.05). Compared with NC cells, P2X7R silencing resulted in an increase in the phagocytosis of the cells (P<0.05). CONCLUSION: A cell line RAW264.7 of stable silencing of P2X7R expression was successfully established. P2X7R gene silencing stimulates the proliferation, and changes phagocytic function in murine RAW264.7 macrophages.
[KEY WORDS]P2X7receptor; RNA interference; RAW264.7 macrophages; Cell proliferation; Cell phagocytosis
巨噬细胞是天然免疫应答的重要细胞成份,由于其组织分布、分化程度以及外界激活因子的多样性,巨噬细胞具有复杂的异质性与功能的多样性。不同的环境中,巨噬细胞可以具有不同的激活途径,主要有经典激活的M1表型分泌促炎细胞因子,替代激活的M2表型分泌抗炎因子并与损伤修复有关。在以慢性炎症为特征的某些疾病及其病理过程中,均观察到巨噬细胞活化表型的变化。目前研究发现,P2X7受体(P2X7receptor,P2X7R)不仅通过与三磷酸腺苷(adenosine triphosphate,ATP)结合刺激细胞因子类的合成和分泌,诱导炎症反应和巨噬细胞表型的偏移等[1-3],而且P2X7R还参与了介导细胞内的信号转导[4]。本研究采用RNA干扰技术,构建稳定干扰P2X7R基因的小鼠巨噬细胞RAW264.7,观察干扰后其增殖和凋亡等生物学特性的变化,为进一步探讨P2X7R对巨噬细胞的调控作用及其机制,提供有力的分子生物学工具。
材料和方法
1主要试剂
RAW264.7细胞(南开大学生命科学院韩际宏教授惠赠);高糖DMEM培养基、胎牛血清、胰蛋白酶(Hyclone);G-418(Amesco);OPTI MEM转染培养基、LipofectamineTM2000、TRIzol(Invitrogen);CCK-8试剂盒(Dojindo);MMLV反转录酶、dNTPs(Promega);SYBR GreenPCR试剂盒、蛋白酶抑制剂(Roche);EdU-Click 488细胞增殖检测试剂盒、碘化丙啶(Sigma);AnnexinV-FITC凋亡检测试剂盒(Biolegend);BCA蛋白定量试剂盒(Pierce);GAPDH小鼠单克隆抗体、P2X7R小鼠单克隆抗体(Abcam);HRP标记山羊抗小鼠IgG(Abgent);PVDF膜、ECL化学发光试剂盒(Millipore);干扰表达载体系统(上海吉玛制药技术有限公司);其余试剂均为国产分析纯。
2方法
2.1细胞培养小鼠巨噬细胞株RAW264.7用高糖DMEM培养基(含12%胎牛血清、4 mmol/L 谷氨酰胺),置于37 ℃、5% CO2培养箱中培养,取对数生长期细胞用于实验。
2.2P2X7R稳定干扰细胞株的建立分别将携带P2X7R短发夹RNA(short hairpin RNA,shRNA)和阴性对照(negative control,NC)的重组质粒pGPU6/GFP/Neo,按照LipofectamineTM2000说明书进行细胞转染,简述如下:将对数生长期的RAW264.7细胞计数后接种于6孔板,每孔4×105个,使转染时细胞达到80%~90%的融合。细胞分为野生型(wild type,WT)组、NC组和转染质粒pGPU6/GFP/Neo-P2X7R(RNA interference by P2X7R-shRNA, shP2X7R)组。质粒DNA用量为每孔4 μg,转染后36 h用G418(500 mg/L)筛选转染细胞,然后挑取单克隆进行扩大培养,传代3次以上,real-time PCR法和Western blot法检测P2X7R的干扰效果,若细胞状态稳定,则表明稳定转染细胞系构建成功。
2.3Real-time PCR法检测细胞中P2X7R mRNA的表达情况按照TRIzol说明书提取各组细胞的总RNA,反转录成cDNA,然后用SYBR Green法进行PCR扩增,同一样本设2个复孔,实验重复3次。P2X7R正义链为5’-CAGTCACTGGAGGAACTGGAA-3’,反义链为5’-CCAAAGGAAACACACCGATT-3’,扩增产物长度为77 bp ;β-actin正义链为5’-CTAAGGCCAACCGTGAAAAG-3’,反义链为5’-ACCAGAGGCATACAGGGACA-3’,扩增产物长度为104 bp 。扩增条件为:50 ℃ 2 min, 95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1min,共40个循环。以上引物均由北京三博远志生物技术有限公司合成。用2-ΔΔCt法对扩增结果进行分析。
2.4Western blot法检测细胞中P2X7R蛋白的表达情况分别提取各组细胞总蛋白,采用BCA法定量蛋白浓度,将经过95 ℃ 10 min变性处理的蛋白样品进行SDS-PAGE,半干法转膜;5%的脱脂奶粉溶液封闭,分别加入GAPDH小鼠单克隆抗体(1∶1 000)、P2X7R小鼠单克隆抗体(1∶2 000),4 ℃过夜;次日加入HRP标记山羊抗小鼠IgG,室温孵育1 h,PBST洗涤15 min 3次;ECL化学底物发光法显色,Image Lab 4.0软件进行图像灰度分析, P2X7R的蛋白相对表达量用其与GAPDH的灰度比值表示。
2.5CCK-8测定细胞生长水平分别将对数生长期的WT组、NC组和shP2X7R组RAW264.7细胞计数后,接种于96孔板,每孔103个,每组均设6个复孔,分别于培养24 h、48 h、72 h、96 h后,每孔加入CCK-8 10 μL,继续培养4 h后,测定450 nm波长处吸光度(A)值。实验重复3次,计算平均值,根据各组细胞每天的A值绘制细胞生长曲线。
2.6EdU法检测细胞增殖活性按照EdU细胞检测试剂盒的操作说明进行,简述如下:分别接种对数生长期的WT组、NC组和shP2X7R组RAW264.7细胞于12孔细胞培养板中,每孔接种2×105个细胞,在培养24 h、48 h、72 h、96 h后,换含10 μmol/L EdU的培养基1 mL,孵育1 h后,4%多聚甲醛固定15 min,0.5% Triton X-100室温破膜20 min,加入click-reaction mixture(含1 mol/L pH 8.5 Tris-HCl 50 μL,25 mmol/L CuSO420 μL,10 mmol/L 6-FAM-Azide 2.5 μL,0.5 mol/L抗坏血酸50 μL,去离子水补足体系至500 μL)室温避光孵育30 min,然后用DAPI染DNA,最后用Leica DMZ 3000荧光显微镜观察并采集图像。每个样本随机选取10个视野,细胞增殖率按照高倍视野下EdU阳性细胞数占总细胞数的百分比计算。
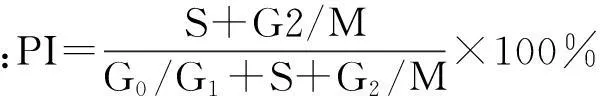
2.8流式细胞术检测细胞吞噬活性按照荧光素标记大肠杆菌吞噬试剂盒操作说明进行测定。简述如下:取各组对数生长期细胞,调整细胞密度为1×109/L,接种于96孔板,每孔105个细胞,每组设3个复孔。0.5 mL HBSS与荧光素标记的E.colik-12微粒超声混匀后,移入含4.5 mL Milli Q水的棕色小瓶中,再次超声充分混匀。每孔加入100 μL微粒悬液,轻轻混匀,CO2培养箱中孵育2 h后,去除上清,加入100 μL 0.25 g/L台盼蓝溶液1 min,吸出上清,加入培养基,收集细胞悬液,Beckman Coulter FC500流式细胞仪分析,计算各组细胞的平均荧光强度(mean fluorescence intensity,MFI),表示吞噬活性的强弱。
3统计学处理
采用SPSS 19.0软件进行统计分析,计量资料以均数±标准误(mean±SEM)表示。组间的比较采用t检验和单因素方差分析,各组均数多重比较采用Tukey’s法。单变量配对资料之间的比较采用配对样本t检验。以P<0.05为差异有统计学意义。
结果
1P2X7R mRNA和蛋白的表达水平
用2-ΔΔCt法对PCR结果进行分析,shRNA组的P2X7R mRNA水平明显低于WT组和NC组(P<0.05),抑制率为80%左右,而NC组和WT组之间差异不显著;Western blot结果表明,与NC组相比,shP2X7R组的P2X7R蛋白表达水平明显下调(P<0.05),而NC组和WT组之间的P2X7R蛋白表达水平无明显变化。上述结果说明成功构建了P2X7R稳定干扰细胞株,见图1、2。
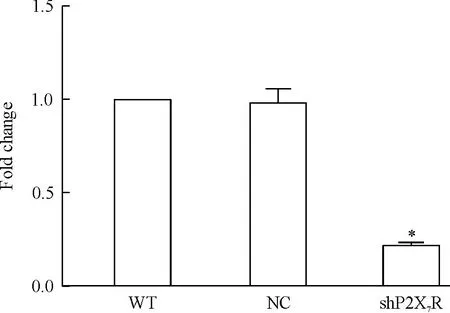
Figure 1.The mRNA expression of P2X7R in the RAW264.7 cells determined by real-time PCR analysis. Mean±SEM.n=3.*P<0.05vsNC and WT.
图1各组RAW264.7细胞中P2X7R mRNA的表达
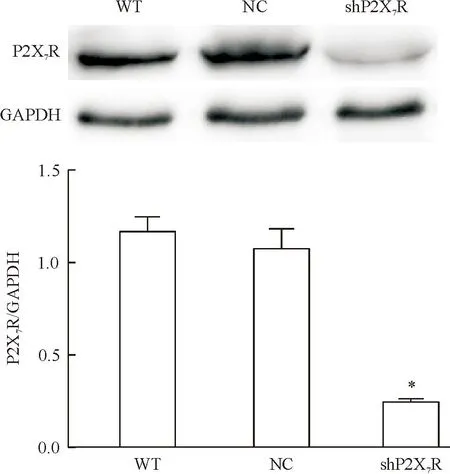
Figure 2.The protein expression of P2X7R in the RAW264.7 cells determined by Western blot. Mean±SEM.n=3.*P<0.05vsNC and WT.
图2各组RAW264.7细胞中P2X7R 蛋白的表达
2P2X7R shRNA对RAW264.7细胞生长的影响
如细胞生长曲线所示,WT组和NC组之间的细胞增殖活性没有显著差异,而48 h后,shP2X7R组细胞的生长明显高于前2组(P<0.05),说明下调P2X7R基因能明显促进细胞生长,见图3。

Figure 3.Cell growth curve of RAW264.7 cells obtained by CCK-8 assay. Mean±SEM.n=3.**P<0.01vsNC and WT.
图3P2X7R shRNA对RAW264.7细胞生长水平的影响
3P2X7R shRNA对RAW264.7细胞增殖活性的影响
EdU法检测结果如图4所示,与NC组相比,shP2X7R组的细胞增殖活性明显升高(P<0.05),NC组和WT组比较无明显差异。说明下调P2X7R基因能明显提高细胞的增殖活性。
4P2X7R shRNA对RAW264.7细胞周期的影响
与WT组和NC组相比,shP2X7R组的细胞周期分布出现改变,G0/G1期比例降低,S期和G2/M期的比例增高,增殖指数明显升高(P<0.05);而WT组与NC组的细胞周期分布无明显差异,见表1。
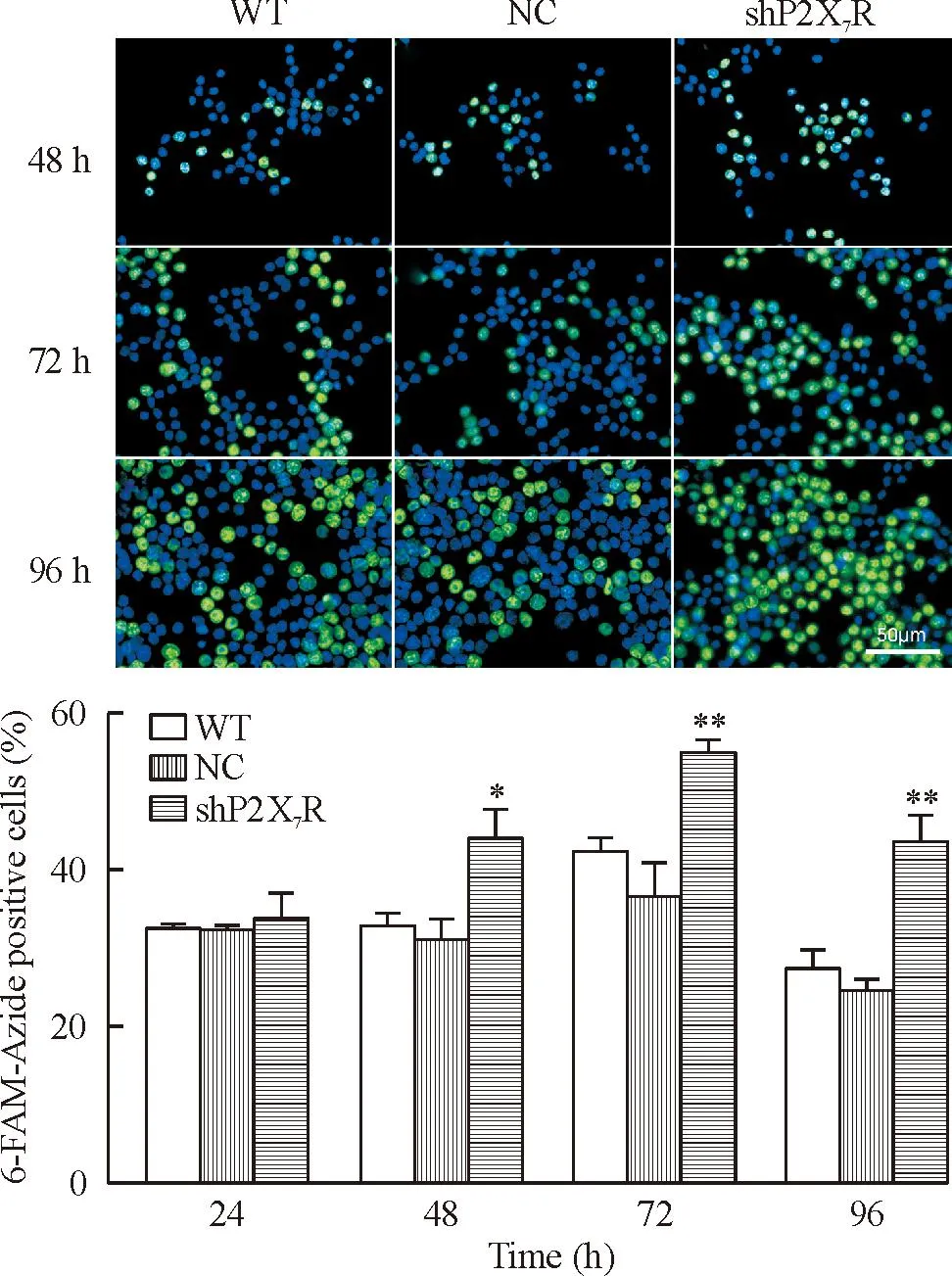
Figure 4.Detection of EdU incorporated into the DNA of RAW264.7 cells by fluorescence microscopy. Mean±SEM.n=3.*P<0.05,**P﹤0.01vsNC and WT.
图4EdU法检测P2X7R shRNA对RAW264.7细胞增殖活性的影响
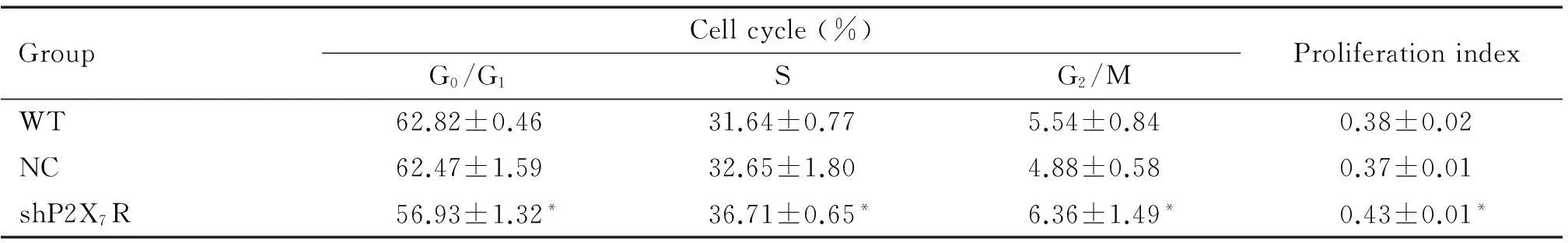
表1 各组细胞周期的分布及增殖指数的变化
*P<0.05vsWT and NC.
5P2X7R shRNA对RAW264.7细胞吞噬活性的影响
小鼠巨噬细胞RAW264.7吞噬FITC标记的大肠杆菌后流式分析结果显示,各组细胞的平均荧光强度分别为:WT组(120.0±3.61)、NC组(47.66±6.78)和shP2X7R组(82.97±8.69)。WT组的细胞吞噬活性最强,其次是shP2X7R组,而NC组的吞噬活性最弱,差异均有统计学意义(P<0.05),见图5。由于NC转染引起细胞吞噬功能下降。因此该结果尚需后续实验进一步验证。
讨论
巨噬细胞是研究细胞吞噬、细胞免疫和分子免疫学的重要对象,在不同环境中,巨噬细胞可以发生不同性质的活化,成为具有不同分子表型和功能特征的亚群,从而决定了其在各种环境和不同疾病中发挥的作用[5]。目前认为巨噬细胞至少存在2种活化状态,经典活化(M1)和替代活化(M2)。M1巨噬细胞通常认为是经干扰素γ激活,主要表现为促进炎症和氧化应激反应、增强的吞噬活性;M2巨噬细胞主要经IL-4和IL-13激活,主要表现为抑制炎症反应,并与组织的修复和纤维化过程有关[6]。两种状态的平衡对于机体维持正常的免疫功能是必须的,任何一种活化失衡状态都可能对组织炎症的恢复产生不良的影响。
P2X7R是一种ATP门控型离子通道,在巨噬细胞、树突状细胞和小胶质细胞高表达[7],参与了细胞的多种病理生理过程,包括细胞增殖、分化和凋亡、单核巨噬细胞分泌细胞因子以及细胞介导的细胞毒性作用等[8-11]。细胞外ATP与P2X7R结合引发的寡聚化反应,使离子通道迅速开放,产生K+外流,引起胞内K+的迅速耗竭,进而激活NALP3炎症复合体。正常情况下,胞外ATP的浓度受到胞外ATP酶和ADP酶的严格调控而处于低水平,出现组织损伤时,ATP大量释放至细胞外间隙,并以旁分泌的形式通过临近细胞的P2X7R进一步促发炎症反应[7, 12]。因此,通过对P2X7R的调控,调节巨噬细胞功能,可能成为潜在的慢性炎症及相关疾病的治疗和预防靶点之一。
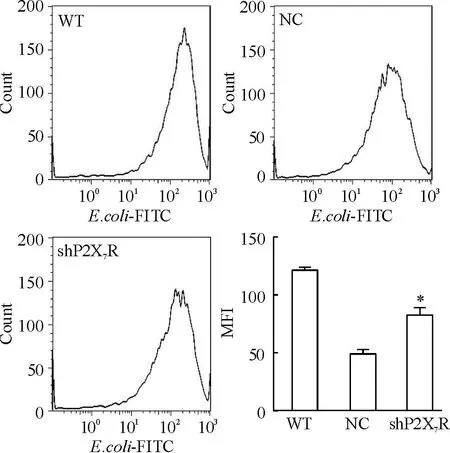
Figure 5.Evaluation of phagocytic function by flow cytometry withE.coli-FITC. Representative histograms of count (y-axis)vsFITC (x-axis) were showed. Mean±SEM.n=3.*P<0.05vsNC.
图5shP2X7R对RAW264.7细胞吞噬功能的影响
本研究中采用基于质粒载体的shRNA系统,用脂质体将重组质粒pGPU6/GFP/Neo-P2X7R shRNA转染至小鼠巨噬细胞RAW264.7,获得稳定干扰细胞株。实验结果表明P2X7R shRNA有效地抑制了RAW264.7细胞中P2X7R的 mRNA和蛋白表达,明显促进了RAW264.7细胞的生长和增殖活性,S期和G2/M期的比例明显升高。但是目前尚未阐明P2X7R对巨噬细胞的调控途径和机制,以及在此过程中与其它信号转导通路之间的相互关系等。因此,本实验中成功构建的稳定干扰细胞株将为进一步探讨P2X7R在巨噬细胞相关的病理生理过程的作用和机制,提供有力的研究工具和奠定初步的实验基础。
[参考文献]
[1]Burnstock G, Boeynaems JM. Purinergic signalling and immune cells[J]. Purinergic Signal, 2014, 10(4): 529-564.
[2]Hasko G, Pacher P. Regulation of macrophage function by adenosine[J]. Arterioscler Thromb Vasc Biol, 2012, 32(4):865-869.
[3]Tschopp J, Schroder K. NLRP3 inflammasome activation: The convergence of multiple signalling pathways on ROS production?[J]. Nat Rev Immunol, 2010, 10(3): 210-215.
[4]Velasquez S, Eugenin EA. Role of Pannexin-1 hemichannels and purinergic receptors in the pathogenesis of human diseases[J]. Front Physiol, 2014, 5:96.
[5]Italiani P, Boraschi D. From monocytes to M1/M2 macrophages: phenotypical vs. functional differentiation[J]. Front Immunol, 2014, 5:514.
[6]Gordon S, Martinez FO. Alternative activation of macrophages: mechanism and functions[J]. Immunity, 2010, 32(5): 593-604.
[7]Jacob F, Perez Novo C, Bachert C, et al. Purinergic signaling in inflammatory cells: P2 receptor expression, functional effects, and modulation of inflammatory responses[J]. Purinergic Signal, 2013, 9(3):285-306.
[8]Budagian V, Bulanova E, Brovko L, et al. Signaling through P2X7 receptor in human T cells involves p56lck, MAP kinases, and transcription factors AP-1 and NF-kappa B[J]. J Biol Chem, 2003, 278(3):1549-1560.
[9]Wilson HL, Francis SE, Dower SK, et al. Secretion of intracellular IL-1 receptor antagonist (type 1) is dependent on P2X7 receptor activation[J]. J Immunol, 2004, 173(2):1202-1208.
[10]Taylor SR, Gonzalez-Begne M, Dewhurst S, et al. Sequential shrinkage and swelling underlie P2X7-stimulated lymphocyte phosphatidylserine exposure and death[J]. J Immunol, 2008, 180(1):300-308.
[11]Junger WG. Immune cell regulation by autocrine purinergic signalling[J]. Nat Rev Immunol, 2011, 11(3):201-212.
[12]Mariathasan S, Weiss DS, Newton K, et al. Cryopyrin activates the inflammasome in response to toxins and ATP[J]. Nature, 2006, 440(7081):228-232.
(责任编辑: 陈妙玲, 余小慧)

