miR-21在周围神经损伤时调控雪旺细胞凋亡
2016-01-11陆新华,王辉,宁昕杰等
miR-21在周围神经损伤时调控雪旺细胞凋亡*
陆新华,王辉△,宁昕杰,罗骏成,梁家骥
(中山大学附属第三医院神经外科,广东 广州 510630)
[摘要]目的: 探讨周围神经损伤时,微小RNA-21(microRNA-21,miR-21)与雪旺细胞(SC)凋亡的关系及相关分子机制。 方法: 采用实时荧光定量PCR(real-time PCR)检测动物模型中miR-21以及人第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homologue deleted on chromosome 10,PTEN)的表达情况;通过将miR-21类似物(miR-21-mimic)、miR-21抑制物(miR-21-inhibitor)和阴性对照miRNA(negative control miRNA,NC-miRNA)转染入RSC96细胞中,构建出过表达miR-21的雪旺细胞株(MI-SC)、抑制miR-21表达的雪旺细胞株(IN-SC)及表达对照miRNA的雪旺细胞株(NC-SC);采用流式细胞仪检测3组细胞的凋亡情况; real-time PCR检测3组细胞中miR-21以及PTEN的表达情况;Western blot检测3组细胞中PTEN及凋亡相关蛋白激活型caspase-3(cleaved caspase-3)的表达情况。结果: 神经损伤组miR-21的表达量与对照组相比明显升高,神经损伤组PTEN mRNA的表达水平与对照组相比明显降低;与NC-SC相比,上调miR-21组细胞的凋亡比例减少,PTEN mRNA及蛋白的表达水平降低,cleaved caspase-3的表达水平降低,下调miR-21组细胞的凋亡比例增加,PTEN mRNA及蛋白的表达水平升高,cleaved caspase-3的表达水平升高(P<0.05)。结论: miR-21可能通过下调PTEN的表达抑制雪旺细胞的凋亡,从而可能在周围神经的损伤修复中发挥作用。
[关键词]周围神经损伤; 微小RNA-21; 雪旺细胞; 细胞凋亡
[中图分类号]R363[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.020
[文章编号]1000-4718(2015)11-2053-06
[收稿日期]2015-04-29[修回日期] 2015-07-28
[基金项目]*国家自然科学基金资助项目(No. 81173580)
通讯作者△Tel: 0411-87586009; E-mail: jingxianyang@yahoo.com
miR-21 inhibits apoptosis of Schwann cells following peripheral nerve injuryLU Xin-hua, WANG Hui, NING Xin-jie, LUO Jun-cheng, LIANG Jia-ji
(DepartmentofNeurosurgery,TheThirdAffiliatedHospital,SunYat-senUniversity,Guangzhou510630,China.E-mail:doctorwanghui@126.com)
ABSTRACT[]AIM: To explore the relationship and molecular mechanism between microRNA-21(miR-21) and Schwann cells (SC) following peripheral nerve injury. METHODS: The mRNA expression of miR-21 and phosphatase and tensin homologue deleted on chromosome ten (PTEN) in animal model were detected by real-time PCR. The over-expression of miR-21 and inhibition of miR-21 expression in the Schwann cells according to transfection of lentiviral vectors were performed, the nonspecific miRNA was used as a negative control (NC). The cell apoptosis was measured by flow cytometry. The mRNA expression of miR-21 and PTEN in the cells was detected by real-time PCR. The protein expression of PTEN and cleaved caspase-3 was determined by Western blot. RESULTS: The level of miR-21 was significantly higher and the mRNA level of PTEN was significantly lower in the model of nerve injury than those in control group. miR-21 over-expression decreased the number of apoptotic Schwann cells compared with NC-SC. The mRNA expression of PTEN was down-regulated by over-expression of miR-21. The protein expression of PTEN and cleaved caspase-3 was down-regulated by over-expression of miR-21 (P<0.05). CONCLUSION: miR-21 may play an important role in the peripheral nerve injury through inhibiting apoptosis of Schwann cells by down-regulating the expression of PTEN.
[KEY WORDS]Peripheral nerve injury; MicroRNA-21; Schwann cells; Apoptosis
众所周知,周围神经损伤后是可修复再生的,而作为周围神经系统的主体细胞,雪旺细胞(Schwann cells ,SC)在其中发挥了重要作用。周围神经损伤后,SC十分活跃[1-2],包括增殖并趋化巨噬细胞、分泌神经营养因子及细胞外基质及与再生轴突形成缝隙连接和紧密连接等。这对于维持神经元的存活,引导轴突再生,促进髓鞘成熟至关重要,从而在周围神经修复再生中发挥作用。然而由于内外环境因素的影响,以及对其修复再生的机制尚未完全清楚,加之周围神经特殊的解剖结构和功能,使得目前临床采用的各种神经修复及吻合技术效果都不十分理想,功能恢复欠佳[3]。为此,周围神经损伤后修复再生的影响因素及细胞分子机制还有待进一步研究。
微小RNA(microRNA,miRNA)是近年来新发现的一类非编码小分子RNA,长度约为22~28个核苷酸,广泛存在于真核生物中。miRNA通过与靶mRNA的3’UTR完全或不完全的互补结合,导致靶mRNA降解或翻译抑制,从而调控靶基因的表达,影响细胞增殖、分化和凋亡[4]。有研究指出,在神经系统领域,miRNA参与细胞生长、增殖、分化、迁移、凋亡[5]以及神经突再生[6]。miRNA在周围神经再生中的作用近年来也受到关注[7-8]。有研究指出,在中枢神经系统损伤后,如脊髓挫裂伤、创伤性脑损伤以及脑缺血后,miR-21的表达量升高[9-14],而在周围神经系统,切断大鼠坐骨神经后,miR-21的表达明显升高,且能促进轴突再生[15-16]。我们前期的研究工作已证实miR-21可在SC中表达[17]。然而目前的研究均未对miR-21与SC的关系及分子机制进行深入探讨。
本实验中,我们旨在研究miR-21对SC凋亡的调控及分子机制。通过研究我们发现,miR-21可能通过下调人第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homologue deleted on chromosome 10,PTEN)的表达抑制雪旺细胞的凋亡,从而可能在周围神经损伤的修复再生中发挥作用。
材料和方法
1材料
30只150~180 g雄性实验用SD大鼠购自中山大学北校区动物实验中心;RSC96雪旺细胞株购自中国科学院细胞库;DMEM/F12培养基、胎牛血清(HyClone);RNA抽提试剂、RNA逆转录试剂盒、SYBR Premix Ex TaqTM荧光定量PCR试剂盒(TaKaRa);miR-21、U6、PTEN、GAPDH逆转录引物及引物对(上海吉玛生物公司);Lipofectamine 2000、miR-21类似物(mimic)、抑制物(inhibitor)及阴性对照序列(negative control miRNA, NC- miRNA)(Invitrogen);细胞凋亡检测试剂盒Annexin V-PE/7-AAD、全蛋白提取试剂盒、BCA蛋白含量检测试剂盒、ECL检测试剂盒(南京凯基生物公司);PTEN和cleaved caspase-3兔抗鼠单克隆抗体(CST);GAPDH兔抗鼠多克隆抗体(广州杰特伟生物公司);HRP标记羊抗兔IgG(北京博奥森生物公司);0.22 μm PVDF膜(Millipore)。
2方法
2.1神经损伤模型建立将30只雄性成年SD大鼠随机分为神经损伤组、假手术组和正常对照组。静脉复合麻醉,左下肢做纵切口,逐层分离,暴露坐骨神经上段。损伤模型组分离外膜后完全横断坐骨神经后逐层缝合组织;假手术组逐层暴露坐骨神经后缝合组织;正常对照组不做处理。7 d后检测miR-21以及PTEN的mRNA表达水平。
2.2细胞培养RSC96细胞用含10%胎牛血清的DMEM/F12培养基,在37 ℃、5% CO2、饱和湿度的细胞培养箱中培养,含EDTA的0.25%胰酶消化传代。
2.3细胞转染将状态良好、对数生长期RSC96细胞于转染前24 h接种于6孔板中,培养至细胞达80%融合度时进行细胞转染,严格按照操作说明将带有绿色荧光蛋白的miR-21-mimic、miR-21-inhibitor和NC-miRNA转染入RSC96细胞中,构建出过表达miR-21的SC株(MI-SC)、抑制miR-21表达的SC株(IN-SC)及表达对照miRNA的SC株(NC-SC)。37 ℃、5% CO2、饱和湿度的细胞培养箱中继续培养,倒置相差显微镜观察拍摄,采用Image J software进行GFP阳性细胞数检测。
2.4流式细胞术检测细胞凋亡用不含EDTA的胰酶消化收集细胞。用预冷的PBS洗涤细胞2次,每次均在2 000 r/min,离心5 min,收集(1~5)×105细胞。在50 μL的binding buffer中加入5 μL 7-AAD染液,混匀;收集细胞中加入上述7-AAD染液,混匀,室温,避光反应5~15 min;反应后再加450 μL的binding buffer混匀;加入1 μL Annexin V-PE混匀,室温,避光反应5~15 min;样品在1 h 内用流式细胞仪检测。结果用FlowJo软件分析,Q2代表早期凋亡,Q3代表晚期凋亡。
2.5Real-time PCR检测细胞中miR-21以及PTEN的表达提取RNA:用TRIzol提取细胞及组织总RNA,经分光光度计检测,A260/A280值为1.8~2.0的用于cDNA合成。逆转录反应:按说明进行,反应条件为:37 ℃ 15 min,85 ℃ 5 s。PCR按说明进行,反应条件为:95 ℃30 s;95 ℃ 5 s,60 ℃ 34 s,扩增40个循环。miR-21以及PTEN的相对表达量采用2-ΔΔCt法计算。miR-21相对表达量:ΔCt=CtmiR-21-CtU6,ΔΔCt=ΔCt实验组-ΔCt对照组;PTEN相对表达量:ΔCt=CtPTEN-CtGAPDH,ΔΔCt=ΔCt实验组-ΔCt对照组。miR-21、PTEN、U6和GAPDH相应的逆转录引物以及PCR引物系列[10]见表1。

表1 miR-21、PTEN、U6和GAPDH的引物系列
2.6Western blot检测PTEN及凋亡相关蛋白cleaved caspase- 3的表达收集细胞,用全蛋白提取试剂盒提取蛋白质样品。用BCA法在酶标仪上用A562 nm波长测定总蛋白浓度。样本经过SDS-PAGE分离蛋白后,再用电转仪以200 mA 恒流90 min转印至PVDF膜,5%脱脂奶粉室温封闭1 h,TBST洗膜3次, 每次5 min,分别加入cleaved caspase-3、PTEN和GAPDH的 I 抗,4 ℃摇床孵育过夜,TBST洗膜3次,每次5 min。再加HRP标记的Ⅱ抗室温孵育1 h,TBST洗膜3次,每次5 min。ECL化学发光试剂盒显影。
3统计学处理
数据均以均数±标准差(mean±SD)表示,所得数据均采用SPSS 13.0统计软件进行分析。3组之间均数的比较采用单因素方差分析及Bonferroni法。以P<0.05为差异有统计学意义。
结果
1miR-21以及PTEN在神经组织中的表达
Real-time PCR检测结果显示神经损伤组中miR-21的表达量明显高于假手术组和正常对照组(P<0.01);但PTEN的表达量明显低于假手术组和正常对照组(P<0.05);假手术组和正常对照组中miR-21以及PTEN的表达量相近,见图1。
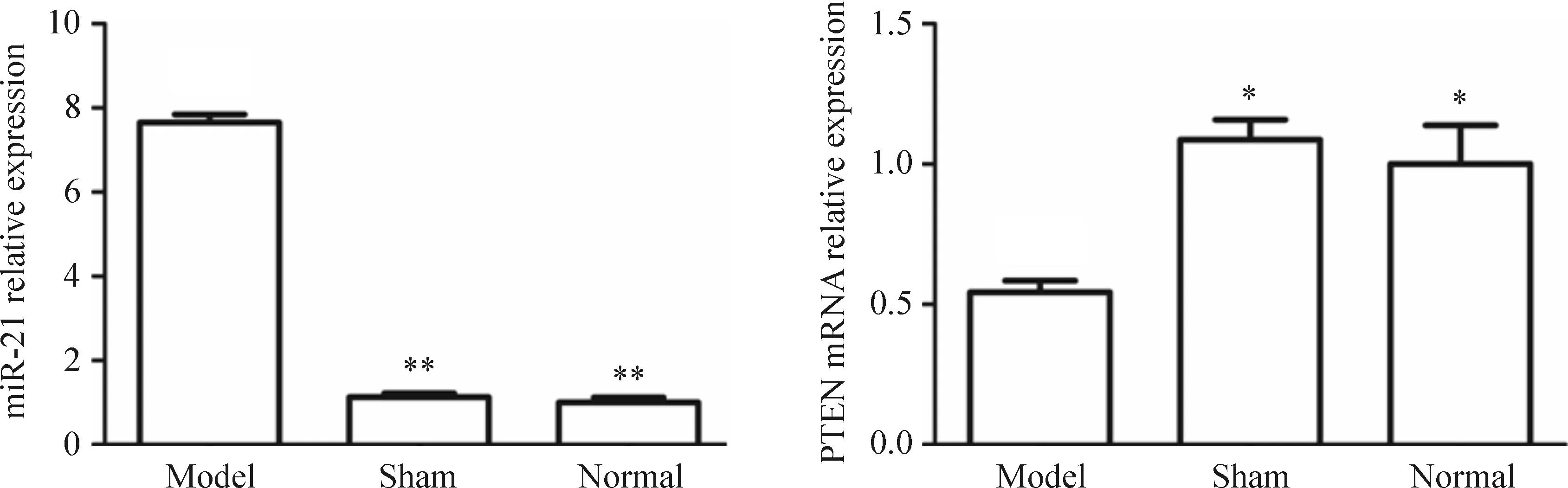
Figure 1.The relative expression of miR-21 was higher but the mRNA relative expression of PTEN was lower in model group than those in control groups. Mean±SD.n=3.*P<0.05,**P<0. 01vsmodel group.
图1Real-time PCR检测神经组织中miR-21以及PTEN的表达
2miR-21在3组细胞中的表达
倒置相差显微镜拍摄细胞转染结果显示,3 组细胞的转染率均在90%以上,见图2。MI-SC细胞中miR-21表达量明显高于NC-SC细胞,IN-SC细胞中miR-21表达量明显低于NC-SC细胞,(P<0.01),见图3。
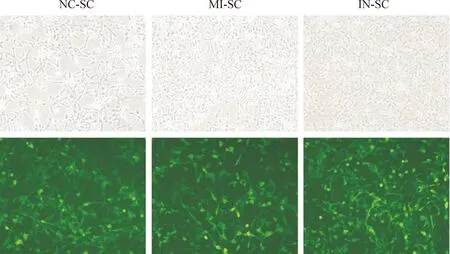
Figure 2.Transfection efficiency of miR-21 in NC-SC cells, MI-SC cells and IN-SC cells(×100).
图2NC-SC、MI-SC和IN-SC 3组细胞的转染情况
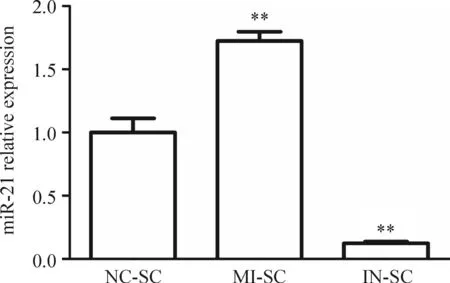
Figure 3.The relative expression of miR-21 in NC-SC, MI-SC and IN-SC cells was detected by real-time PCR. Mean±SD.n=3.**P<0.01vsNC-SC group.
图3Real-time PCR检测NC-SC、MI-SC和IN-SC 3组细胞中miR-21的表达
3miR-21对SC凋亡的影响
流式细胞术检测细胞凋亡的结果显示,IN-SC细胞凋亡比例明显高于NC-SC细胞,MI-SC细胞凋亡比例明显低于NC-SC细胞(P<0.05),见图4。
4miR-21对细胞中PTEN mRNA表达水平的影响
MI-SC细胞中PTEN的表达量明显低于NC-SC细胞(P<0.01),而IN-SC细胞中PTEN的表达量高于NC-SC细胞(P<0.05),见图5。
5miR-21对细胞中PTEN及cleaved caspase- 3蛋白表达水平的影响
Western blot 检测结果显示,与NC-SC组细胞相比,MI-SC组细胞中的PTEN和cleaved caspase-3 蛋白表达量明显下降(P<0.01);与NC-SC组细胞相比,IN-SC组细胞中的PTEN和cleaved caspase-3 蛋白表达量明显升高(P<0.05),见图6。
讨论
周围神经损伤后修复再生是神经科学的重点也是难点[18]。SC作为周围神经系统的主体细胞,在周围神经损伤修复再生中发挥着重要作用[1-2],可以说,周围神经修复再生的研究在相当程度上是对SC的研究。然而目前对于SC的认识仍比较肤浅,如SC凋亡的分子调控机制如何?其下游的具体信号通路如何?这些都还有待进一步研究。
有研究指出,miRNA可能在周围神经的损伤修复中发挥重要作用,坐骨神经损伤后,损伤处miR-21的表达量升高最明显[15-16]。miR-21是一种位于17q23.2染色体FRA17B脆性区域上,且具有自主转录单位的miRNA[19],大量实验证明在多种肿瘤细胞中miR-21的表达均出现显著异常,参与调控多种抑癌基因的表达,提示miR-21作为一个致癌miRNA,在多种肿瘤疾病的发生和发展中发挥着重要的作用[20]。此外,也有研究指出,miR-21可能在心血管疾病、肾脏疾病以及免疫系统疾病中发挥作用[21]。然而它是如何在周围神经系统中发挥作用以及作用机制如何尚不清楚。本研究中,我们发现过表达miR-21能够抑制SC的凋亡,这或许是它在周围神经修复再生中发挥作用的关键。
进一步研究我们发现,miR-21可能通过下调PTEN的表达从而抑制SC的凋亡。有研究指出,大约有2/3的miR-21的潜在靶基因与细胞凋亡的信号通路相关[22]。利用miRander、PicTar和TargetScan 3种miRNA常用靶基因预测软件对miR-21的靶基因进行预测,查阅相关文献,以及利用KEGG信号通路数据库对预测基因进行分析,我们发现,PTEN与细胞的生长及凋亡关系密切。PTEN基因是第1个具有双特异性磷酸酶活性的抑癌基因,不仅参与细胞周期的调控,而且调节细胞的正常生长和发育,最终促进细胞凋亡。大量的研究已证明PTEN主要通过使3,4,5,-三磷酸脂酰肌醇去磷酸化,达到阻止细胞生长和促进细胞凋亡的目的。PTEN基因是继p53之后,另一个在肿瘤细胞中突变与缺失较为广泛,与细胞的生长及凋亡关系密切的抑癌基因。近来有研究指出,在结直肠癌中,过表达PTEN联合锂可以促进细胞凋亡[23]。本研究中,过表达miR-21后PTEN的mRNA及蛋白表达水平明显降低,其下游的细胞凋亡相关蛋白cleaved caspase-3的表达量也明显降低,而下调miR-21后PTEN的mRNA及蛋白表达水平明显升高,其下游的细胞凋亡相关蛋白cleaved caspase-3的表达量也明显升高。
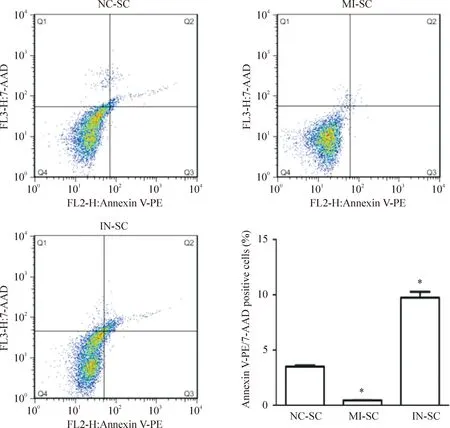
Figure 4.The effects of miR-21 transfection on the apoptosis of Schwann cells detected by flow cytometry.Mean±SD.n=3.*P<0.05vsNC-SC group.
图4流式细胞术检测3组细胞的凋亡情况
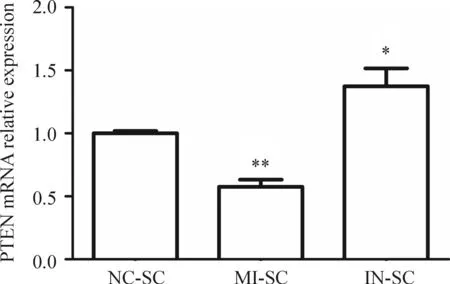
Figure 5.The relative expression of PTEN in NC-SC, MI-SC and IN-SC cells was detected by real-time PCR. Mean±SD.n=3.*P<0.05,**P<0.01vsNC-SC group.
图5Real-time PCR检测NC-SC、MI-SC和IN-SC 3组细胞中PTEN的表达
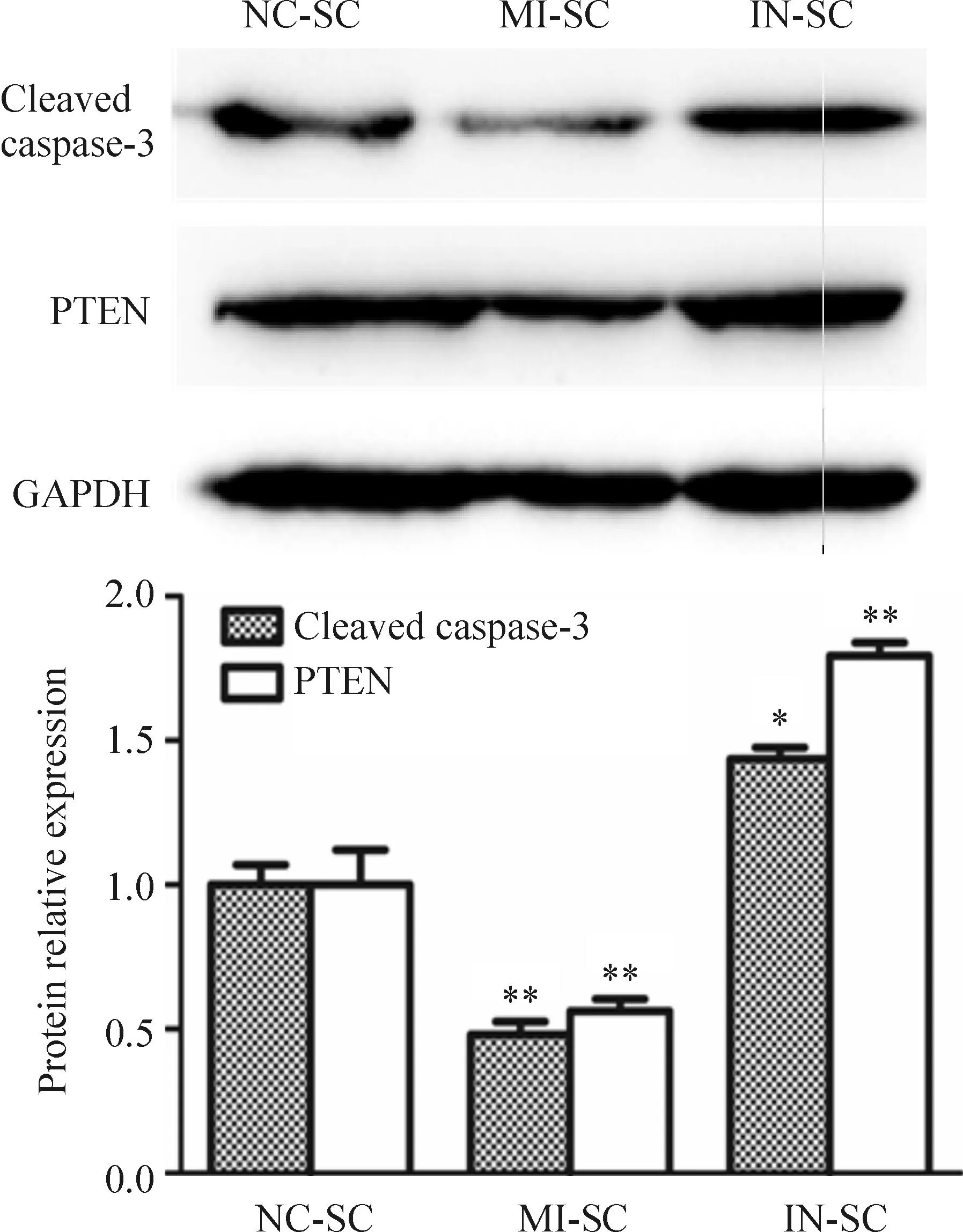
Figure 6.The relative expression of PTEN and cleaved caspase-3 in NC-SC, MI-SC and IN-SC cells detected by Western blot. Mean±SD.n=3.*P<0.05,**P<0.01vsNC-SC group.
图6Western blot检测NC-SC、MI-SC和IN-SC 3组细胞中PTEN及cleaved caspase-3的蛋白表达
总之,通过实验我们发现,miR-21可以通过下调PTEN的表达减少雪旺细胞的凋亡,从而可能在周围神经修复再生中发挥作用。由于目前尚处于体外实验阶段,对于miR-21能否在体内促进神经修复再生,还有待实验进一步验证。
[参考文献]
[1]Madduri S, Gander B. Schwann cell delivery of neurotrophic factors for peripheral nerve regeneration[J]. J Peripheral Nervous System, 2010, 15(2):93-103.
[2]Webber CA, Christie KJ, Cheng CHU, et al. Schwann cells direct peripheral nerve regeneration through the Netrin-1 receptors, DCC and Unc5H2[J]. Glia, 2011, 59(10):1503-1517.
[3]吴林清, 殷超, 景尚斐, 等. 周围神经损伤后修复再生的研究进展[J]. 中华临床医师杂志:电子版,2014,8(7): 122-125.
[4]Ambros V. The functions of animal microRNAs[J]. Nature, 2004, 431(7006): 350-355.
[5]Chen LJ, Lim SH, Yeh YT, et al. Roles of microRNAs in atherosclerosis and restenosis[J]. J Biomed Sci, 2012, 19(1):1-13.
[6]Vo N, Klein ME, Varlamova O, et al. A cAMP-response element binding protein-induced microRNA regulates neuronal morphogenesis[J]. Proc Natl Acad Sci U S A, 2005, 102(45):16426-16431.
[7]Zhou S, Yu B, Qian T, et al. Early changes of microRNAs expression in the dorsal root ganglia following rat sciatic nerve transection[J]. Neurosci Lett, 2011, 494(2):89-93.
[8]Wu D, Raafat A, Pak E, et al. Dicer-microRNA pathway is critical for peripheral nerve regeneration and functional recoveryinvivoand regenerative axonogenesisinvitro[J]. Exp Neurol, 2012, 233(1):555-565.
[9]Hu JZ, Huang JH, Zeng L, et al. Anti-apoptotic effect of microRNA-21 after contusion spinal cord injury in rats[J]. J Neurotrauma, 2013, 30(15):1349-1360.
[10]Han Z, Chen F, Ge X, et al. miR-21 alleviated apoptosis of cortical neurons through promoting PTEN-Akt signaling pathwayinvitroafter experimental traumatic brain injury[J]. Brain Res, 2014, 1582:12-20.
[11]Lei P, Li Y, Chen X, et al. Microarray based analysis of microRNA expression in rat cerebral cortex after traumatic brain injury[J]. Brain Res, 2009, 1284:191-201.
[12]Redell JB, Liu Y, Dash PK. Traumatic brain injury alters expression of hippocampal microRNAs: potential regulators of multiple pathophysiological processes[J]. J Neurosci Res, 2009, 87(6):1435-1448.
[13]Zhang L, Dong LY, Li YJ, et al. miR-21 represses FasL in microglia and protects against microglia-mediated neuronal cell death following hypoxia/ischemia[J]. Glia, 2012, 60(12):1888-1895.
[14]Buller B, Liu X, Wang X, et al. MicroRNA-21 protects neurons from ischemic death[J]. FEBS J, 2010, 277(20):4299-4307.
[15]Strickland IT, Richards L, Holmes FE, et al. Axotomy-induced miR-21 promotes axon growth in adult dorsal root ganglion neurons[J]. PloS One, 2011, 6(8): e23423.
[16]Wu D, Raafat M, Pak E, et al. MicroRNA machinery responds to peripheral nerve lesion in an injury-regulated pattern[J]. Neuroscience, 2011, 190:386-397.
[17]宁昕杰,王辉,陆新华,等. MicroRNA-21 促进大鼠雪旺细胞增殖的实验研究[J]. 中国病理生理杂志, 2015, 31(3):392-396.
[18]Johnson EO, Zoubos AB, Soucacos PN. Regeneration and repair of peripheral nerves[J]. Injury, 2005, 36(4):S24-S29.
[19]Fujita S, Ito T, Mizutani T, et al. miR-21 gene expression triggered by AP-1 is sustained through a double-negative feedback mechanism[J]. J Mol Biol, 2008, 378(3):492-504.
[20]梁燕,吴建新. miR-21与肿瘤研究进展[J]. 中华肿瘤防治杂志, 2012, 19(12):949-952.
[21]Li S, Liang Z, Xu L, et al. MicroRNA-21: a ubiquitously expressed pro-survival factor in cancer and other diseases[J]. Mol Cell Biochem, 2012, 360(1-2):147-158.
[22]Buscaglia LE, Li Y. Apoptosis and the target genes of microRNA-21[J]. Chinese J Cancer, 2011, 30(6):371-380.
[23]de Araujo WM, Robbs BK, Bastos L, et al. PTEN overexpression cooperates with lithium to reduce the malignancy and to increase cell death by apoptosis via PI3K/Akt suppression in colorectal cancer cells[J]. J Cell Biochem, 2015 Jul 30. [Epub ahead of print]
(责任编辑: 陈妙玲, 余小慧)

