炎性因子对人胰腺癌PaTu8988细胞NF-κB及Hedgehog通路成员表达的影响
2016-01-11王玉琼,丁佳寅,诸娴等
·论著·
炎性因子对人胰腺癌PaTu8988细胞NF-κB及Hedgehog通路成员表达的影响
王玉琼丁佳寅诸娴吴红玉金晶满晓华高军李兆申
【摘要】目的探讨肿瘤坏死因子 α(TNF-α)和白介素1β(IL-1β)对人胰腺癌PaTu8988细胞核因子κB(NF-κB)及Hedgehog(HH)通路成员Shh、SMO、Gli1、SuFu基因表达的影响。方法分别应用TNF-α和IL-1β刺激人胰腺癌PaTu8988细胞48 h,以未处理细胞作为对照组。采用实时定量RT-PCR和蛋白质印迹法检测各组细胞NF-κB及Shh、SMO、Gli1、SuFu的mRNA和蛋白表达,采用流式细胞仪检测各组细胞的凋亡。结果TNF-α刺激组、IL-1β刺激组、对照组PaTu8988细胞的NF-κB mRNA表达量分别为9.92±0.78、7.74±0.32、1.01±0.08;Gli1 mRNA为7.25±0.45、5.74±0.33、1.00±0.06;Shh mRNA为3.60±0.36、4.33±0.45、1.00±0.04;SMO mRNA为1.03±0.15、1.07±0.16、1.01±0.06;SuFu mRNA为0.88±0.14、0.96±0.13、1.01±0.05。其中TNF-α刺激组、IL-1β刺激组的NF-κB、Gli1、Shh mRNA表达量均较对照组显著增加,差异有统计学意义(P值<0.05或<0.01)。两刺激组的NF-κB、Gli1、Shh蛋白表达量也较对照组增高,差异具有统计学意义(P值均<0.05)。TNF-α刺激组、IL-1β刺激组、对照组PaTu8988细胞凋亡率分别为(17.40±2.87)%、(11.05±1.34)%、(49.90±2.96)%,TNF-α刺激组、IL-1β刺激组的细胞凋亡率均较对照组显著减少,差异有统计学意义(P值均<0.01)。结论TNF-α和IL-1β可激活PaTu8988细胞的NF-κB和HH信号通路的Shh、Gli1基因的表达,减少细胞的凋亡。
【关键词】胰腺肿瘤;Hedgehog蛋白质类;信号传导;炎症;NF-κB
DOI:10.3760/cma.j.issn.1674-1935.2015.01.005
基金项目:国家自然科学基金(81272663,30910103911);国家科技支撑计划(2006BAI02A12);上海市重点科技攻关项目(11441901800)
收稿日期:(2014-08-21)
Pro-inflammatory cytokines inhibit apoptosis of pancreatic ductal adenocarcinoma cells via both NF-κB and Hedgehog signaling pathwaysWangYuqiong,Dingjiayin,ZhuXian,WuHongyu,JinJing,ManXiaohua,GaoJun,LiZhaoshen.DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai210043,China
Correspondingauthor:GaoJun,Email:gaojunaaa@gmail.com;LiZhaoshen,Email:zhsli@81890.net
Abstract【】ObjectiveTo investigate the effect of TNF-α and IL-1β on the expression of human pancreatic cancer PaTu8988 NF-κB and Hedgehog (HH) signaling pathways members Gli1, Shh, SMO, SuFu. MethodsPancreatic cancer cell line PaTu8988 was treated with TNF-α and IL-1β, respectively, for 48 h, and cells without treatment were control group. Then the protein and mRNA expression of NF-κB and Shh, SMO, Gli1, SuFu was determined by RT-PCR and Western blot; apoptosis of cells were tested by flow cytometry. ResultsThe expressions of NF-κB mRNA in PaTu8988 cells in TNF-α group, IL-1β group, control group were 9.92±0.78, 7.74±0.32, 1.01±0.08; and the expressions of Gli1 mRNA were 7.25±0.45, 5.74±0.33, 1.00±0.06; and the expressions of Shh mRNA were 3.60±0.36, 4.33±0.45, 1.00±0.04; and the expressions of SMO mRNA were 1.03±0.15, 1.07±0.16, 1.01±0.06; and the expressions of SuFu mRNA were 0.88±0.14, 0.96±0.13, 1.01±0.05. The expressions of NF-κB, Gli1,

作者单位:210043第二军医大学长海医院消化内科(王玉琼、诸娴、丁佳寅、吴红玉、金晶、满晓华、高军、李兆申);解放军411医院分院内科(王玉琼)
通信作者:高军,Email:gaojunaaa@gmail.com;李兆申,Email:zhsli@81890.net
Shh mRNA in TNF-α group, IL-1β group were significantly higher than that in control group, and the difference between the two groups was statistically significant (P<0.05). The expressions of corresponding proteins were consistent with the expressions of mRNA. The apoptosis rates in TNF-α group, IL-1β group, control group were (17.40±2.87)%, (11.05±1.34)%, (49.90±2.96)%, and the apoptosis rates in TNF-α group, IL-1β group were significantly lower than that in control group, and the difference between the two groups was statistically significant (P<0.01). ConclusionsTNF-α and IL-1β can activate the expression of NF-κB and Shh, Gli1 in human pancreatic cancer PaTu898, and decrease apoptosis.
【Key words】Pancreatic neoplasms;Hedgehog proteins;Signal transduction;Inflammation;NF-kappa B
流行病学研究发现,高达15%的肿瘤的发生、发展与感染引起的炎症相关[1-2]。转录因子NF-κB是炎症因子中的重要成员,正常情况下与inhibitor kappa B(IκB)结合处于无活性状态,炎症时IκB激酶(IκB kinase, IKK)复合物可被肿瘤坏死因子-α(TNF-α)和白介素1β(IL-1β)等激活,通过泛素-蛋白酶途径降解,从而释放出NF-κB,从胞质转移到胞核内,进而调控下游基因表达[3-4]。研究证实,NF-κB参与胰腺癌的发生[5-6]。Hedgehog(HH)信号通路在胚胎发育及胰腺癌等肿瘤发生和发展中起重要作用。HH信号通路主要由配体sonic hedgehog(Shh)、跨膜蛋白受体smoothened (SMO)、核转录因子glioma-associated oncogene (Glis)和抑制因子suppressor of fused(SuFu)等组成。一些信号通路也可通过影响SuFu、SMO而活化HH通路[7]。
近期研究发现,在弥漫性大B细胞淋巴瘤中,HH信号通路和NF-κB共同异常增多[7]。为此,本研究应用TNF-α、IL-1β刺激胰腺癌细胞株PaTu8988,检测细胞受刺激后NF-κB及HH信号通路成员表达及细胞凋亡的变化,探讨其作用机制。
材料与方法
一、细胞培养及分组
胰腺癌细胞株PaTu8988由上海长海医院消化内科实验室保存。常规培养、传代。取对数生长期细胞,以5×105个细胞密度接种于10 cm培养皿,共接种3皿,加入含10%胎牛血清(FBS)的DMEM培养液(含青霉素、链霉素各10 U/ml)置37℃、5% CO2条件下培养。细胞贴壁后换含1% FBS的DMEM培养液(含青霉素、链霉素各10 U/ml)“饥饿”12 h,分别以10 ng/ml的人重组TNF-α、5 ng/ml的人重组IL-1β刺激PaTu8988细胞48 h,收集细胞。以未处理的细胞作为对照组。人重组TNF-α及IL-1β均购自B&D公司。
二、蛋白质印迹法检测蛋白表达
按蛋白提取试剂盒(Thermo公司)说明书分别提取细胞胞质蛋白及胞核蛋白,以二喹啉甲酸法测蛋白浓度。取待测样本30 μg上样,常规行蛋白质印迹法检测Shh、SMO、Gli1、SuFu、NF-κB蛋白表达,分别以Histone、GAPDH为内参。一抗的工作浓度分别为1∶3 000、1∶1 000、1∶1 000、1∶1 000、1∶200、1∶2 000、1∶2 000,二抗工作浓度1∶5 000,最后ECL发光,X片曝光、显影、定影。通过凝胶成像系统扫描各条带的灰度值。以目的条带与内参条带的灰度值比表示蛋白相对表达量。实验重复3次,取均值。
三、实时定量聚合酶链反应(qRT-PCR)法检测mRNA表达
收集各组PaTu8988细胞,采用Trizol(Takara公司)抽提细胞总RNA。先逆转录成cDNA,再行PCR反应。Shh、SMO、Gli1、NF-κB、SuFu、Histone、GAPDH探针均购自Life Technology公司。实时PCR反应程序:95℃ 10 min,95℃ 10 s、60℃ 1 min,40个循环。以公式2-△△Ct计算mRNA相对表达量。实验重复3次,取均值。
四、流式细胞仪检测细胞凋亡
Annexin V/FITC 试剂盒购自eBioscience公司,按说明书操作。收集刺激48 h的各组PaTu8988细胞,PBS冲洗3次后以200 μl Binding buffer重悬,加入3 μl Annexin V,暗室放置15 min,加6 μl碘化丙啶,混合后上流式细胞仪(美天妮公司产品)检测细胞凋亡。结果用flowjo软件分析。实验重复3次,取均值。
五、统计学处理
结果
一、TNF-α、IL-1β刺激后PaTu8988细胞Gli1、NF-κB mRNA及蛋白表达变化
TNF-α刺激组、IL-1β刺激组、对照组PaTu8988细胞的NF-κB mRNA表达量分别为9.92±0.78、7.74±0.32、1.01±0.08,蛋白表达量分别为1.00±0.01、0.98±0.03、0.79±0.04,TNF-α、IL-1β刺激组的表达均较对照组显著增加,差异有统计学意义(t值分别为19.19、30.11、14.55、11.44,P值均<0.05,图1)。TNF-α刺激组、IL-1β刺激组、对照组PaTu8988细胞的Gli1 mRNA表达量分别7.25±0.45、5.74±0.33、1.00±0.06,蛋白表达量分别为0.96±0.05、0.93±0.04、0.70±0.04,TNF-α、IL-1β刺激组的表达均显著高于对照组,差异有统计学意义(t值分别为25.11、22.07、5.51、7.22,P值均<0.05,图1)。
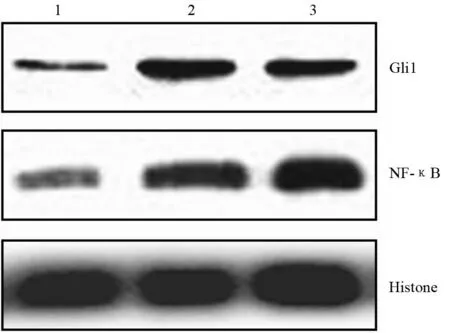
图1 对照组(1)、TNF-α刺激组(2)、IL-1β刺激组(3)PaTu8988细胞胞核内Gli1、NF-κB蛋白表达
二、TNF-α、IL-1β刺激后PaTu8988细胞Shh、SMO、SuFu mRNA及蛋白表达变化
TNF-α刺激组、IL-1β刺激组、对照组PaTu8988细胞Shh mRNA的表达量分别为3.60±0.36、4.33±0.45、1.00±0.04,蛋白表达量为0.85±0.05、0.75±0.06、0.60±0.04,两刺激组的表达均较对照组显著增加,差异有统计学意义(t值分别为13.35、13.88、45.08、6.99,P<0.05或<0.01,图2)。TNF-α刺激组、IL-1β刺激组、对照组PaTu8988细胞SMO mRNA的表达量分别为1.03±0.15、1.07±0.16、1.01±0.06,蛋白表达量为0.73±0.04、0.70±0.02、0.72±0.01;SuFu mRNA的表达量分别为0.88±0.14、0.96±0.13、1.01±0.05,蛋白表达量为0.72±0.01、0.74±0.05、0.73±0.00,两刺激组与对照组的差异均无统计学意义(t值分别为0.16、0.57、0.63、2.61、1.52、0.63、0.82、0.32,P值均>0.05,图2)。
三、TNF-α、IL-1β 刺激后PaTu8988细胞凋亡变化
TNF-α刺激组、IL-1β刺激组、对照组PaTu8988细胞凋亡率分别为(17.40±2.87)%、(11.05±1.34)%、(49.90±2.96)%(图3)。TNF-α、IL-1β刺激组的细胞凋亡均较对照组显著减少,差异有统计学意义(t值分别为19.98、29.97,P值均<0.01)。

图2 对照组(1)、TNF-α刺激组(2)、IL-1β刺激组(3)PaTu8988细胞胞质内Shh、SMO、SuFu蛋白的表达

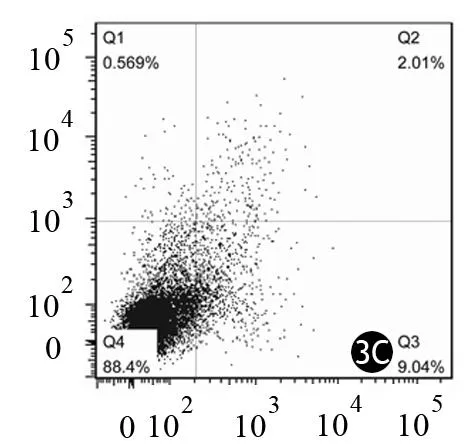
图3对照组(3A)、TNF-α刺激组(3B)、IL-1β刺激组(3C)PaTu8988细胞的凋亡图
讨论
在对弥漫性大B细胞淋巴瘤的研究中发现,NF-κB可激活HH通路,上调SMO的表达[7]。另有研究[8-14]报道,包括EGF/EGFR、Wnt/β-链蛋白、TGF-β1、TGF-β R在内的多个信号通路可影响正常细胞和肿瘤细胞SuFu的作用而调控Glis的表达和(或)稳定性,导致HH通路活化,促进HH靶基因表达。
胰腺癌发病过程极为复杂,有多种信号系统参与。NF-κB和HH信号通路是其中的两个重要系统,它们的相互作用越来越受到学者的关注。Nakashima等[15]研究发现,TNF-α、IL-1β等通过激活NF-кB诱导Shh过度表达,激活HH信号通路,且NF-κB p65与Shh在胰腺癌组织中的表达呈显著正相关,阻断NF-κB可以抑制Shh mRNA的表达。
本研究结果显示,TNF-α、IL-1β刺激胰腺癌PaTu8988细胞后,NF-κB表达上调,同时HH通路的Shh、Gli1基因表达也上调,而SMO及SuFu表达量无变化,提示炎症因子的刺激可同时激活NF-κB与HH通路,两条通路存在一定的相关性,NF-κB可能通过Gli1入核增多而激活HH通路。本研究结果还显示,炎症因子刺激可抑制PaTu8988细胞的凋亡。
参考文献
[1]Okada F. Inflammation and free radicals in tumor development and progression[J]. Redox Rep, 2002,7(6):357-368.
[2]Sutcliffe S, Platz EA. Inflammation and prostate cancer: a focus on infections[J]. Curr Urol Rep, 2008,9(3):243-249.
[3]van Kempen LC, de Visser KE, Coussens LM. Inflammation, proteases and cancer[J]. Eur J Cancer, 2006,42(6):728-734.
[4]Greten FR, Eckmann L, Greten TF, et al. IKKbeta links inflammation and tumorigenesis in a mouse model of colitis-associated cancer[J]. Cell, 2004,118(3):285-296.
[5]Tang D, Zhang J, Yuan Z, et al. Pancreatic satellite cells derived galectin-1 increase the progression and less survival of pancreatic ductal adenocarcinoma[J]. PLoS One, 2014,9(3):e90476.
[6]Shi C, Merchant N, Newsome G, et al. Differentiation of pancreatic ductal adenocarcinoma from chronic pancreatitis by PAM4 immunohistochemistry[J]. Arch Pathol Lab Med, 2014,138(2):220-228.
[7]Qu C, Liu Y, Kunkalla K, et al. Trimeric G protein-CARMA1 axis links smoothened, the hedgehog receptor transducer, to NF-kappaB activation in diffuse large B-cell lymphoma[J]. Blood, 2013,121(23):4718-4728.
[8]Xie J, Aszterbaum M, Zhang X, et al. A role of PDGFRalpha in basal cell carcinoma proliferation[J]. Proc Natl Acad Sci U S A, 2001,98(16):9255-9259.
[9]Bigelow RL, Jen EY, Delehedde M, et al. Sonic hedgehog induces epidermal growth factor dependent matrix infiltration in HaCaT keratinocytes[J]. J Invest Dermatol, 2005,124(2):457-465.
[10]Kasper M, Schnidar H, Neill GW, et al. Selective modulation of Hedgehog/GLI target gene expression by epidermal growth factor signaling in human keratinocytes[J]. Mol Cell Biol, 2006,26:6283-6298.
[11]Stecca B, Mas C, Clement V, et al. Melanomas require HEDGEHOG-GLI signaling regulated by interactions between GLI1 and the RAS-MEK/AKT pathways[J]. Proc Natl Acad Sci U S A, 2007,104(14):5895-5900.
[12]Dennler S, Andre J, Verrecchia F, et al. Cloning of the human GLI2 Promoter: transcriptional activation by transforming growth factor-beta via SMAD3/beta-catenin cooperation[J]. J Biol Chem, 2009,284(46):31523-31531.
[13]Schnidar H, Eberl M, Klingler S, et al. Epidermal growth factor receptor signaling synergizes with Hedgehog/GLI in oncogenic transformation via activation of the MEK/ERK/JUN pathway[J]. Cancer Res, 2009,69(4):1284-1292.
[14]Seto M, Ohta M, Asaoka Y, et al. Regulation of the hedgehog signaling by the mitogen-activated protein kinase cascade in gastric cancer[J]. Mol Carcinog, 2009,48(8):703-712.
[15]Nakashima H, Nakamura M, Yamaguchi H, et al. Nuclear factor-kappaB contributes to hedgehog signaling pathway activation through sonic hedgehog induction in pancreatic cancer[J]. Cancer Res, 2006,66(14):7041-7049.
(本文编辑:屠振兴)
