玉米青贮蛋白质组分与分子结构关系的研究
2016-01-10王晓帆张幸怡郝小燕张立阳薛世崇张永根
■王晓帆 张幸怡 郝小燕 张立阳 丁 雪 薛世崇 李 高 张永根
(东北农业大学动物科学技术学院,黑龙江哈尔滨 150030)
蛋白质含量是评定玉米青贮品质优劣的重要指标之一。传统的化学分析方法一般是通过组织均化和成分分离来实现对已知特定化学成分的测定。但是并没有考虑到测定成分的空间构象和分布。这不仅丢失了化学组成的内在结构信息,测量起来更加的耗时、费力,也伴随着样品浪费、环境污染等问题。与传统化学分析方法破坏蛋白质内部结构不同,傅里叶红外光谱(Fourier Transform Infrared Spectroscopy,FTIR)是一种快速、无损、环保的分子结构特征分析技术。Barth A等总结了蛋白质二级结构主要由α-螺旋、β-折叠和少量的β-转角、无规则卷曲组成,这些二级结构信息(酰胺Ⅰ带和酰胺Ⅱ带的峰高、峰面积以及比值,α-螺旋和β-折叠的峰高以及比值)对蛋白质的营养价值有所影响。目前用此种技术来探究反刍动物粗饲料蛋白质二级结构与蛋白质组分关系的研究还很少。故本试验重在利用FTIR技术对玉米青贮进行光谱分析,以期探索蛋白质分子结构与营养组分间的联系。
1 材料与方法
1.1 试验材料
全株玉米青贮样品共计15份,每份取两个平行样品。分别采集于不同时间(2014年5月至2014年9月)、黑龙江省不同地区的奶牛养殖场。青贮玉米的种类不同(先玉335、绥玉7、金岭17、中原单32、阳光1号、垦单10等),青贮方式均为窖贮。
采集后的样品经过65℃烘干、粉碎过1 mm网筛,用于化学分析。粉碎过100目网筛,用于蛋白质光谱分析。
1.2 试验方法
1.2.1 化学分析指标
干物质(DM)、粗蛋白(CP)的测定参照张丽英方法。可溶性蛋白(soluble protein,SP)的分析依照Krishnamoorthy方法。非蛋白氮(non-protein nitrogen,NPN)的测定按照AACC的方法测定。中性洗涤不溶蛋白(neutral detergent insoluble crude protein,NDICP)和酸性洗涤不溶蛋白(acid detergent insoluble crude protein,ADICP)按照Tcitra的方法进行测量。
1.2.2 中红外光谱的采集
试验采用的仪器为BRUKER ALPHA中红外光谱仪,德国布鲁克光谱仪器公司。
混有200 mg溴化钾的2 mg样品在玛瑙研钵中充分研磨、混匀、压片,放入光谱仪中进行读取分析。光谱采集时仪器的设定参数:扫描范围为700~4 000 cm-1(见图1)。扫描次数为128次,分辨率为4 cm-1,每个样品重复装样5次(见图2)。

图1 15种玉米青贮4 000~700 cm-1区域的中红外光谱

图2 玉米青贮5次测量图谱的酰胺区域划分
1.3 数据分析与计算
1.3.1 CNCPS蛋白质组分的计算
按Sniffen的计算方法计算:
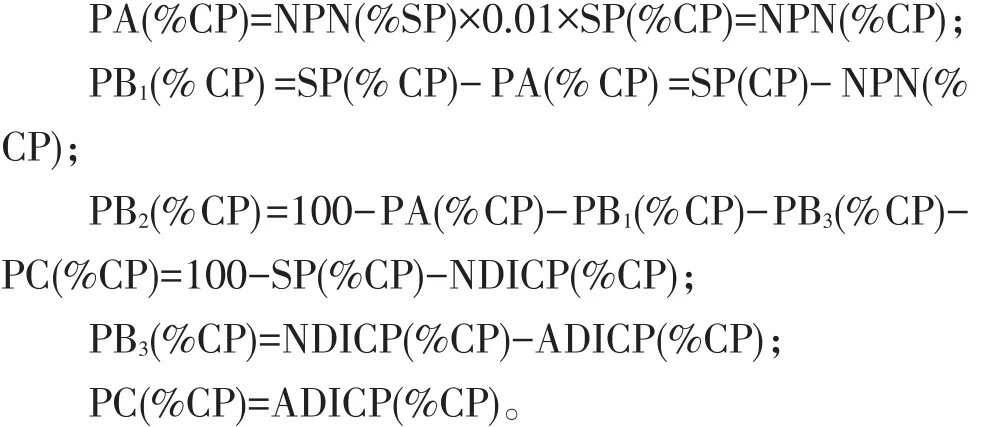
其中,NPN(%SP)为非蛋白氮占可溶性蛋白的百分比;SP(%CP)为可溶性蛋白占粗蛋白的百分比;NPN(%CP)为非蛋白氮占粗蛋白的百分比;NDICP(%CP)为中性洗涤不溶蛋白占粗蛋白的百分比;ADICP(%CP)为酸性洗涤不溶蛋白占粗蛋白的百分比。PA(%CP)为快速降解部分,即为非蛋白氮占粗蛋白的百分比;PB1(%CP)为溶于缓冲液中的真蛋白占粗蛋白的百分比;PB2(%CP)为中性洗涤可溶性蛋白占粗蛋白的百分比;PB3(%CP)为酸性洗涤可溶性蛋白占粗蛋白的百分比;PC(%CP)为酸性洗剂不溶性蛋白,即为不可利用的蛋白部分。
1.3.2 中红外光谱分析
利用Ominic 8.2(Spectratech,Madison,WI,USA)光谱处理软件对1 720~1 480 cm-1蛋白质光谱区段进行分析,并分别对酰胺Ⅰ带与酰胺Ⅱ带进行基线校正。对酰胺Ⅰ带区段进行二阶导处理,并对二阶导图谱进行平滑。根据平滑后的二阶导图谱,找到原光谱对应的蛋白质二级结构关系:α-螺旋出现在1 658~1 648 cm-1波段;β-折叠出现在1 640~1 620 cm-1波段。根据对酰胺Ⅰ带、酰胺Ⅱ带的峰高、峰面积、峰高比、峰面积比,以及二级结构α-螺旋、β-折叠的峰高、峰高比进行计算,探索玉米青贮分子营养结构与蛋白质组分的相关性。
1.3.3 数据统计与分析
用SAS 9.2软件的PROC CORR程序分别检测蛋白质结构光谱酰胺Ⅰ带、酰胺Ⅱ带的峰面积、峰高、峰面积比和峰高比,二级结构α-螺旋、β-折叠的峰高、峰高比与全株玉米青贮的化学营养成分和CNCPS蛋白质组分的相关性,并进行PROC REG程序的多元回归分析。
2 结果与分析
2.1 基础营养成分与蛋白质结构光谱的相关性

表1 玉米青贮化学成分和CNCPS蛋白质组分与蛋白质结构光谱的相关性

表1(续) 玉米青贮化学成分和CNCPS蛋白质组分与蛋白质结构光谱的相关性
由表1可知,玉米青贮的基本营养成分含量与其蛋白质光谱结构存在一定的相关性。
玉米青贮的粗蛋白含量分别与酰胺Ⅰ带的峰面积、酰胺Ⅰ带的峰高、α-螺旋峰高、β-折叠的峰高极显著正相关(r=0.593~0.672,P≤0.001),与酰胺Ⅱ带的峰高趋于相关(r=0.338,P=0.067),而与酰胺Ⅱ带的峰面积、酰胺Ⅰ带与酰胺Ⅱ带的峰面积比、峰高比、α-螺旋和β-折叠的峰高比无相关。
玉米青贮中可溶性蛋白的含量分别与酰胺Ⅰ带的峰面积、酰胺Ⅰ带的峰高和β-折叠的峰高极显著相关(r=0.510~0.543,P<0.010),与α-螺旋的峰高(r=0.371,P=0.043)、酰胺Ⅰ带与酰胺Ⅱ带的峰高比(r=0.368,P=0.045)存在相关,与酰胺Ⅱ带的峰面积、酰胺Ⅱ带的峰高、酰胺Ⅰ带与酰胺Ⅱ带的峰面积比、α-螺旋和β-折叠的峰高比无相关关系。
玉米青贮中非蛋白氮的含量与酰胺Ⅰ带的峰高极显著正相关(r=0.483,P=0.007),与酰胺Ⅰ带的峰面积(r=0.448,P=0.013)和β-折叠的峰高(r=0.396,P=0.030)存在相关,与酰胺Ⅰ带与酰胺Ⅱ带的峰高比趋于相关(r=0.329,P=0.076)。
玉米青贮的中性洗涤不溶蛋白和酸性洗涤不溶蛋白的含量与酰胺Ⅰ带的峰面积、α-螺旋的峰高和β-折叠的峰高呈极显著正相关(r=0.567~0.731,P≤0.001),与酰胺Ⅰ带的峰高存在相关(r=0.451~0.460,P=0.011~0.013),与酰胺Ⅱ带的峰面积、酰胺Ⅱ带的峰高、酰胺Ⅰ带与酰胺Ⅱ带的峰面积比、酰胺Ⅰ带与酰胺Ⅱ带的峰高比、α-螺旋和β-折叠的峰高比不存在相关性。
由表2可以发现,可以利用酰胺Ⅰ带的面积以及α-螺旋和β-折叠的峰高比对玉米青贮蛋白质的含量建立回归方程(R2=0.572,P<0.001),同时酰胺Ⅰ带的面积也是影响青贮可溶性蛋白含量的重要因素之一,可利用其对SP含量建立回归方程(R2=0.299,P=0.002)。酰胺Ⅰ带的峰高可以与玉米青贮非蛋白氮含量建立回归方程(R2=0.234,P=0.007)。α-螺旋峰高和酰胺Ⅱ带的峰面积可以拟合玉米青贮中酸性洗涤不溶蛋白的含量(R2=0.458,P=0.000),同时还可以利用α-螺旋的峰高与青贮中性洗涤不溶蛋白的含量建立回归方程(R2=0.534,P<0.001)。
2.2 CNCPS中蛋白质组分与蛋白质结构光谱的相关性
综合表1、表2可知,PA组分与酰胺Ⅱ带的峰面积、α-螺旋和β-折叠的峰高比存在负相关(r=-0.424,P=0.019~0.020),与酰胺Ⅰ带与酰胺Ⅱ带的峰高比存在正相关(r=0.428,P=0.018)。在蛋白质二级结构中,酰胺Ⅰ带与酰胺Ⅱ带的峰高比和α-螺旋与β-折叠的峰高比可以用来估算PA组分的含量,并建立回归方程(R2=0.333,P=0.018)。
PB1组分与α-螺旋的峰高呈显著正相关(r=0.527,P=0.003),故可利用α-螺旋的峰高建立对PB1组分的回归方程(R2=0.278,P=0.003)。β-折叠的峰高与PB1组分存在相关(r=0.454,P=0.012),酰胺Ⅰ带的峰面积与PB1也存在相关(r=0.348,P=0.059)。
酰胺Ⅰ带的峰面积、峰高,酰胺Ⅱ带的峰面积、α-螺旋的峰高、β-折叠的峰高、酰胺Ⅰ带与酰胺Ⅱ带的峰面积比、峰高比均与PB2组分呈极显著相关(P<0.001),其中除与酰胺Ⅱ带的峰面积呈极显著程度的正相关(r=0.509)外,其余均呈极显著负相关(r=-0.799~-0.473)。其中可利用酰胺Ⅰ带与酰胺Ⅱ带的峰高比以及α-螺旋的峰高与PB2建立回归方程(R2=0.796,P<0.001)。
PB3组分与α-螺旋的峰高、酰胺Ⅰ带与酰胺Ⅱ带的峰面积比、峰高比呈显著正相关(r=0.499~0.649,P<0.005),其中α-螺旋的峰高和酰胺Ⅰ带与酰胺Ⅱ带的峰面积比对PB3组分更为相关,故可用来估算PB3组分并建立回归方程(R2=0.521,P<0.001)。
PC与α-螺旋的峰高呈极显著正相关(r=0.465,P=0.010),回归方程的决定系数为0.216。
3 讨论
蛋白质拥有独特的分子结构,其对应的光谱也具有独特性。蛋白质的光谱信息(峰高、官能团的比例)与蛋白质的营养价值关系紧密。
3.1 基础营养成分与蛋白质结构光谱的相关性
蛋白质酰胺Ⅰ带区域主要是由80%的C=O伸缩振动和C-N的伸缩振动组成,蛋白质酰胺Ⅱ带区域主要为60%的N-H弯曲振动和C-N伸缩振动。酰胺Ⅰ带的伸缩振动主要与蛋白质二级结构相关,并可以用于预测蛋白质的二级结构。本文中酰胺Ⅰ带的峰高和峰面积与CP、SP、NPN、NDICP、ADICP均存在正相关,与此一致。但酰胺Ⅱ带的峰高除与粗蛋白趋于正相关外,与其它营养指标无相关。这可能是因为酰胺Ⅱ带区域涉及到了多种官能团的伸缩振动,波谱较复杂,对蛋白质的预测能力不如酰胺Ⅰ带。Zhang等也分析可能因此原因只得到了粗蛋白的含量与酰胺Ⅰ带的面积存在正相关。Yu在比较6种DDGS营养价值与蛋白质结构时,提及酰胺Ⅰ带与酰胺Ⅱ带的峰面积与SP呈显著正相关,与NDICP趋于正相关,与ADICP不存在相关性。而本文并未发现此相关性,差异的原因可能是因为饲料的种类不同,导致相应的分子结构也不同,有相关性的指标被重新分配。
本文中α-螺旋和β-折叠的峰高比与基本营养指标无相关,而K.Doiron在研究三种不同温度对亚麻籽影响时得到其峰高比值与NDICP、ADICP呈显著相关。可能原因除原料种类不同带来的差异外,还有可能是因为热处理改变了分子结构与构象。这一点Yu在比较亚麻籽和北美驼绒藜籽蛋白质二级结构各组分比值以及相互关系时就表明,不同蛋白质源的饲料,内部结构也不相同,饲料蛋白中α-螺旋和β-折叠的比值不同,其蛋白质的营养价值也不同。
3.2 CNCPS中蛋白质组分与蛋白质结构光谱的相关性
Yu在分析谷物和乙醇副产物蛋白质结构信息时,指出α-螺旋的峰高和β-折叠的峰高均与蛋白质PA、PC组分呈正相关,与PB2组分呈负相关。本文结论与之一致,并在相关的基础上,建立了回归方程,更形象地指出了蛋白质组分PA、PC与蛋白质二级结构的关系。与PB3组分正相关,这可能是因为不同种类的饲料原料蛋白质二级结构不同。Mojtaba Yari指出酰胺Ⅰ带与酰胺Ⅱ带的峰高比与PB2呈显著负相关。本文结果与之相同,并建立了相应的回归方程。这可能是因为酰胺Ⅰ带对蛋白质二级结构存在特别相关的原因。
Yu在分析小麦DDGS、玉米DDGS及其混合DDGS得出α-螺旋与β-折叠的峰高比只与PC组分有关,与NPN、SP、NDICP、PB1、PB2、PB3均无相关性,本文结论与其存在较大差异,这可能是由于饲料的种类、产地、品种、加工方法和贮存方式等多方面的不同而造成的较大差异。Yu在研究羽毛、大麦、小麦、燕麦的蛋白质二级结构时也得出饲料蛋白质的营养价值不仅与粗蛋白质总含量有关,更与其二级结构有关。并说明光谱的二级结构受蛋白质样品的种类、分子的组成、热处理、压强处理和转基因等因素的影响。
饲料二级结构对粗饲料,尤其是玉米青贮饲料的蛋白质营养价值的影响研究尚少,还有待继续深入研究。
4 结论
利用FTIR技术对玉米青贮内在蛋白质分子结构进行分析,发现了光谱信息与蛋白质组分的相关性,并根据其相关性建立了回归方程,丰富了FTIR技术在快速分析粗饲料蛋白的营养价值上的应用。并初步确认,可以利用FTIR技术预测玉米青贮的蛋白营养价值。
(参考文献32篇,刊略,需者可函索)
