中华根霉12#产复合酶浸提条件及体外酶解饲料的研究
2016-01-10邓永平艾瑞波郭建华刘晓兰郑喜群
■ 邓永平 艾瑞波 郭建华 刘晓兰 郑喜群 宫 晓 殷 景
(1.齐齐哈尔大学食品与生物工程学院,黑龙江齐齐哈尔 161006;2.黑龙江省普通高校齐齐哈尔农产品加工重点实验室,黑龙江齐齐哈尔 161006)
饲用复合酶是一类新型的活性饲料添加剂,在畜禽日粮中添加一定比例的复合酶能明显提高饲料的消化率和转化率,降低料肉比,缩短生长周期;同时还有防病和减少环境污染的作用,无任何毒、副作用,被誉为真正的绿色饲料添加剂[1-2]。同时,开发酶制剂、微生物制剂等新型饲料添加剂也是我国饲料工业“十三五”期间的主要任务之一。
微生物发酵是制备饲用酶的主要途径,已有报道在 Mucor indicusMTCC 6333、Aspergillus japonicus、Trichoderma reesei、Aspergillus nigerAS3.3928、Aspergillus aculeatus、Rhizopus chinesis的代谢产物中存在不同酶组成的复合酶[3-8]。为了充分发挥微生物的产酶优势,以及加强对各种糟渣的利用,学者们近些年还开展了混菌发酵生产饲用复合酶的工作[9-10]。
现有的报道主要集中于饲用复合酶发酵条件及应用的研究,鲜见对酶的提取的研究,而酶活力的高低不仅与发酵条件有关,在提取过程中酶的活力也会有不同程度的损失,因此,探索复合酶适宜的提取条件是非常必要的。根霉是发酵工业中常用的生产菌种,能分泌多种酶系。本文所采用的菌株中华根霉12#来源于南方小酒药,此菌安全性较高,且经过发酵能产生多种酶系,是一种较理想的生产饲用复合酶的菌株。本文研究了中华根霉12#产饲用复合酶的浸提条件和体外对饲料的降解情况,以期为开发该复合酶为“绿色饲料添加剂”奠定基础。
1 试验材料和仪器
1.1 菌种
中华根酶12#(Rhizopus Chinesis12#)。
1.2 试剂及材料
木聚糖、果胶、D-半乳糖醛酸均购自Sigma公司;其它试剂均为国产分析纯试剂;CF15RXII高速冷冻离心机(Hitachi)、高速万能粉碎机FW80(天津市泰斯特仪器有限公司)、分光光度计TU-1810(北京普析通用仪器有限公司)。
2 试验方法
2.1 培养基和培养方法
①斜面培养基:PDA培养基。将菌种接入PDA培养基后于28~30℃培养4~5 d,转入4℃条件下保存,备用。
②固体发酵培养基:250 ml三角瓶中装6 g麸皮和4 g豆渣,培养基料水比为1∶2,pH值自然,接种量为103个孢子/g干基,28~30 ℃条件下培养96 h[8]。
2.2 酶活力的测定
①淀粉酶的活力测定:采用DNS法。底物为1%淀粉溶液。酶活力定义:在40℃、pH值6.0的条件下,1 min水解淀粉生成1 μg葡萄糖所需要的酶量,规定为一个酶活力单位,以U/g表示。
②果胶酶活力测定:采用DNS法。底物为0.4%果胶溶液。酶活力定义:在45℃、pH值6.0的条件下,1 min分解果胶生成1 μg半乳糖醛酸所需的酶量定义为一个酶活力单位,以U/g表示。
③纤维素酶活力测定:采用DNS法。底物为1%羧甲基纤维素钠溶液。酶活力定义:在45℃、pH值6.0的条件下,1 min分解羧甲基纤维素钠生成1 μg同葡萄糖的还原糖所需的酶量定义为一个酶活力单位,以U/g表示。
④ 木聚糖酶活力测定:采用DNS法。底物为0.4%木聚糖溶液。酶活力定义:在45℃、pH值6.0的条件下,1 min分解木聚糖生成1 μg还原糖所需的酶量定义为一个酶活力单位,以U/g表示。
⑤蛋白酶活力测定:底物为1%酪蛋白溶液(pH值6.0)。酶活力定义:在40℃ pH值6.0条件下,1 h水解酪蛋白产生相当于1 μg酪氨酸所需的酶量,规定为1个酶活力单位,以U/g表示。
2.3 浸提溶剂的确定
分别将100 ml的2%CaCl2溶液、自来水、生理盐水加入固体发酵产物中,在30℃、120 r/min条件下振荡浸提酶4 h,10 000 r/min离心10 min,测上清液中酶活力。
2.4 浸提温度的确定
向培养物中加入100 ml浸提溶剂,分别在25、30、40、50 ℃条件下150 r/min振荡浸提酶4 h,10 000 r/min离心10 min,取上清液,测定不同浸提温度下的酶活力。
2.5 浸提时间的确定
向发酵后的培养物中加入100 ml浸提溶剂,在30 ℃摇床中150 r/min振荡浸提酶,在1、2、3、4、5、6 h时,10 000 r/min离心10 min,测上清液中酶活力。
2.6 摇床转速的确定
采用上述试验确定的条件分别在90、120、150、180、210 r/min条件下提取酶,10 000 r/min离心10 min,测上清液中酶活力。
2.7 粗酶液对豆粕的降解
称取10 g豆粕粉(过80目筛),加入到250 ml三角瓶中,分别加入料酶体积比为1∶2、1∶3、1∶4、1∶5的复合酶液,并用生理盐水补至100 ml,反应体系最终pH值为6.0,对照组加100 ml生理盐水;在40℃恒温水浴锅中酶解2、4、6、8、10 h,每2 h取样测还原糖含量。
2.8 粗酶液对玉米粉的降解
称取10 g玉米粉(过80目筛)于250 ml三角瓶中,分别加入料酶体积比为1∶1、1∶1.5、1∶2、1∶2.5的复合酶液,并用生理盐水补至100 ml,反应体系最终pH值为6.0,对照组加100 ml生理盐水;在40℃恒温水浴锅中振荡(150 r/min)酶解2、4、6、8、10 h,每2 h取样测还原糖含量。
2.9 还原糖测定
采用DNS法测定复合酶液降解植物性饲料生成的还原糖量。吸取1 ml样液,置于25 ml比色管中,再加入DNS试剂1.5 ml,沸水显色5 min,然后用流水迅速冷却,用蒸馏水定容至20 ml,用振荡器摇匀。以蒸馏水空白调零,在540 nm处比色,参照葡萄糖标准曲线求出还原糖的含量。
还原糖得率(%)=还原糖含量(mg)×稀释倍数×100/样品干重(g)。
3 结果与讨论
3.1 浸提条件对酶活力的影响
3.1.1 浸提溶剂的确定
向发酵产物中分别加入100 ml自来水、生理盐水、2%氯化钙溶液浸提酶,对浸提产物冷冻离心,取上清液测定酶活力,确定不同溶剂的浸提效果,试验结果如图1所示。

图1 浸提溶剂对酶活力的影响
由图1可知,发酵产物经自来水浸提所得的五种酶活力都较低,氯化钙居中,生理盐水浸提后的酶活力较高。同时,考虑到复合酶浸提时保护酶的活力及成本,所以选择生理盐水作为下一步的浸提溶剂。
3.1.2 浸提温度的确定
温度对酶活力有显著影响,温度升高分子运动速度加快,有利于缩短酶的浸提时间,但是温度过高,易导致不耐热酶的活力降低,甚至失活,直接影响酶的进一步研究与应用。试验采用上一步确定的生理盐水为浸提溶剂,振荡浸提4 h,浸提温度分别为25、30、40、50 ℃,试验结果见图2。
由图2可知,浸提温度40℃时,除蛋白酶外,其它各种酶活力都相对较高,分别是木聚糖酶活力124 U/g、果胶酶活力46 U/g、纤维素酶活力64 U/g、淀粉酶活力875 U/g,综合考虑,浸提温度选择40℃。
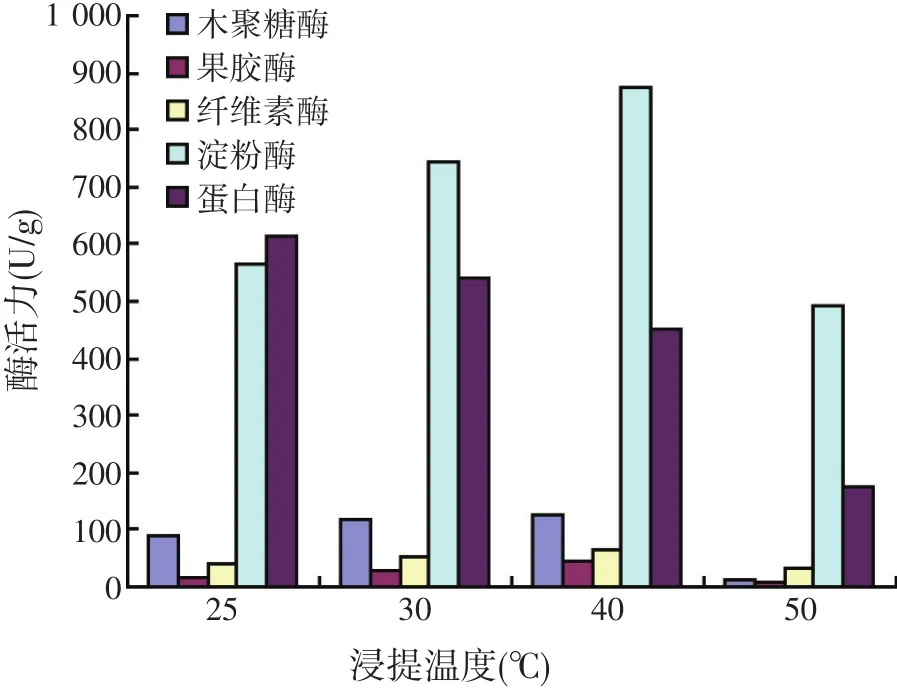
图2 不同浸提温度对酶活力的影响
3.1.3 浸提时间的确定
发酵液的浸提时间如过长,不仅易染菌,导致酶活力的降低,而且使生产周期延长;浸提时间过短,目标酶浸提不完全,不能达到最好的浸提效果。用生理盐水对中华根霉12#固态发酵产物进行浸提,在其他条件不变的情况下,对浸提时间对粗酶液酶活力的影响进行研究。试验结果如图3所示。
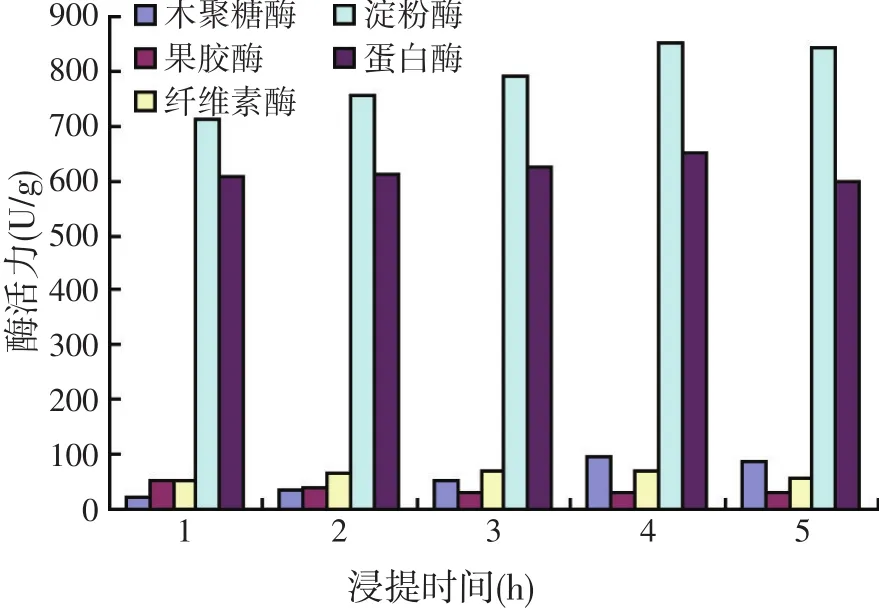
图3 不同浸提时间对酶活力的影响
从图3可见,浸提时间4 h时,除果胶酶外,其它各种酶活力都相对较高,分别为木聚糖酶活98 U/g、纤维素酶活71 U/g、淀粉酶活854 U/g、蛋白酶活653 U/g,综合考虑,浸提时间选择4 h。
3.1.4 摇床转速的确定
通过往复式摇床振荡浸提有利于酶与浸提溶剂的充分接触,缩短浸提时间,但是需要控制合适的摇床转速,既能将酶最大程度的浸提出来,又不能因为转速过快使局部热量过高导致酶失活。试验选择了90、120、150、180、210 r/min条件下提取酶,结果如图4所示。
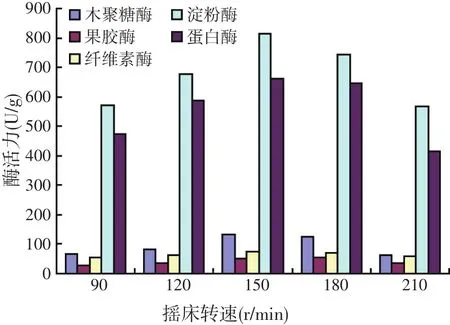
图4 摇床转速对酶活力的影响
由图4可知,当摇床转速设定为150 r/min时,五种酶的活力均较高,因此,选择摇床转速为150 r/min。
3.2 粗酶液对饲料原料中还原糖的降解
体外酶解试验中还原糖含量是可以直观反映酶制剂分解某种底物能力大小的一个重要指标[11]。以产生的同葡萄糖的还原糖为指标,研究中华根霉12#固体发酵生产的复合酶对豆粕粉和玉米粉两种饲料原料的降解情况。经测定,本次试验复合酶中各种酶活力分别是:木聚糖酶活力113 U/g、果胶酶活力48 U/g、纤维素酶活力79 U/g、淀粉酶活力812 U/g、蛋白酶活力589 U/g。
复合酶对豆粕粉的降解情况见图5。
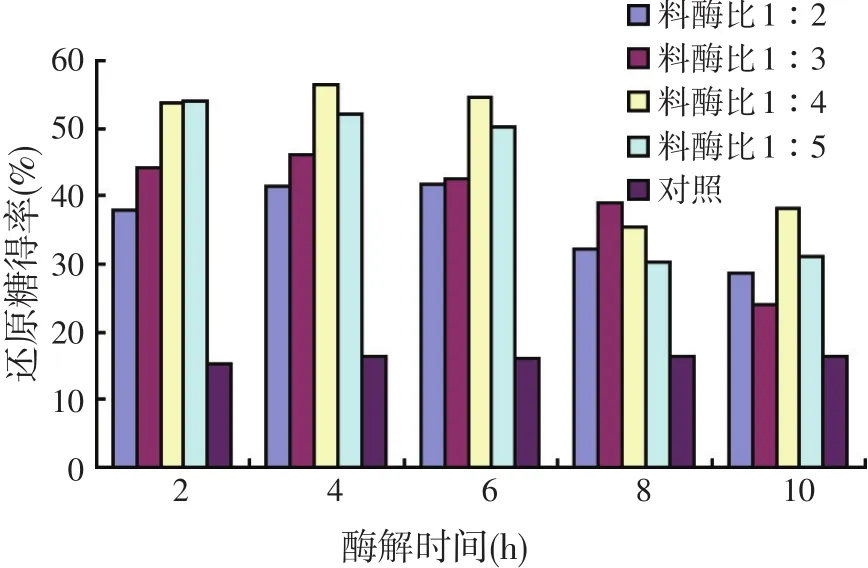
图5 不同酶解条件对豆粕中还原糖量的影响
从图5可以看出,不同酶用量条件下的酶解得到的还原糖产量均明显高于对照组。随着酶用量的逐渐增加,还原糖产量逐渐增加,但是随着酶用量的进一步提高,还原糖的产量反而下降,料酶比为1∶4反应时间为4 h时还原糖产量达到最高。
鉴于酶解豆粕试验中高浓度的复合酶并没有增加还原糖的得率,所以,该试验提高了料酶比,复合酶对玉米粉的降解情况见图6。
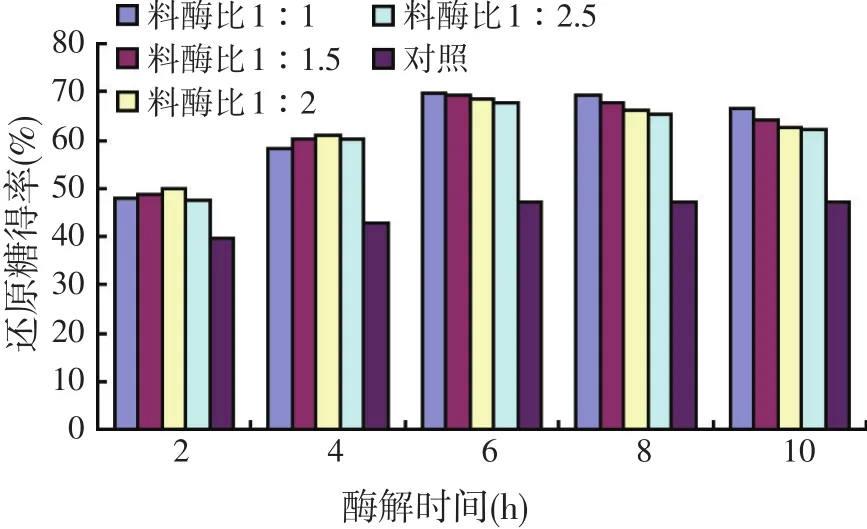
图6 不同酶解条件对玉米粉中还原糖量的影响
从图6中可以看出,不同酶用量条件下的还原糖得率差异不大,但是均高于对照。综合考虑到饲料加工、产物浓缩以及能耗等诸多因素(有关饲用复合酶酶解条件的研究仍在进行中,随后会有相关后续报导),故确定料酶比为1∶1,降解时间为6 h。
与文献报道相比,本文中复合酶酶解豆粕粉和玉米粉的还原糖得率高峰期都提前了[12]。这提示不同来源的复合酶在降解植物性饲料时,有诸多影响因素,如酶的用量、作用时间、饲料底物种类、作用pH值和温度等都会影响到最终的饲料的消化利用情况,需要具体分析,从而达到充分发挥饲用酶制剂的作用,提高饲料利用率,降低养殖成本的目的。
4 结论
本试验以中华根霉12#为生产菌种,利用固态发酵法生产饲用复合酶,对酶的浸提条件和体外对植物性饲料原料的降解情况进行了探讨。试验结果表明:提取溶剂为生理盐水,浸提时间为4 h,浸提温度为40℃,摇床转速150 r/min。在40℃条件下,豆粕粉与复合酶液比例为1∶4酶解4 h时生成还原糖量最高;玉米粉与复合酶液比例为1∶1酶解6 h时生成还原糖量最高。
