烟酸对水牛瘤胃发酵指标及微生物区系的影响
2016-01-08韦升菊李丽莉梁贤威邹彩霞中国农业科学院广西水牛研究所农业部广西水牛遗传繁育重点实验室南宁530001
林 波 梁 辛 韦升菊 李丽莉 梁贤威 李 萍 邹彩霞(中国农业科学院广西水牛研究所,农业部(广西)水牛遗传繁育重点实验室,南宁530001)
烟酸对水牛瘤胃发酵指标及微生物区系的影响
林 波 梁 辛 韦升菊 李丽莉 梁贤威 李 萍 邹彩霞∗
(中国农业科学院广西水牛研究所,农业部(广西)水牛遗传繁育重点实验室,南宁530001)
摘 要:本试验旨在研究饲粮添加烟酸对水牛瘤胃发酵指标及微生物区系的影响。试验选用36头健康状况良好,体重接近的杂交泌乳水牛,随机分为4个组,分别在基础饲粮中添加0(对照)、4、8、12 g/d烟酸,烟酸与精料混合饲喂,进行预试期14 d,正试期42 d的饲养试验。试验结束后,胃管采集瘤胃液测定瘤胃发酵指标,并采用Illumina Miseq PE250高通量测序平台分别测序瘤胃细菌和甲烷菌16S rRNA基因以确定二者区系组成。结果表明:1)与对照组相比,添加12 g/d烟酸提高了水牛日均采食量(P<0.05)和瘤胃液氨态氮浓度(P>0.05),烟酸各组均显著降低了瘤胃液总挥发性脂肪(TVFA)浓度(P<0.05),但未显著影响瘤胃液pH(P>0.05)。2)水牛瘤胃内细菌在门水平上主要以拟杆菌门和厚壁菌门为主,科水平上为普雷沃氏菌科和黄杆菌科;甲烷菌以甲烷短杆菌属为主,占90%以上,其次为甲烷球菌属和热原体属,水牛瘤胃微生物区系总体上与奶牛等其他利用植物纤维的反刍动物相似。3)与对照组相比,饲粮添加烟酸显著降低了瘤胃内厚壁菌门的比例(P<0.05),显著提高了黄杆菌科细菌的比例(P<0.05),但对瘤胃甲烷菌区系无显著影响(P>0.05)。饲粮添加烟酸改变了水牛瘤胃发酵指标和微生物区系组成,瘤胃发酵指标的变化除了与烟酸对水牛热应激的缓解和消化吸收的影响有关,还与烟酸添加对瘤胃细菌区系的影响有关。
关键词:烟酸;水牛;瘤胃发酵;微生物区系
水牛是我国南方地区重要的奶源动物,主要生活在亚热带高温潮湿地区,对热应激有一定的耐受性[1]。然而随着奶水牛集约化养殖的发展,高产奶水牛对应激的敏感性增强,因此有必要补充微量元素和维生素等抗应激添加剂。烟酸是与动物体内的碳水化合物、脂肪及蛋白质代谢密切相关的一种B族维生素,饲粮中添加烟酸的作用机制之一是弥补了瘤胃内合成的不足,从而满足了动物正常生理代谢对烟酸的需求,特别是在高温条件下,可缓解动物的热应激[2]。李萍等[3]研究表明饲粮添加8和12 g/d烟酸分别提高水牛产奶量达11.5%和8.0%。也有研究表明饲粮添加烟酸可刺激瘤胃微生物的生长,进而影响瘤胃发酵指标[4-5]。现有研究表明饲粮添加烟酸提高了瘤胃总挥发性脂肪酸和氨态氮浓度,增加了微生物蛋白浓度[6-7]。目前,烟酸添加对水牛瘤胃发酵指标影响的研究还较少,特别是尚无对瘤胃微生物区系影响的研究报道,而外源烟酸对瘤胃微生物区系的影响是阐明烟酸在瘤胃内作用机制的关键。因此,本研究对处于高温条件下的泌乳水牛饲粮中添加烟酸,研究其对瘤胃微生物区系和瘤胃发酵指标的影响,旨在阐明外源烟酸对瘤胃发酵的影响机制。
1 材料与方法
1.1 试验动物与管理
本试验于2012-07-07—2012-08-31在广西水牛研究所水牛养殖试验研究与示范基地进行。选取36头日均产奶量在5 kg以上,泌乳天数超过30 d的健康杂交(广西本地水牛×尼里-拉菲水牛×摩拉水牛)泌乳水牛(平均年龄为6.5岁,平均体重为615 kg,胎次为2~4胎)。按产奶量、泌乳期等相近原则随机分为4组,每组9头水牛。试验牛进行单槽专人饲喂、每天挤奶2次,采取先粗后精的饲喂顺序。饲喂后,试验牛放于运动场自由运动和饮水。
1.2 试验设计
将4组水牛分为对照组和试验组,其中对照组饲喂基础饲粮(组成及营养水平见表1),按照张丽英[8]的方法测定各原料营养水平后,按照配方计算出饲粮营养水平;试验组分别饲喂基础饲粮添加4、8、12 g/d烟酸(购自广西彼得汉预混饲料有限公司,有效含量≥99.0%)的试验饲粮,烟酸与精料混合饲喂。整个试验期共56 d,其中预试期14 d,正试期42 d。预试期内逐步增加各试验组烟酸喂量,直至正试期前达到试验设定水平。从正试期开始,每隔7 d用逐一称量各试验牛饲粮饲喂量和剩料量,并计算各组试验牛日均采食量。
1.3 样品采集和测定
1.3.1 瘤胃液采集
正试期结束后,每组挑选泌乳量和采食量最为接近的3头水牛采集瘤胃液,分析瘤胃微生物区系。于正试期第42天晨饲前通过胃管采集水牛瘤胃液500 mL,通过4层纱布过滤后,立即用便携式pH测定仪(PP⁃50⁃P11,Sartorius,德国)测定各样品pH,取10 mL瘤胃液保存于-20℃,用于乳酸和挥发性脂肪酸浓度测定,另取50 mL滤液冷冻干燥(Christ Alpha 1⁃4 LD plus,Christ Alpha,德国)后用于DNA提取测定微生物区系。
1.3.2 瘤胃液氨态氮、乳酸和挥发性脂肪酸浓度测定
瘤胃液氨态氮浓度采用比色法按照冯宗慈等[9]的方法测定。乳酸浓度测定采用试剂盒法(试剂盒购于南京建成生物工程研究所),该法是基于比色法进行。挥发性脂肪酸浓度按照胡伟莲等[10]的方法,采用气相色谱法测定,测定仪器为Agilent 7890A型气相色谱仪,毛细管柱为Agilent⁃HP⁃INNOWax毛细管柱(19091N-133)。气相色谱条件为柱温180℃,气化室温度200℃,检测室温度220℃,载气使用高纯氮气,总压力90 kPa,总流量37.2 mL/min,柱流量0.67 mL/min,线速度23.4 cm/s,分流比50∶50,吹扫流量3 mL/min,循环流量8 mL/min,氢气流量40 mL/min,空气流量400 mL/min,进样量2 μL。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air⁃dry basis) %
1.3.3 瘤胃微生物区系测定
1.3.3.1 瘤胃液DNA提取
称取25 mg冷冻干燥瘤胃液置于装有0.7 g锆珠(0.1 mm)200 μL的20%十二烷基四乙酸二钠(SDS)、282 μL的QIAquick Buffer A、268 μL的QIAquick Buffer PB(QIAquick kit,Qiagen,德国)和550 μL的饱和酚/氯仿/异戊醇(25∶24∶1)溶液的离心管中。封闭离心管后于小型珠磨器(Bio⁃spec Mini⁃Beadbeater⁃16,美国)上破碎2 min,然后于16 000×g(4℃)下离心20 min,取500 μL上清液与650 μL的磷酸盐缓冲液混合后,用QIAquick PCR purification kit纯化混合液获得DNA样品。1.3.3.2 水牛瘤胃微生物区系组成的测序分析
瘤胃细菌和甲烷菌的16S rRNA基因片段扩增与处理均按照Kittelmann等[11]提供的方法进行。PCR引物由Illumina Miseq PE250测序接头、1个2碱基的连接(linker)和样品标签(barcode)组成,细菌PCR引物为515f/806r,甲烷菌PCR引物为519f/915r(表2)。PCR扩增采用Promega PCR mix进行,体系为50 μL,每个样品的2种微生物分别扩增2管;PCR扩增程序为:94℃,3 min;然后进入94℃变性30 s,56℃退火30 s,72℃延伸45 s的循环,共进行30个循环;PCR扩增后,将同一样品的同一种微生物的2管PCR产物混合,电泳后切胶回收,采用天根胶回收试剂盒纯化;采用ND2000超微量核酸蛋白测定仪(THERMO,德国)准确测定纯化产物的DNA浓度后(精确到0.1 ng/μL),每个样品的PCR纯化产物按照细菌∶甲烷菌=5∶1的浓度比例混合。最后,将各样品全部PCR产物混合后,送广州海基生物技术有限公司应用Miseq PE250平台进行测序分析。

表2 瘤胃微生物区系测序分析采用的引物信息Table 2 Information of primers used to microbe composition sequencing analysis
1.3.3.3 测序序列的聚类分析和注释
测序数据分析采用QIIME 1.5进行,经过去除接头污染、低复杂度以及低质量reads等质量控制后,对获得的序列(clean reads)进行拼接并去除引物,用于后继分析[12]。序列分类操作单元(OTU)注释和聚类分析按照细菌和古菌97%相似度进行。OTU聚类分析和注释通过与Ribosomal Data⁃base Project(RDP)数据库中的细菌和古菌序列比对进行,细菌聚类分析到门和属水平,甲烷菌分类到属水平,丰度图采用Excel软件制作。
1.4 统计与分析
所有数据均采用SAS 8.02软件的GLM程序进行单因素试验设计方差分析,多重比较采用Duncan氏法,P<0.05为差异显著性判定标准。
2 结 果
2.1 饲粮添加烟酸对泌乳水牛瘤胃发酵指标的影响
饲粮添加烟酸后,日均采食量和瘤胃发酵指标如表3所示。低、中水平烟酸(4和8 g/d)添加对日均采食量无显著影响(P>0.05),但高水平烟酸(12 g/d)添加则显著提高了日均采食量(P<0.05)。饲粮添加烟酸对瘤胃液pH没有显著影响(P>0.05)。添加烟酸各组瘤胃液氨态氮的浓度均与对照组差异不显著(P>0.05)。12 g/d烟酸相比于其他各组均显著提高了瘤胃液乳酸浓度(P<0.05),而与对照组相比,4和8 g/d的烟酸添加对乳酸浓度无显著影响(P>0.05)。饲粮添加烟酸极显著降低了瘤胃液乙酸、丙酸和丁酸浓度和总挥发性脂肪酸浓度(P<0.01)。与对照组相比,中、高水平烟酸(8和12 g/d)添加组总挥发性脂肪酸浓度降幅达34%以上。
2.2 高通量测序数据质量控制与多样性分析结果
高通量测序数据经质量控制后获得的细菌和甲烷菌序列数、OTU数以及样品物种多样性指数如表4所示。水牛瘤胃内细菌测序后,在种水平上得到的平均序列数为22 663条,平均OTU数为1 042个,测序覆盖率均在0.88以上;细菌平均香农多样性指数为6.65,平均Chao1多样性指数为1 137,细菌组间各指标均无显著差异(P>0.05)。水牛瘤胃内甲烷菌测序后,在种水平上得到的平均序列数为8 599条,平均OTU数为200个,测序覆盖率均在0.87以上;平均甲烷菌香农多样性指数为1.41,平均Chao1多样性指数为277,甲烷菌
组间各指标均无显著差异(P>0.05)。

表3 饲粮添加烟酸对泌乳水牛日均采食量和瘤胃发酵指标的影响Table 3 Effects of dietary niacin addition on ADFI and ruminal fermentation indexes of lactating water buffaloes

表4 细菌和甲烷菌高通量测序质量控制与物种多样性指数Table 4 Quality control of high⁃flux sequencing and diversity indexes of bacteria and methanogen
2.3 饲粮添加烟酸对泌乳水牛瘤胃细菌区系的影响
饲粮添加烟酸后瘤胃细菌在门水平的组成如图1所示,水牛瘤胃细菌在门水平上共有14个门,其中主要的细菌门是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),这3类菌占总细菌的90%左右。饲粮添加烟酸后瘤胃细菌在科水平上的组成如图2所示,共有65个科,其中普雷沃氏菌科(Prevotellaceae)和黄杆菌科(Fibrobacteraceae)是在科水平的上主要细菌种类,共占据了总细菌的30%左右。

图1 饲粮添加烟酸对泌乳水牛瘤胃细菌在门水平上组成的影响Fig.1 Effects of dietary addition of niacin on ruminal bacteria composition at phyla level of lactating water buffaloes

图2 饲粮添加烟酸对泌乳水牛瘤胃细菌在科水平上组成的影响Fig.2 Effects of dietary addition of niacin on ruminal bacteria composition at family level of lactating water buffaloes
由表5可见,在门水平上,烟酸各组均显著降低了瘤胃内厚壁菌门的比例(P<0.05),但未影响其他占总菌比例大于1%的细菌比例(P>0.05)。在科水平上,烟酸各组均显著提高了瘤胃内黄杆菌科的比例(P<0.05),未影响其他占总菌比例大于1%的细菌比例(P>0.05)。
2.3 饲粮添加烟酸对泌乳水牛瘤胃甲烷菌区系的影响
饲粮添加烟酸后瘤胃甲烷菌区系在属水平的组成如图3所示。可鉴定到属水平的水牛瘤胃甲烷菌共6个,其中主要的甲烷菌是甲烷短杆菌属(Methanobrevibacter)、热原体属(Thermoplasma)和甲烷球菌属(Methanosphaera),这3类菌占总甲烷菌的95%,其中甲烷短杆菌属在各样品的比例均在90%以上。饲粮烟酸添加未影响各组中甲烷短杆菌属和其他甲烷菌的比例。
3 讨 论
3.1 烟酸对水牛瘤胃发酵指标的影响
烟酸又名尼克酸,属B族维生素,是2个重要辅酶烟酰胺腺嘌呤二核甘酸(NADH)和烟酰胺腺嘌呤二核甘酸磷酸(NADP)的成分,在动物体内的起着重要作用。烟酸对于奶牛的应激,特别是热应激具有缓解作用,且在高产奶牛和水牛饲粮中添加一定量的烟酸可显著提高奶牛产奶量、乳脂率[3]。饲粮添加烟酸的主要作用机制可能在于,吸收入动物体内后促进了碳水化合物、脂肪及蛋白质代谢。也有研究表明,烟酸可影响瘤胃发酵指标,进而影响动物的消化吸收[13-14]。一些体内与体外试验发现,烟酸可以促进奶牛瘤胃微生物合成蛋白质[13,15];杨艳等[6]研究表明高精料(80%)条件下,添加烟酸显著提高了瘤胃液pH及丙酸、总挥发性脂肪酸浓度,降低了乳酸浓度;欧阳克蕙等[14]研究表明,在体外试验条件下高精料饲粮(精粗比85∶15)中添加适量烟酸促进挥发性脂肪酸产生,提高氨态氮的浓度。本研究表明,低、中水平(4和8 g/d)的烟酸对瘤胃液氨态氮和乳酸浓度无显著影响,但添加高水平(12 g/d)烟酸则提高了氨态氮和乳酸浓度,表明高水平的烟酸可能促进了微生物对饲料蛋白质的分解利用;而乳酸浓度升高则不同于杨艳等[6]的结论,原因与本试验中水牛饲喂高粗饲粮且采食量有所提高有关。目前,现有多数研究表明烟酸添加有提高瘤胃挥发性脂肪浓度的趋势[6,15],机制是烟酸可促进微生物的生长进而促进瘤胃发酵,但这些研究多是在体外条件下进行,未考虑到烟酸对动物机体代谢的影响[13,15]。本研究中的烟酸的添加,特别是在中、高水平(8和12 g/d)下显著降低了瘤胃液中总挥发性脂肪浓度的机制尚不明了,可能是烟酸添加后降低了热应激且提高了水牛产奶量[3],进而促进了瘤胃对挥发性脂肪酸的摄取利用,但尚需进一步验证。

表5 饲粮添加烟酸对泌乳水牛瘤胃细菌在门和科水平上细菌比例(占总菌比例大于1%的细菌)的影响Table 5 Effects of dietary addition of niacin on ruminal bacteria composition(the percentage of bacteria in total bacteria>1%)at phyla and family levels of lactating water buffaloes %
3.2 烟酸对水牛瘤胃细菌组成的影响
细菌约占瘤胃生物量的50%~80%,研究表明反刍动物瘤胃内具有丰富的细菌种群,与其他脊椎动物消化道微生物区系相似,厚壁菌门和拟杆菌门是主要的2大类别,占80%左右,另外还含有比例较少的螺旋体门(Spirochaetes)、放线菌门(Actinobacteria)和变形菌门等类群[11,16-17]。本研究采用高通量测序分析结果表明,水牛瘤胃内细菌种类较多,共发现有68个属的细菌,在种水平上的香农多样性指数平均为6.65,饲粮烟酸并未影响瘤胃细菌多样性。水牛瘤胃内主要的细菌在门水平为拟杆菌门和厚壁菌门,科水平为普雷沃氏菌科和黄杆菌科。本研究结果与其他有关水牛瘤胃细菌区系的研究结果相似,总体上也与其他反刍动物瘤胃细菌区系的组成相似,表现出典型的纤维消化主导的细菌区系特征[18-20]。瘤胃细菌可合成烟酸,因此瘤胃内自身就有烟酸的存在,现有研究表明,外源烟酸添加可进一步促进瘤胃微生物的生长和蛋白质的合成[13,15],而本研究的其他试验还发现烟酸可提高水牛抗应激和能力和能量表观消化率,但对纤维表观消化率无显著影响[3]。目前有关烟酸对瘤胃细菌组成影响的研究还较少,本研究中,添加烟酸降低了水牛瘤胃内革兰氏阳性的厚壁菌门细菌的比例,但提高了与瘤胃纤维消化密切相关的黄杆菌科细菌的比例,可见烟酸在一定程度上影响了瘤胃细菌的区系组成。因此,本研究中瘤胃发酵指标的变化,特别是挥发性脂肪在烟酸添加组中显著降低是否与瘤胃细菌区系的变化有关是一个值得后继研究的重要内容。此外,瘤胃挥发性脂肪酸浓度的降低可能也与烟酸添加后缓解了热应激[3],进而促进了瘤胃对发酵产物的吸收有关。
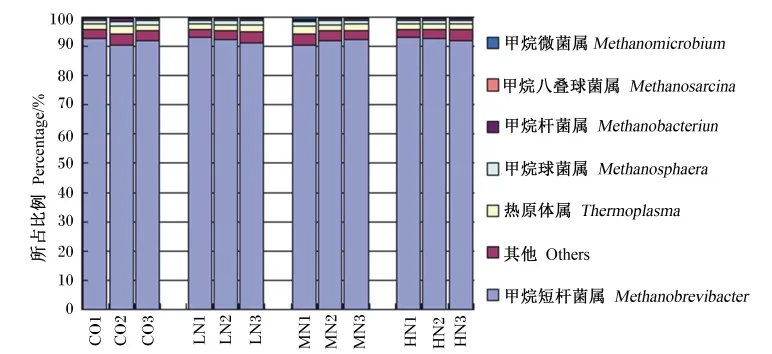
图3 饲粮添加烟酸对泌乳水牛瘤胃甲烷菌在属水平上组成的影响Fig.3 Effects of dietary addition of niacin on ruminal methanogen composition at genus level of lactating water buffaloes
3.3 烟酸对水牛瘤胃甲烷菌组成的影响
甲烷菌主要在瘤胃内主要参与有机物厌氧降解的最后一步,并利用发酵产生的氢生产甲烷。反刍动物排放的甲烷是与全球气候变化密切相关的温室气体,因此反刍动物瘤胃甲烷菌区系和特点是研究的热点[21]。现有研究表明,反刍动物瘤胃甲烷菌以甲烷短杆菌属为主,其次是甲烷球菌属和热原体属[22];有较多印度学者的研究表明,水牛瘤胃内甲烷菌以甲烷微菌属(Methanomicrobi⁃um)菌群为主,表现出于其他反刍动物不同的区系[23-25]。本研究高通量测序分析结果表明,水牛瘤胃内共发现有11个属的细菌,在种水平上的香农多样性指数平均是1.41,且饲粮烟酸也未影响瘤胃甲烷菌多样性。水牛瘤胃内90%的甲烷菌为甲烷短杆菌属,其次为甲烷球菌属和热原体属,总体上于其他反刍动物瘤胃甲烷菌区系组成相似,该结果与Franzolin等[26]的报道一致。添加烟酸后,瘤胃甲烷菌区系并无明显变化,各组中甲烷短杆菌属的比例均在90%以上,并未显著影响甲烷短杆菌属在瘤胃内的主导地位。烟酸是瘤胃内产氢细菌的必须辅酶因子,而氢是瘤胃内以氢为底物的甲烷短杆菌属和甲烷球菌属等甲烷菌生长代谢的底物,因此烟酸的添加可促进这些氢利用甲烷菌的生长,进一步巩固其主导地位。
4 结 论
①饲粮中添加烟酸能不同程度地提高水牛日均采食量和瘤胃液氨态氮浓度,但显著降低了瘤胃液总挥发性脂肪浓度。
②水牛瘤胃内细菌在门水平上主要以拟杆菌门和厚壁菌门为主,科水平上为普雷沃氏菌科和黄杆菌科;甲烷短杆菌属是瘤胃内主要的甲烷菌,占90%以上。总体上水牛瘤胃微生物区系与奶牛等其他反刍动物相似,表现出以纤维消化为特征的区系组成。
③烟酸降低了瘤胃内厚壁菌门细菌的比例,提高了黄杆菌科细菌的比例,但对瘤胃甲烷菌区系无显著影响。
参考文献:
[1] 章纯熙.中国水牛科学[M].南宁:广西科学技术出版社,2010.
[2] 蒋亚军,周凌云,赵芸君,等.烟酸在反刍动物营养中的研究进展[J].中国畜牧兽医,2010,37(7):9-14.
[3] 李萍,梁辛,韦升菊,等.不同水平烟酸对夏季泌乳水牛饲粮养分消化率和生产性能的影响[J].动物营养报,2014,26(9):2630-2636.
[4] 王菊花,卢德勋,冯宗慈,等.添加烟酸条件下绵羊瘤胃发酵底物降解动力学变化特征[J].中国草食动物,2008,28(6):7-10.
[5] DOREAU M,OTTOU J F.Influence of niacin supple⁃mentation on in vivo digestibility and ruminal digestion in dairy cows[J].Journal of Dairy Science,1996,79 (12):2247-2254.
[6] 杨艳,瞿明仁,欧阳克蕙,等.烟酸对锦江黄牛瘤胃乳酸、挥发性脂肪酸浓度及相关酶活性的影响[J].动物营养学报,2013,25(7):1610-1616.
[7] SAMANTA A K,KEWALRAMANI N,KAUR H.Effect of niacin supplementation on VFA production and microbial protein synthesis in cattle[J].Journal of Dairy Science,2000,53(2):150-153.
[8] 张丽英.饲料分析及饲料质量检测技术[M].3版.北京:中国农业大学出版社,2007.
[9] 冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].内蒙古畜牧科学,1993(4):40-41.
[10] 胡伟莲,王佳堃,吕建敏,等.瘤胃体外发酵产物中的甲烷和有机酸含量的快速测定[J].浙江大学学报:农业与生命科学版,2006,32(2):217-221.
[11] KITTELMANN S,SEEDORF H,WALTERS W A,et al.Simultaneous amplicon sequencing to explore co⁃occurrence patterns of bacterial,archaeal and eukaryot⁃ic microorganisms in rumen microbial communities [J].PLoS One,2013,8(2):e47879.
[12] CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high⁃throughput com⁃munity sequencing data[J].Nature Methods,2010,7 (5):335-336.
[13] OTTOU J F,DOREAU M.Influence of niacin on in vitro ruminal fermentation and microbial synthesis de⁃pending on dietary factors[J].Animal Feed Science and Technology,1996,58(3/4):187-199.
[14] 欧阳克蕙,张琪,鲁友友,等.高精料饲粮中添加烟酸对体外瘤胃发酵培养液pH及发酵参数动态变化的影响动[J].动物营养学报,2014,26(1):115-124.
[15] 潘龙,卜登攀,程建波,等.烟酸对奶牛瘤胃发酵及缓解热应激的影响[J].中国饲料,2013(7):25-27,31.
[16] TAJIMA K,NONAKA I,HIGUCHI K,et al.Influence of high temperature and humidity on rumen bacterial diversity in Holstein heifers[J].Anaerobe,2007,13 (2):57-64.
[17] JAMI E,MIZRAHI I.Composition and similarity of bovine rumen microbiota across individual animals [J].PLoS ONE,2012,7(3):e33306.
[18] SINGH K M,AHIR V B,TRIPATHI A K,et al.Met⁃agenomic analysis of Surti buffalo(Bubalus bubalis)rumen:a preliminary study[J].Molecular Biological Repotts,2012,39(4):4841-4848.
[19] LEE H J,JUNG J Y,OH Y K,et al.Comparative sur⁃vey of rumen microbial communities and metabolites across one caprine and three bovine groups,using barcoded pyrosequencing and 1H nuclear magnetic reso⁃nance spectroscopy[J].Applied and Environmental Microbiology,2012,78(17):5983-5993.
[20] KIM M,WANG L,MORRISON M,et al.Develop⁃ment of a phylogenetic microarray for comprehensive analysis of ruminal bacterial communities[J].Journal of Applied Microbiology,2014,117(4):949-960.
[21] 林波,纪苗苗,梁权,等.肉桂油和牛至油及其主要成分对体外瘤胃发酵和甲烷产生的影响[J].中国兽医学报,2011,31(2):279-282,287.
[22] ST⁃PIERRE B,WRIGHT A D G.Diversity of gut methanogens in herbivorous animals[J].Animal,2013,7(Suppl.1):49-56.
[23] CHAUDHARY P P,SIROHI S K.Dominance of Methanomicrobium phylotype in methanogen popula⁃tion present in Murrah buffaloes(Bubalus bubalis)[J].Letters in Applied Microbiology,2009,49(2):274-277.
[24] CHAUDHARY P P,SIROHI S K,SINGH D,et al.Methyl coenzyme M reductase(mcrA)gene based phylogenetic analysis of methanogens population in Murrah buffaloes(Bubalus bubalis)[J].The Journal of Microbiology,2011,49(4):558-561.
[25] SINGH K M,PANDYA P R,PARNERKAR S,et al.Molecular identification of methanogenic archaea from Surti buffaloes(Bubalus bubalis),reveals more hydrogenotrophic methanogens phylotypes[J].Brazil Journal of Microbiology,2011,42(1):132-139.
[26] FRANZOLIN R,ST⁃PIERRE B,NORTHWOOD K,et al.Analysis of rumen methanogen diversity in water buffaloes(Bubalus bubalis)under three different diets [J].Microbial Ecology,2012,64(1):131-139.
Effects of Niacin on Ruminal Fermentation Indexes and Microflora of Water Buffaloes
LIN Bo LIANG Xin WEI Shengju LI Lili LIANG Xianwei LI Ping ZOU Caixia
∗
(责任编辑 王智航)
(Key Laboratory of Buffalo Genetics,Breeding and Reproduction,Ministry of Agriculture and Guangxi,Buffalo Research Institute,Chinese Academy of Agricultural Sciences,Nanning 530001,China)
∗Corresponding author,professor,E⁃mail:caixiazou2002@hotmail.com
Abstract:This study was conducted to study the effects of dietary addition of niacin on ruminal fermentation indexes and microflora of water buffaloes.Thirty⁃six healthy hybrid water buffaloes with similar body weight were selected and divided into four groups randomly.The four groups were fed the same basal diet but added with 0(control),4,8 and 12 g/d,respectively.Niacin was mixed in concentrate to feed.The advanced ex⁃periment feeding period was 14 days and the formal experimental period was 42 days.At the end of experi⁃ment,rumen fluid samples were taken from rumen by stomach tube to test the ruminal fermentation indexes,16S rRNA genes of ruminal bacteria and methanogen were tested to determine microbial community by Illumi⁃na Miseq PE250 high⁃throughput sequencing.The results showed as follows:1)compared with control group,the addition of 12 g/d of niacin increased average daily feed intake(P<0.05)and rumen fluid ammonia con⁃centration(P>0.05),niacin groups significantly decreased rumen fluid total volatile fatty acid(TVFA)con⁃centration(P<0.05),but the rumen fluid pH was not significantly influenced(P>0.05).2)Water buffalo ruminal bacterial community was dominated by Bacteroidetes and Firmicutes at phyla level,Prevotellaceae and Fibrobacteraceae at family level,while ruminal methanogen community was dominated by Methanobrevibacter (over 90%)at genus level,followed by Methanosphaera and Thermoplasma.Water buffalo ruminal bacteria and methanogen community composition was generally similar with other ruminants which could utilize plant fi⁃ber.3)Compared with control group,the addition of niacin significantly decreased ruminal Firmicutes the pro⁃portion(P<0.05),and significantly increased ruminal Fibrobacteraceae proportion(P<0.05),but there was no influence on methanogen community(P>0.05).In conclusion,the addition of niacin changes ruminal fer⁃mentation indexes and microflora of water buffaloes,the changes of ruminal fermentation indexes on one hand are related with release on heat stress and improvement on digestion of niacin,on another hand are related with the change of ruminal microflora.[Chinese Journal of Animal Nutrition,2015,27(8):2396⁃2404]
Key words:niacin;water buffalo;ruminal fermentation;microflora
通信作者:∗邹彩霞,研究员,硕士生导师,E⁃mail:caixiazou2002@hotmail.com
作者简介:林 波(1983—),男,四川雅安人,副研究员,博士,主要从事反刍动物营养研究,E⁃mail:linbobri@foxmail.com
基金项目:国家自然科学基金项目(31160470);广西自然科学基金项目(2013GXNSFBA019114)
收稿日期:2015-03-02
doi:10.3969/j.issn.1006⁃267x.2015.08.011
文章编号:1006⁃267X(2015)08⁃2396⁃09
文献标识码:A
中图分类号:S823;S816.7
