5-羟甲基糠醛对皮质酮损伤型海马神经元P-synapsin Ⅰ蛋白表达的影响
2016-01-08张丽娜,张天良,金国琴等
5-羟甲基糠醛对皮质酮损伤型海马神经元P-synapsin Ⅰ蛋白表达的影响
张丽娜张天良1金国琴戴薇薇林梅2
(上海中医药大学基础医学院生化教研室,上海201203)
摘要〔〕目的观察熟地有效成分5-羟甲基糠醛对高浓度皮质酮致海马神经元损伤及学习记忆相关蛋白P-synapsinI蛋白表达的影响。方法用24 h新生大鼠制备原代海马神经细胞。培养第8天用皮质酮、RU38486、5-HMF处理细胞,将细胞分为正常组、模型组(1×10-4mol/L皮质酮)、拮抗剂组(10-4mol/L皮质酮+3 nmol/L RU38486)、5-羟甲基糠醛组(10-4mol/L 皮质酮+ 0.5 mg/L 5-HMF)。24 h后,通过SYTO13-PI双荧光染色法观察各组细胞的形态及存活情况,MTT法测定细胞活性,生化方法检测衰老特异性指标β-半乳糖苷酶活性, Western 印迹检测学习记忆相关分子P-synapsinⅠ的蛋白表达。结果与正常组相比,模型组细胞死亡较多,细胞活力下降,β-半乳糖苷酶活性升高,P-synapsinⅠ蛋白表达显著性降低;如上改变均被皮质酮受体拮抗剂RU38486逆转;一定浓度的5-羟甲基糠醛明显减少死细胞数量,提高细胞活力,降低β-半乳糖苷酶活性,提高模型细胞P-synapsinⅠ蛋白表达。结论0.5 mg/L 5-羟甲基糠醛可以保护大鼠海马神经细胞免遭高浓度皮质酮的损伤,通过调节学习记忆信号转导途径中的重要蛋白P-synapsinⅠ的蛋白表达,可能在延缓学习记忆功能退化中发挥作用。
关键词〔〕5-羟甲基糠醛;海马神经元;皮质酮;P-synapsinⅠ;熟地
中图分类号〔〕R966〔文献标识码〕A〔
基金项目:国家自然科学
Protein expression of P-synapsin Ⅰ following 5-HMF of SHUDI treatment in hippocampal neurons with corticosterone injury
ZHANG Li-Na,ZHANG Tian-Liang,JIN Guo-Qin,etal.ss
Department of Biochemistry,College of Basic Medicine,Shanghai University of TCM,Shanghai 201203,China
Abstract【】ObjectiveTo observe the effect of 5-HMF in SHUDI to P-synapsin Ⅰ protein expression in injured hippocampal neurons by high dose of corticosterone(CORT). MethodsHippocampal neurons were cultured from newborn (24 h) rats. On the eighth day the neurons were treated with CORT,RU38486 and 5-HMF. The cells were divided into control,model (containing 10-4mol/L CORT),RU38486 (containing 10-4 mol/L CORT+3 nmol/L RU38486) and 5-HMF (containing 10-4 mol/L CORT+0.5 mg/L 5-HMF) groups. 24 hours later,SYTO13-PI double-fluorescence staining,MTT assay,β-galactosidase assay and Western blot were carried out. ResultsCompared with the control group,both the cell survival rate and cell viability were decreased markedly (P<0.05),β-galactosidase activity was increased markedly(P<0.05) and P-synapsin Ⅰ protein expression was significantly decreased in model group. 5-HMF or RU38486 could invert above changes. Conclusions0.5 mg/L 5-HMF in SHUDI could significantly prevent the hippocampus neuron from injury. 5-HMF could change P-synapsin Ⅰ protein expression in injured hippocampal neurons by high dose of CORT to prevent and treat learning and memory impairment probably.
【Key words】5-HMF; Hippocampal neuron; Corticosterone(CORT); P-synapsin Ⅰ; SHUDI
1十堰市第十六中学2上海中医药大学教学实验中心
第一作者:张丽娜(1980-),女,在读博士,讲师,主要从事中西医结合基础(生化) 研究。
补肾滋阴药能有效改善老年学习记忆减退〔1〕。如以熟地为主药的左归丸、六味地黄丸等补肾复方均可以改善学习记忆功能〔2,3〕。大量实验也提示熟地本身也具有抗衰老及改善学习记忆的作用〔4,5〕。熟地即经过炮制加工后的地黄,在加工过程中5-羟甲基糠醛(5-HMF)含量比炮制前增加20倍左右,是熟地质量控制选择的量化指标之一〔6〕。大脑边缘系统——海马区域是糖皮质激素受体(GCR)密度最高的脑区,所以最容易受到高皮质酮血症的毒性影响,而海马又与学习记忆密切相关,故认为海马的皮质酮毒性可能是老年学习记忆退化的重要起始原因之一。本研究旨在探讨熟地改善老年学习记忆退化的分子机制及发挥作用的活性成分。
1材料与方法
1.1实验动物及主要试剂清洁级出生24 h内的SD大鼠,由上海中医药大学实验动物中心提供。DMEM高糖培养液(Hyclone)、胎牛血清(杭州四季青公司)、0.25% Trypsin、Neurobasal培养基及B27(Gibco)、皮质酮(US Biol)、RU38486、5-HMF(纯度≥99%)及MTT(Sigma)、DMSO(Amresco)、SYTO13染料(Invitrogen)、PI(碘化丙锭)染料、免疫组化SP通用试剂盒(上海长岛生物),兔抗鼠NSE多克隆抗体、P-synapsinI兔抗大鼠多克隆抗体、羊抗小鼠(兔)IgG-HRP二抗(Santa Cruz)。
1.2主要仪器B5060EK CO2培养箱(Heraeus,德国),Bio-hazard垂直式无菌无尘操作台(造鑫企业有限公司,上海),TH-3560灭菌锅(造鑫企业有限公司,台湾),XDS-1B荧光倒置相差显微镜(Olympus,日本),JA1003型电子分析天平(上海天平仪器厂),FR-200凝胶扫描分析系统(上海复日科技有限公司)
1.3海马神经细胞原代培养取新生24 h的SD大鼠5只,75%酒精消毒,断颈取头,置于无菌培养皿中,迅速用眼科剪剪开头部皮肤及颅骨,取出两侧大脑半球,用眼科剪小心分离出两侧海马,置入少量无血清高糖DMEM培养液中,剪成约1~2 mm3的小块后,加入0.25% Trypsin 0.02%EDTA 5 ml,把胰酶及组织块一并吸入15 ml离心管中。细胞培养箱中孵育30 min,期间每10 min轻轻摇晃1次。取出,吸弃上清液,加入5 ml种植液(含20%BSA的高糖DMEM)静置3 min以终止胰酶的消化。吸弃上清,再加入5 ml种植液,反复轻轻吹打25次,静置3 min,吸取并保留上清细胞悬液于50 ml离心管中(置于冰上)。沉淀中再次加入5~6 ml种植液,步骤同上。反复3~4次,直至组织块基本消失,合并每次细胞悬液至前一50 ml离心管中。细胞计数,种植液调整细胞浓度为0.5~1×107个/ml,接终于培养板中,96孔板120 μl,24孔板1 ml,6孔板3 ml。CO2细胞培养箱中培养。待细胞贴壁后,全量改培养液为neurobasal+B27 (体积比为49∶1),以后每2~3天半量换液,培养至第8天,进行NSE免疫细胞化学染色和分组用药处理。
1.4海马神经细胞的鉴定NSE特异的免疫细胞化学染色法。细胞接种于6孔板,孔数n=6。用NSE多克隆抗体,依据免疫组织化学SP通用试剂盒方法鉴定神经元。
1.55-HMF作用于模型细胞的量效观察 在以往工作的基础上〔7〕(采用浓度为10-4mol/L皮质酮作用海马神经元制备皮质酮损伤型海马神经细胞模型;用3 nmol/L皮质酮受体拮抗剂RU38486作用该模型可成功拮抗皮质酮对海马神经元的损伤;各用药组用药24 h,差异最显著),采用MTT法进行量效实验,确定用药组5-HMF(0.05,0.5,5,50 mg/L)最佳作用浓度。
1.6实验分组将培养至第8天的生长良好的海马神经元分组用药处理,共分为4组。用neurobasal+B27 (体积比为49∶1)培养基培养细胞,每2~3天换液`次。培养至第8天,弃去培养基,给贴壁细胞用药。第1组用前述培养基继续培养,即正常组;第2组用含终浓度为10-4mol/L皮质酮的培养基继续培养,即模型组;第3组用含终浓度为3 nmol/L皮质酮受体拮抗剂RU38486和终浓度为10-4mol/L皮质酮的培养基继续培养,即拮抗剂组;第4组含终浓度为0.5 mg/L 5-HMF和终浓度为10-4mol/L皮质酮的培养基继续培养,即5-HMF组。
1.7SYTO13-PI双荧光染色观察海马神经元形态及细胞存活率细胞接种于96孔板,每组细胞孔数n=6。每孔细胞加入2.5 μmol/L SYTO-13染液2 μl,用铝箔遮盖避光,室温放置15 min;再向每孔培养细胞中加入2 μl PI染液,用铝箔遮盖避光,室温放置15 min。小心吸弃上清液,用HEPES缓冲液轻轻洗涤2次,荧光显微镜下观察和拍照。
1.8MTT法测定细胞的活力细胞培养于96孔培养板,每组细胞孔数n=10。每孔细胞加入MTT试剂(5 mg/ml)20 μl,继续培养4 h,弃上清,加入150 μl DMSO,振荡10 min,酶标仪测定570 nm的吸光度(OD)值。
1.9β-半乳糖苷酶活性测定细胞培养于96孔培养板,每组孔数n=10。按照β-半乳糖苷酶测定试剂盒进行测定。文献报道,随着细胞老化,在pH 6.0的条件下,细胞内增高的β-半乳糖苷酶可降解其底物X-半乳糖,产生的蓝色产物随之增多。
1.10Western 印迹法测定学习记忆信号转导通路相关分子P-synapsinⅠ蛋白表达细胞接种于6孔板,每组细胞孔数n=6。参照DBI公司的动物细胞总蛋白抽提试剂盒和BCA蛋白定量试剂盒的方法抽提和定量细胞总蛋白。根据求出样品的实际蛋白含量,求得在20 μl总上样体积中的样品体积,保证每个样品上样量为30 μg。加入上样缓冲液,沸水浴中煮10 min。SDS-PAGE电泳,转膜,5%的脱脂奶粉封闭1 h,加入一抗,4℃过夜,PBST洗膜,加入二抗,37℃条件孵育45 min,PBST洗膜。ECL显色,图像分析仪进行光密度积分扫描,做定量分析。
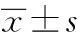
2结果
2.1神经元鉴定结果经过NSE特异的免疫细胞技术染色后,细胞的胞质和突起均被染成棕黄色(如图1)。清晰可见神经元的胞体、树突和轴突,表明海马神经细胞生长状态及纯度较好。

图1 NSE染色实验中培养第8天的海马神经元(×200)
2.25-HMF作用模型细胞的量效结果与正常组相比,10-4mol/L皮质酮处理的模型组细胞的活力显著下降(0.529±0.022 vs 0.722±0.015,P<0.05)。与模型组相比,5 mg/L 5-HMF与50 mg/L 5-HMF组的细胞活力显著下降(0.354±0.017,0.296±0.013,P<0.05),说明了此两种浓度的5-HMF对海马神经元具有损伤作用,而与模型组相比,0.5 mg/L 5-HMF组的细胞活力显著升高(0.637±0.010,P<0.05),0.05 mg/L 5-HMF组与模型组无差异(0.524±0.022,P>0.05)。
结合形态学观察,5 mg/L 5-HMF与50 mg/L 5-HMF组的绝大部分细胞消失,仅存的细胞也变小变圆,皱缩变形,细胞间连接完全消失;而0.5 mg/L 5-HMF组细胞形态与正常组相比并无显著区别,胞核及核仁、细胞突起均清晰可见,树突与轴突相连成神经网络结构;0.05 mg/L 5-HMF组细胞形态与模型组相比无显著差异,细胞突起及神经网络结构较正常组减少。
2.3SYTO13-PI双重荧光染色法观察各处理组海马神经细胞的存活情况PI染料可使死细胞染成红色,SYTO13可使活细胞染成绿色。与正常组比较,模型组红染细胞明显增多,绿染细胞减少,与模型组比较,加入5-HMF与拮抗剂处理后,均可以明显降低细胞死亡数量。拮抗剂RU38486对模型细胞存活率的改变证明了该损伤作用由皮质酮受体介导。见图2。
2.4MTT法检测细胞的活性与正常组细胞比较,模型组细胞活力明显下降(P<0.05)。皮质酮受体拮抗剂RU38486组和5-HMF组细胞活力较模型组明显升高(P<0.05)。见表1。
2.5各组细胞β-半乳糖苷酶活性与正常组细胞相比较,模型组细胞内β-半乳糖苷酶活性明显增高(P<0.05)。拮抗剂组、5-HMF组细胞内β-半乳糖苷酶活性明显较模型组下降(P<0.05)。见表1。
2.6Western 印迹法检测各组细胞P-synapsinⅠ蛋白表达与正常组相比,模型组细胞P-synapsinⅠ蛋白相对表达量显著性降低(P<0.05)。拮抗剂组、5-HMF组P-synapsinⅠ蛋白相对表达量较模型组均显著性升高(P<0.05)。见表1,图3。
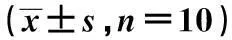

组别细胞活力570nmβ-半服糖苷酶活性505nmP-synapsinⅠ正常组0.748±0.0230.327±0.0900.927±0.065模型组0.538±0.0511)0.464±0.0441)0.082±0.0571)拮抗剂组0.658±0.0402)0.354±0.0332)0.605±0.0312)5-HMF组0.615±0.0362)0.353±0.0602)0.704±0.0492)
与正常组比较:1)P<0.05;与模型组比较:2)P<0.05
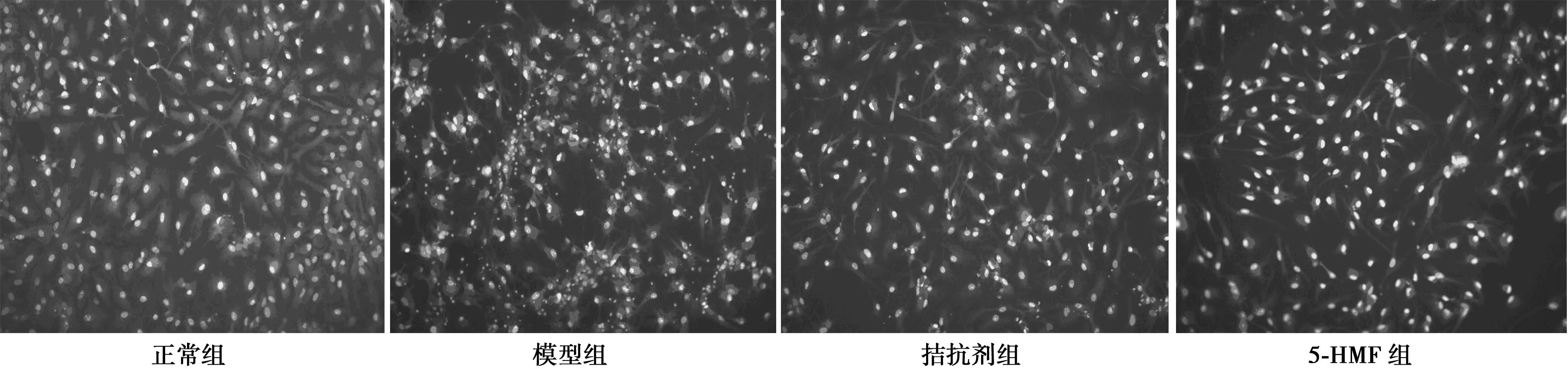
图2 用药24 h后的各用药组海马神经元SYTO1313-PI双重荧光染色(×200)

图3 药物处理24 h各组细胞P-synapsinⅠ蛋白表达
3讨论
SynapsinⅠ是神经元特异性突触前囊泡膜磷酸蛋白,是突触蛋白家族的第1个成员,被称为突触素Ⅰ或突触蛋白1〔8〕。突触蛋白磷酸化状态及其mRNA水平的改变可能引发多种神经疾病,因此突触素常被运用于神经系统疾病的研究中。SynapsinⅠ具有多种蛋白激酶磷酸化的多个位点,尤其是PKA、Ca2+/CaMKⅡ和MAPK的主要底物。当SynapsinⅠ处于非磷酸化状态时,可将储存库中的囊泡固定在细胞骨架上,使其准备随时进入囊泡循环;当突触前膜去极化,胞质内Ca2+浓度升高,激活PKA 、Ca2+/CaMKⅡ或通过BDNF-TrkB-MAPK通路磷酸化synapsinⅠ,囊泡即可从细胞骨架上释放出来,进入突触前膜的激活区,再进一步释放神经递质〔9〕。因此SynapsinⅠ的磷酸化水平可间接反映递质(如谷氨酸)的释放和突触的传递功能,参与学习记忆及LTP(突触传递功能长时程增强)诱导〔10,11〕。
本研究说明GCR是皮质酮损伤海马神经元活力和P-synapsinⅠ蛋白表达的重要中间环节。GCR属于细胞内受体,在海马细胞等最为丰富。5-HFM可以保护大鼠海马神经细胞免遭高浓度皮质酮的损伤,可能通过调节学习记忆信号转导途径中重要蛋白synapsinⅠ的磷酸化,在延缓学习记忆功能退化中发挥作用。
4参考文献
1戴薇薇,金国琴,张学礼,等.补肾方药对衰老大鼠海马学习记忆相关基因BDNF及其受TrkB mRNA表达的影响〔J〕.中华中医药杂志,2008;23(4):296-9.
2王亚娟,金国琴,戴薇薇,等.补肾方药延缓老年大鼠学习记忆减退的分子机制〔J〕.皖南医学院学报,2009;28 (4):235-8.
3Zhang HP,Zhang YX.P-60 Effect of serum from Liu Wei Di Huang decoction-treated rats on long-term potentiation in hippocampal slices from senescence accelerated mice〔C〕. Acta Pharmacol Sin,2003:342-51.
4Cui Y,Yan ZH,Hou SL,etal.Effect of Shu Di-huang on the transmitter and receptor of amino acid in brain and learning and memory of dementia model〔J〕.Chin J Chin Mater Med,2003;28(9):862-6.
5崔瑛,侯士良,颜正华,等.熟地黄对毁损下丘脑弓状核大鼠学习记忆及海马c-fos,NGF表达的影响〔J〕.中国中药杂志,2003;28(4):362-5.
6川口义夫.地黄的炮制对所含成分的变化〔J〕.国外医学·中医中药分册,1984;(5):44.
7顾翠英,金国琴,赵新永,等.皮质酮损伤大鼠海马神经细胞病理模型的建立及补肾方药的作用〔J〕.中药药理与临床,2010;26(2):10-2.
8Ferreira A,Rapoport M.The synapsins:beyond the regulation of neurotransmitter release〔J〕.Cell Mol Life Sci,2002;59(4):589-95.
9Hosaka M,Hammer RE,Sudhof TC. A phospho-switch controls the dynamic association of synapsins with synaptic vesicles〔J〕.Neuron,1999;24(2):377-87.
10Chen JJ,Yin DZ.A role of synapsin in the process of learning and memory〔J〕.Chem Life,2006;26(4):334-6.
11Chi P,Greengard P,Ryan TA.Synapsin dispersion and reclustering during synaptic activity〔J〕.Nat Neurosci,2001;4(12):1187-93.
〔2013-12-30修回〕
(编辑赵慧玲/曹梦园)
