巴戟天含药血清对成骨-破骨细胞共育体系原癌基因、核心结合因子1 mRNA表达的影响
2016-01-08李艺敏,陈健,何剑全等
巴戟天含药血清对成骨-破骨细胞共育体系原癌基因、核心结合因子1 mRNA表达的影响
李艺敏陈健1何剑全1张永晟2
(福建中医药大学, 福建福州350108)
摘要〔〕目的观察不同浓度巴戟天含药血清对体外培养成骨-破骨细胞共育体系中原癌基因(C-FOS)、核心结合因子(Cbfa)1 mRNA表达的影响。方法提取24 h内新生SD乳鼠颅盖骨分离培养成骨细胞,采用5周龄SD大鼠双侧股骨、胫骨的骨髓基质细胞,加入集落细胞刺激因子(M-CSF)和细胞核因子κB受体活化因子配体(RANKL)诱导培养破骨细胞。采用碱性磷酸酶(ALP)染色鉴定成骨细胞,抗酒石酸酸性磷酸酶(TRAP)染色、骨吸收陷窝甲苯胺蓝染色、电镜扫描等鉴定破骨细胞,体外建立成骨-破骨细胞共育体系,设置低、中、高三种浓度巴戟天含药血清组和不含药血清组,干预3 d后提取各组总RNA,应用逆转录-聚合酶链反应(RT-PCR)方法测定各组C-FOS、Cbfa1 mRNA表达量。结果不同浓度巴戟天含药大鼠血清对成骨-破骨细胞共育体系C-FOS有抑制作用,对Cbfa1 mRNA的表达有促进作用。高浓度含药血清组两者的表达差异显著(P<0.05,P<0.000 1)。结论巴戟天含药血清可抑制成骨-破骨细胞共育体系C-FOS的表达,促进Cbfa1 mRNA的表达,从而达到降低破骨细胞分化成熟及骨吸收活性,促进骨形成。
关键词〔〕巴戟天;成骨-破骨细胞共育体系;原癌基因(C-FOS);核心结合因子(Cbfa)1
中图分类号〔〕R73〔文献标识码〕A〔
基金项目:国家自然科学基金资助项目(No.81272168);福建省医学创新课题资助项目(No.2012-CXB-32)
通讯作者:陈健(1963-),男,博士,主任医师,硕士生导师,主要从事骨质疏松研究。
1厦门大学附属中山医院康复医学科2厦门大学医学院
第一作者:李艺敏(1986-),女,在读硕士,主要从事骨质疏松研究。
Effects of Morinda officinalis-containing serum on the mRNA expression of C-FOS and Cbfa1 in osteoblast and osteoclast co-cultured system
LI Yi-Min,CHEN Jian,HE Jian-Quan,etal.
Traditional Chinese Medicine University of Fujian,Fuzhou 350108,Fujian,China
Abstract【】ObjectiveTo observe the effects of the serum of Morinda officinalis(RMO) on the mRNA expression of C-FOS and core binding factor Alpha1(Cbfa1) in osteoblast and osteoclast co-cultured system. MethodsOsteoblasts were separated from the cranium of 24 hours newborn SD rat. Bone marrow cells were harvested from bilateral femora and tibiae of five weeks old SD rat,and M-CSF and RANKL were used to induce osteoclast formation. Osteoblast cells were confirmed by alkaline phosphatase(ALP) stain,osteoclast cells were confirmed by tartrate resistant acidphos phatase(TRAP) stain,Toluidine blue stain and bone resorption assay. Osteoblast and osteoclast co-cultured system was established in vitro. Low,middle,high concentrations of serum RMO and control groups were set. Total RNA was extracted after intervention 3 days,C-FOS and Cbfa1 mRNA expression were measured by real-time PCR. ResultsDifferent concentrations serum of RMO had inhibitory effect on the expression of C-FOS and enhance the mRNA expression of Cbfa1 mRNA,and the function on both indicated a statistically significant difference at high concentration(P<0.05,P<0.000 1). ConclusionsThe serum of RMO could down-regulate the expression of C-FOS and up-regulate Cbfa1 mRNA in osteoblast and osteoclast co-cultured system,consequently reduce osteoclast differentiation and activity of bone resorption,enhance bone formation.
【Key words】Morinda officinalis;Osteoblast and osteoclast co-cultured system;C-FOS;Core binding factor Alpha1
巴戟天能够有效减少骨量丢失,是中医治疗骨质疏松常用的中药之一,能有效提高去卵巢后大鼠骨密度(BMD)而起到抑制骨吸收作用。但巴戟天的有效成分及作用机制仍不明确。当前巴戟天对成骨(OB)-破骨细胞(OC)共育体系影响的研究甚少,尤其是对OC分化、成熟信号通路上原癌基因(C-FOS)以及OB分化信号通路核心结合因子(Cbfa)1基因的影响未见报道。本文观察巴戟天含药血清对OB-OC细胞共育体系的影响,探讨其抗骨质疏松的分子作用机制。
1材料与方法
1.1实验材料新生SD乳鼠及5周龄SD 大鼠(厦门大学实验动物中心提供〔SYXK(闽)2007-0004〕)。胎牛血清DMEM培养基、胰蛋白酶、青霉素、链霉素、Ⅱ型胶原酶(Gibco),巨噬细胞集落刺激因子(M-CSF)、 细胞核因子κB受体活化因子配体(RANKL)(Peprotech),抗酒石酚酸性磷酸酶(TRAP)染色试剂盒(Sigma),巴戟天颗粒(培力药业有限公司)。
1.2含药血清制备选用9只正常SD大鼠,每组3只,禁食12 h后,巴戟天溶液灌胃给药,给药剂量相当于临床等效剂量(根据人和动物体表面积折算的等效剂量比率表计算),所定低、中、高剂量分别为0.5,1,3 g/kg(1 g相当于生药3 g)。给药2次/d,灌胃3 d,最后一次服用全天剂量。采血前禁食12 h,末次给药1 h后将大鼠麻醉,无菌条件下心脏采血,室温静置2 h,3 000 r/min离心15 min,分离血清,同组血清混合,56℃水浴,30 min灭活,分装,-80℃冰箱保存备用。
1.3不含药血清的制备选用3只正常SD大鼠,只用生理盐水灌胃,方法同前。
1.4细胞培养
1.4.1OB培养取新生的SD大鼠乳鼠4只,置于75 %乙醇溶液中浸泡10 min。无菌条件下,取头骨,去除周围软组织及骨膜,剪碎成0.5 mm×0.5 mm大小的骨块,将骨碎片置于含2.5%乙二胺四乙酸(EDTA)胰酶液中消化30 min,离心弃液加Ⅱ型胶原酶继续消化1 h,每隔10 min振荡一次,1 h后离心800 r/min,3 min,并用磷酸盐缓冲液(PBS)重悬后再次离心(800 r/min,3 min),骨碎片接种于培养皿内,加入4 ml的DMEM全培养液,置入37℃、5%CO2培养箱内培养,隔3 d换一次液,等细胞铺满皿底后,采用差速贴壁法将成骨细胞纯化,重复3次后,再置培养箱内培养,隔3 d换液一次。
1.4.2OC培养按照文献〔1〕的方法分离大鼠骨髓基质细胞,加入M-CSF和RANKL诱导培养OC。
1.5体外建立OB、OC共育体系及含药血清干预培养5 d后分别用胰酶消化OC和第二代OB,将2×104个/ml的OC和2×104个/ml的OB加入6孔培养板中,充分混匀,制备成细胞悬液,置于37℃、5%CO2培养箱内共育培养2 d。2 d后更换培养液,改用不同浓度巴戟天含药大鼠血清的培养基与不含药大鼠血清的培养基,继续培养3 d。
1.6细胞形态特征观察用显微镜观察培养后的OB、OC细胞生长形态。
1.7OB、OC染色鉴定将贴有第二代成骨细胞的玻片取出,按说明书进行碱性磷酸酶(ALP)染色;7 d后将贴有破骨样细胞的玻片取出,按说明书进行TRAP染色,中性树胶封固后光镜下观察,TRAP(+)且细胞核≥3为破骨细胞。
参考文献1.8OC骨吸收功能的检测甲苯胺蓝染色、电镜扫描〔1〕进行。
1.9C-FOS、Cbfa1 mRNA表达的检测用Trizol(Sigma公司,美国)提取各组总RNA,采用紫外分光光度计计算OD260/OD280比值,确定RNA纯度。逆转录合成cDNA。PCR引物序列见表1。内参基因β-actin作为参照标准序列的设计公司(上海吉玛生物工程公司)。聚合酶链(PCR)反应混合物:FastStart Universal SYBR Green Master mix(罗氏公司,德国),加蒸馏水至最终体积为50 μl。在实时PCR扩增仪(ABI7500,美国)进行PCR反应,并使用系统(SDS文件)进行分析。按上述条件进行扩增循环。采用2-△△CT方法分析相关基因表达的数据。靶基因= 2-ΔΔCT×控制,ΔΔCT =治疗组(CT目的基因-CT参照基因)-对照组(CT目的基因-CT参照基因)。
表1PCR引物序列

基因引物序列条件产物长度(bp)C-FOS5'-CCCGTAGACCTAGGGAGGAC-3'5'-GAATACACTCCATGCGGTTG-3'(40)95℃,30s;60℃,45s;72℃,60s234Cbfa15'-AGTCCCAACTTCCTGTGCT-3'5'-GGTGAAACTCTTGCCTCGTC-3'(40)95℃,30s;60℃,45s;72℃,60s243β-actin5'-GAACCCTAAGGCCAACCGTG-3'5'-AGGCATACAGGGACAACACAGC-3'(35)94℃,45s;55℃,60s;72℃,60s315
1.10统计学分析使用SPSS18.0软件进行单因素方差分析。
2结果
2.1OB形态观察及鉴定颅盖骨碎片培养24 h后,可见少量细胞贴壁生长,呈长梭形,胞质透亮、饱满,48 h观察细胞数量逐渐增多,相邻骨块长出的细胞开始融合,72 h后细胞铺满瓶底,贴壁生长良好。第2代培养24 h后细胞贴附增殖加快,细胞膨大,呈不规则形或三角形;48 h后可见大部分细胞贴壁,伸展,成长梭形,3 d后细胞形态多样化,呈梭形、不规则形、多角形,5 d后细胞生长紧密连接,融合成片,部分区域重叠生长。细胞传代培养2 d后经ALP染色,95%以上的OB胞质呈阳性反应,胞质深蓝色,胞质和突起富含黑色颗粒ALP。见图1。
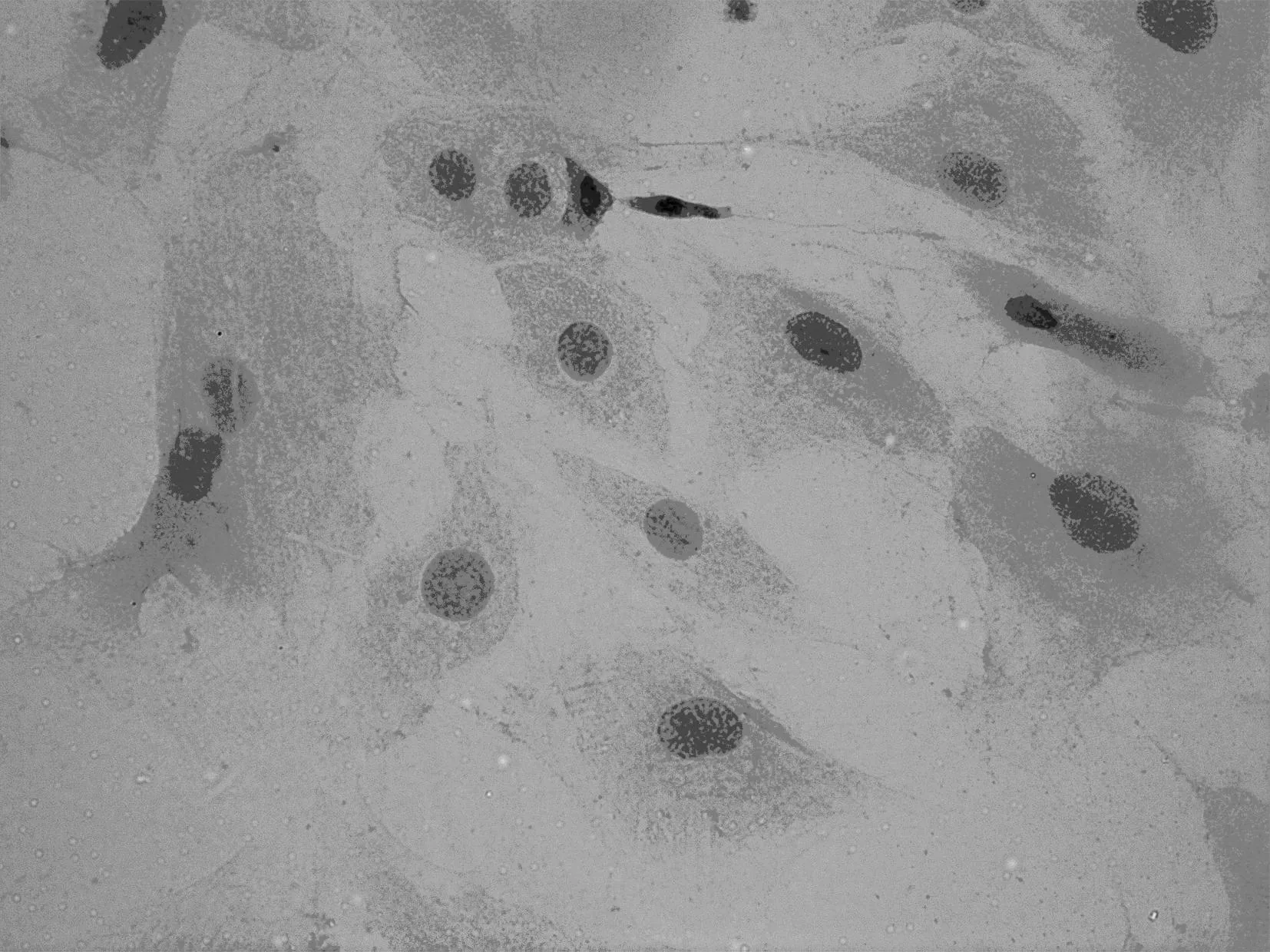
图1 OB形态及鉴定(ALP染色,×400)
2.2OC诱导培养结果及鉴定如图2所示,接种24 h后细胞开始逐渐贴壁,为体积均一的圆形细胞,分布均匀,72 h后细胞形态多样化,出现多核细胞(圆形、漏斗形、椭圆形或腊肠形等),细胞边缘不规则,有突起和片状或丝状伪足,细胞内可见

TRAP染色(×100)

骨陷窝甲苯胺蓝染色(×200)

骨陷窝电镜扫描(×2 000)
图2OC形态及鉴定
到几个或十几个细胞核,胞质有大小不等的空泡,色淡红,TRAP染色阳性;OC形态随着培养时间延长不断发生变化,体积不断增大,细胞数量逐渐增多融合。培养6 d后,甲苯胺蓝染色可见陷窝呈圆形、椭圆形、不规则形、腊肠型等多样形态的蓝色或紫蓝色深色区域;电镜扫描可见与正常骨组织相比陷窝明显凹陷,部分陷窝呈串珠样连接,陷窝融合后面积增大,边缘延续成贝壳状或不规则形状,形成纤维基底样形态。
2.3各组C-FOS、Cbfa1 mRNA基因表达的比较不含药血清组C-Fos、cbfal mRNA表达量为1.03±0.29,1.01±0.13;低剂量合药血清组分别为0.70±0.49,1.02±0.18;中剂量含药血清组分别为0.48±0.17,1.26±0.05;高剂量合药血清组分别为0.02±0.02,5.55±0.58。高浓度含药血清组C-Fos及Cbfa1 mRNA与无含药血清组比较差异显著(P=0.016 2,P<0.000 1)。
3讨论
OB和OC是骨重建的效应细胞,骨组织新陈代谢的动态平衡是通过OB促进骨形成,OC促进骨吸收来维系的。OB和OC之间的功能活动并不是相互独立的,二者之间的信号交谈对彼此功能的影响至关重要〔2〕。近年来中医药干预骨质疏松方面的体外实验,多是采用含药血清单纯对OB或OC干预实验,并不能代表体内骨代谢的实际情况。本实验采用分别培养OB与OC,然后以1∶1比例建立共育体系,更符合骨代谢的微环境,便于研究OB与OC之间的信号交谈及探讨相关信号分子的作用机制。
中药巴戟天具有滋补肝肾,强筋壮骨,祛风除湿等功能。有研究证明,巴戟天能够提高去卵巢大鼠血清钙、磷及护骨素水平;抑制OC分化及骨吸收,显著提高去卵巢大鼠股骨的骨密度〔3~6〕,说明巴戟天能够改善绝经后的骨量丢失,发挥抗骨质疏松作用。鲍蕾蕾等〔7〕实验表明巴戟天甲基蒽醌通过抑制OC的形成、分化和骨吸收功能来减少骨量丢失。何剑全等〔8〕实验发现巴戟天可降低骨质疏松大鼠OC RANK和CAⅡ的表达,从而达到抑制骨质疏松的作用。还有研究〔9,10〕发现巴戟天在一定程度上能够抑制OB的凋亡,促进体外培养OB增殖。以上研究提示巴戟天抗骨质疏松的作用不单是通过抑制骨吸收,还有促进骨形成。近年来,在骨质疏松防治方面,中医药的研究有很大进展〔11〕。
C-FOS基因是原癌基因的重要成员。其表达产物C-FOS蛋白具有多种生物学作用,参调控细胞的生长、增殖、分化等。C-FOS在OC分化过程中起重要的调控作用〔12〕。有研究〔13〕显示紫穗槐素能够通过下调C-FOS、治化T细胞核因子(NFATc)1的表达,阻止OC生成。林华等〔14〕的实验提示癌基因C-FOS与原发性骨质疏松的关系密切,原发性骨质疏松时C-FOS表达增高与骨细胞和OB的凋亡有关。在代谢性疾病的研究中,发现人参皂甙Rh2可控制癌症和其他包括OC分化的代谢疾病,其可抑制骨髓巨噬细胞向OC分化,显著降低诱导转录因子C-FOS和T细胞活化的核因子RANKL的表达〔15〕。研究〔16〕发现咖啡酸苯乙酯可抑制OC分化形成,且通过抑制RANKL及其下游的NFATc1和C-FOS转导通路抑制OC的形成。羧酸通过抑制OC前体细胞C-FOS蛋白的表达,从而阻止OC形成,防止骨量丢失〔17〕,说明C-FOS基因与骨质疏松的发生密切相关。本研究说明巴戟天含药血清能够通过抑制C-FOS mRNA的表达降低骨吸收活性,阻止骨量丢失。
Cbfa1是骨形成的关键因子,它能上调非OB或OB前体细胞成骨分化相关基因的表达,使其向OB分化〔18〕。Cbfa1在胚胎骨发育期,间充质细胞凝集阶段就有表达,此阶段缺失Cbfa1将无OB形成〔19〕。李楠等〔20,21〕发现巴戟天多糖能够促进OB转化生长因子β1 mRNA、Cbfa1 mRNA的表达。有研究〔22〕表明染料木素可通过p38 MAPK-Cbfa1途径,刺激骨髓基质细胞向OB分化。Cbfa1与骨髓基质细胞向OB分化过程密切相关,而巴戟天水提物和巴戟天醇提物均能使此过程中Cbfa1表达加强,且巴戟天醇提物使Cbfa1的表达强于巴戟天水提物,提示巴戟天的作用机制主要是促进骨髓基质细胞成骨分化,从而达到骨形成。本试验中随着巴戟天含药血清浓度的上升,在高浓度时出现统计学差异,说明巴戟天含药血清可以通过加强Cbfa1 mRNA的表达促进骨形成。
本实验表明了巴戟天含药血清在这个共育体系中能够显著抑制OC C-FOS的表达;巴戟天含药血清能够促进共育体系中OB分化,抑制OC成熟,从而达到抑制骨吸收,促进骨形成的功能作用。巴戟天抗骨质疏松的详细分子作用机制及具体的有效成分尚不明确,有待进一步研究。
4参考文献
1何剑全,陈健.两种大鼠骨髓源破骨样细胞诱导方法的比较〔J〕.中国老年学杂志,2011;31(10):1014-6.
2Stains JP,Civitelli R.Cell-cell interactions in regulating osteogenesis and osteoblast function〔J〕.Birth Defects Res C Embryo Today,2005;75(1):72-80.
3Li N,Qin LP,Han T,etal.Inhibitory effects of morinda offcinails extract on bone loss in ovariectomized rats〔J〕.Molecules,2009;14(6):2049-61.
4朱猛勇,王彩娇,郝长胜.巴戟天多糖对骨质疏松大鼠血清护骨素表达影响的研究〔J〕.现代实用医学,2010;22(7):748-9.
5朱猛勇,郝长胜,王彩娇.巴戟天多糖对骨质疏松大鼠骨密度及血清微量元素的影响〔J〕.中草药,2010;41(9):1513-5.
6Zhu MY,Wang CJ,Zhang HS,etal.Protective effect of polysaccharides from morinda officinalis on bone loss in ovariectomized rats〔J〕.Int J Biol Macromol,2008;43(3):276-8.
7鲍蕾蕾,卞俊,张巧艳,等.巴戟天2-羟基-3-羟甲基蒽醌对破骨细胞性骨吸收的影响〔C〕.2010年中国药学大会暨第十届中国药师周大会论文集,2010:1-8.
8何剑全,陈健,郑素玉,等.巴戟天含药血清对原代破骨细胞RANK和CAIImRNA表达的影响〔J〕.中国骨质疏松杂志,2013;19(5):469-75.
9李楠,王和鸣,郭素华,等.巴戟天多糖含药血清对体外培养成骨细胞凋亡的保护作用观察〔J〕.中国骨伤,2008;21(1):39-41.
10李楠,王和鸣,郭素华,等.巴戟天多糖及其水提取物对体外培养成骨细胞活性的影响〔J〕.中国组织工程研究与临床康复,2007;23(12):4570-2.
11何嘉承,林燕萍.中医药对体外破骨细胞功能的干预作用〔J〕.中医正骨,2010;22(9):25-71.
12Huang H,Ryu J,Lee ZH,etal.Induction of c-fos and NFATc1 during RANKL-stimulated osteoclast differentiation is mediated by the p38 signaling pathway〔J〕.Biochem Biophy Res Commun,2006;351(1):99-105.
13Kim BG,Kwak HB,Choi EY,etal.Amorphigenin inhibits osteoclast differentiation by suppressing c-fos and nuclear factor of activated T cells〔J〕.Anat Cell Biol,2010;43(4):310-6.
14林华,魏海燕,蒋青,等.原发性骨质疏松骨组织c-fos、c-jun和p53基因的表达〔J〕.中国骨肿瘤骨病,2003;23(6):368-71.
15He L,Lee J,Hyuk J,etal.Ginsenoside Rh2 inhibits osteoclastogenesis through down-regulation of NF-κb,NFATc1 and c-fos〔J〕.Bone,2012;50(6):1207-13.
16Ha J,Choi HS,Lee Y,etal.Caffeic acid phenethyl ester inhibits osteoclastogenesis by suppressing NFκB anddownregulating NFATc1 and c-fos〔J〕.Int Immunopharmacol,2009;9(6):774-80.
17Lee JH,Kim HN,Yang D,etal.Trolox prevents osteoclastogenesis by suppressing RANKL expression and signaling〔J〕.J Biol Chem,2009;284(20):13725-34.
18Ducy P,Zhang R,Geoffroy V,etal.Osf2 /Cbfa1:a transcriptional activator of osteoblast differentiation 〔J〕 .Cell,1997;89(5):747-54.
19Karsenty G,Ducy P,Starbuck M,etal.Cbfa1 as a regulator of osteoblast differentiation and function〔J〕.Bone,1999;25(1):107-8.
20李楠,王和鸣,郭素华,等.巴戟天多糖对体外培养成骨细胞核心结合因子Cbfa1mRNA表达的影响〔J〕.中华中医药杂志,2007;22(8):517-9.
21王和鸣,王力,李楠.巴戟天对骨髓基质细胞向成骨细胞分化过程Cbfa1表达的影响〔J〕.中国中医骨伤科杂志,2004;12(6):22-6.
22Liao QC,Xiao ZS,Qin YF,etal.Genistein stimulates osteoblastic differentiation via p38 MAPK-Cbfa1 pathway in bone marrow culture〔J〕.Acta Pharmacol Sin,2007;28(10):1597-602.
〔2014-10-09修回〕
(编辑冯超/曹梦园)
