亚麻籽胶微波辅助提取与热水浸提方法比较研究
2016-01-03李小凤赵倩竹滕英来廖文镇李爱军汪MartinReaney
李小凤 赵倩竹 滕英来 廖文镇 李爱军汪 勇 Martin J.T.Reaney
亚麻籽胶微波辅助提取与热水浸提方法比较研究
李小凤1,2赵倩竹1,2滕英来1,2廖文镇1,2李爱军1,2汪 勇1,2Martin J.T.Reaney1,3
(暨南大学食品科学与工程系暨南大学-萨斯喀切温大学“油料生物炼制与营养”联合实验室1,广州 510632)
(广东省油脂生物炼制工程技术研究中心2,广州 510632)
(萨斯喀切温大学植物科学系3,加拿大萨斯卡通 S7N 5A8)
本研究通过单因素和正交优化试验分别确定了热水浸提与微波辅助提取两种方法提取亚麻籽胶的最佳工艺条件。结果表明,热水浸提法提取亚麻籽胶的最佳工艺为:温度80℃、时间6 h、料液比1∶10、提取次数1次;该条件下亚麻籽胶得率为7.28%,所得的亚麻籽胶中,多糖质量分数为68.13%,蛋白质质量分数为10.21%。微波辅助提取的最佳工艺为:温度80℃、时间1 h、料液比1∶10、输出功率600 W、搅拌速度900 r/min、提取次数1次;该条件下亚麻籽胶得率为6.46%,其中多糖质量分数为63.13%,蛋白质质量分数为13.75%。通过扫描电镜对提胶前后亚麻籽表面微观形态分析表明,胶液的溶出会破坏亚麻籽表面,微波处理对亚麻籽表层结构破坏大于热水浸提。红外吸收光谱分析表明,所得提取物在1 410 cm-1的C-H变角振动和2 930 cm-1的C-H伸缩振动以及1 039 cm-1的O-H变角振动,构成了糖环的特征吸收峰,证明获得的亚麻籽提取物为亚麻籽胶。
全亚麻籽 亚麻籽胶 热水浸提 微波辅助提取 扫描电镜 红外光谱
亚麻(Linum ustitatissimum L.)是世界五大油料作物之一,主要产于加拿大、中国、美国、印度、乌克兰、英国和俄罗斯等国家[1]。亚麻籽是亚麻的种子,呈平椭圆状,种皮颜色分为黄色和棕色,主要由胶质薄膜、种皮、胚乳和子叶组成(图1)[2]。亚麻籽营养成分丰富,其胚乳和子叶富含不饱和脂肪酸和必需氨基酸,具有较高营养价值[3]。此外,亚麻籽还含有丰富的糖类,按其溶解性分为水溶性多糖与水不溶性多糖,水不溶性多糖主要包括纤维素和木酚素,水溶性多糖中主要成分是亚麻籽胶,主要存在于亚麻籽最外层的胶质薄膜层,其质量分数约为6.5%~10.2%,随品种来源不同而有所差异[4]。亚麻籽胶主要成分为多糖,由木糖、阿拉伯糖、葡萄糖、半乳糖、鼠李糖和岩藻糖组成。研究表明,亚麻籽胶作为一种可溶性的膳食纤维,具有降低血胆固醇水平、减少冠状动脉硬化、降低糖尿病、预防结肠癌等作用,具有广阔的发展前景[5]。
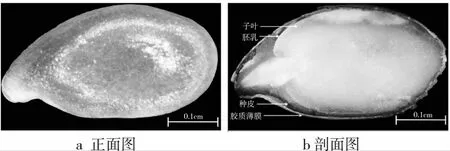
图1 亚麻籽的正面图和剖面图[2]
目前,亚麻籽胶主要从脱脂饼粕、亚麻籽壳、全亚麻籽或亚麻籽粉中提取,提取方法根据是否用水做溶剂分为干法和湿法[6]。Kitahara Koji等[7]提出干法脱除亚麻籽胶的概念,干法是指用打磨的方法实现亚麻籽胶的分离。杨金娥等[8]采用高速旋转砂辊对亚麻籽表面进行打磨提取亚麻籽胶粉的技术。干法制备工艺简单、产率高,不影响压榨亚麻籽油品质,但生产的亚麻籽胶产品含量不高、黏度低、质量较差,使用范围受限。湿法是指以水作为主要浸提剂,Ziolkovska等[9]以全亚麻籽为原料,水为浸提剂,采取三级逆流法提取亚麻籽胶。湿法生产的亚麻籽胶具有产品质量高、黏度高的优点,但提胶后亚麻籽需要长时间烘干,能量消耗大。
微波辅助提取主要是利用微波热效应使萃取体系中的极性溶剂产生大量热量,溶剂分子迅速汽化导致细胞内压力上升,从而使细胞壁和细胞膜形成微小的孔洞,有利于胞外溶剂进入胞内溶解并释放出胞内产物[10]。近年来,微波辅助提取法受到广泛关注,如Ganzler等[11]用微波辅助提取从羽扇豆中提取生物碱;有研究采用微波辅助提取桑叶多糖,与其他提取方法相比,大大缩短了提取时间,且提取率高达9.41%[12];但微波法提取亚麻籽胶的研究鲜有报道。本研究以亚麻籽为原料,通过优化传统热水浸提和微波辅助提取亚麻籽胶的工艺条件,对比了2种方法在亚麻籽胶得率、多糖提取率、亚麻籽提取前后表面微观形貌变化及其红外谱图方面的差异性,为深入研究亚麻籽胶提取技术提供参考。
1 材料与方法
1.1 材料
1.1.1 原料与试剂
亚麻籽购自中国内蒙古乌兰察布市;D-木糖标准品:成都西亚化工股份有限公司;考马斯亮蓝G250、牛血清蛋白:北京梦怡美生物科技有限公司;硫酸、苯酚、无水乙醇、硼酸等均购自天津市富宇精细化工有限公司。
1.1.2 仪器
DF-101S集热式恒温加热磁力搅拌器:巩义市予华仪器有限责任公司;KDC-1044型低速离心机:科大创新股份有限公司中佳分公司;RE-52AAA型旋转蒸发器:上海嘉鹏科技有限公司;SHZ-D(Ш)型循环水式真空泵:巩义市予华仪器有限责任公司;Scientz-10N型冷冻干燥机:宁波新芝生物科技有限公司;722s可见分光光度计:上海菁华科技仪器股份有限公司;EQUINOX-55型红外光谱仪:德国Bruker公司;JSM-6490扫描电镜:日本电子株式会社(JEOL)公司;MAS-II型常压微波合成/萃取反应工作站:上海新仪微波化学科技有限公司。
1.2 方法
1.2.1 亚麻籽胶提取工艺
工艺流程:亚麻籽→浸提→过筛→胶液蒸发浓缩→醇沉→离心→沉淀溶于水→旋蒸除乙醇→冷冻干燥→粗亚麻籽胶。
称取除杂后的亚麻籽25.00 g,装入1 000 mL的圆底烧瓶中,加入100~475 mL的去离子水,然后置于磁力搅拌器或者微波辅助萃取装置加热到指定温度(50~90℃)进行浸提,浸提一段时间(2~8 h)后过20目筛,将浸提液减压浓缩至50 mL冷却后加入4倍体积无水乙醇,搅拌混匀,4℃下冷藏过夜,离心(3 500 r/min,15 min)弃上清,收集沉淀,再将沉淀复溶于5倍体积的去离子水,再次减压蒸发除去乙醇,后经真空冷冻干燥得粗亚麻籽胶,测定其中的多糖与蛋白质含量。
1.2.2 木糖标准曲线的绘制
采用硫酸-苯酚法绘制标准曲线[13],将木糖标准品置于105℃下干燥至恒重后准确称取20.00 mg,加蒸馏水溶解,并定容至500 mL,得到0.04 mg/mL的木糖标准液。用移液器分别移取0.40、0.60、0.80、1.00、1.20、1.40、1.60、1.80 mL 的木糖标准液于15 mL试管中,用蒸馏水补至2.00 mL。向试管中加入1.00 mL的6%苯酚溶液及5.00 mL的浓硫酸,漩涡混匀,在室温下放置30 min冷却后于490 nm测吸光值。以木糖含量(μg/mL)作为横坐标,吸光值(A)作为纵坐标,绘制标准曲线。
1.2.3 牛血清蛋白标准曲线的绘制
称取10.00 mg牛血清蛋白,用生理盐水定容至100 mL,得到0.10 mg/mL的牛血清蛋白标准溶液;分别移取0、0.20、0.40、0.60、0.80、1.00 mL 的标准液,用蒸馏水补至1.00 mL;分别向试管中加入5.00 mL的考马斯亮蓝试剂摇匀,放置5 min后于595 nm测吸光值。以牛血清蛋白含量(μg/mL)作为横坐标,吸光值(A)作为纵坐标,绘制标准曲线。
1.2.4 亚麻籽胶的提取
1.2.4.1 热水浸提
单因素试验:以亚麻籽胶得率为指标,采用热水浸提法提取亚麻籽胶,考察料液比、温度、浸提时间、提取次数对亚麻籽胶得率的影响。
正交试验设计:在单因素试验的基础上,确定提取次数为1次的条件下,对料液比、温度、浸提时间进行三因素三水平的正交试验,具体的因素水平见表1。
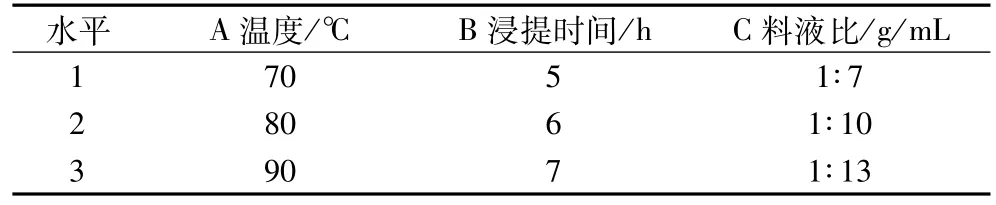
表1 热水浸提亚麻籽胶的正交试验因素水平表
1.2.4.2 微波辅助提取
单因素试验:以亚麻籽胶得率为指标,在热水浸提研究的基础上,采用微波辅助法提取亚麻籽胶,固定提取温度80℃,料液比1∶10,提取1次,考察浸提时间、输出功率、搅拌速度对亚麻籽胶提取率的影响。
正交试验设计:在单因素试验的基础上,对浸提时间、输出功率、搅拌速度进行三因素三水平的正交试验,具体的因素水平见表2。
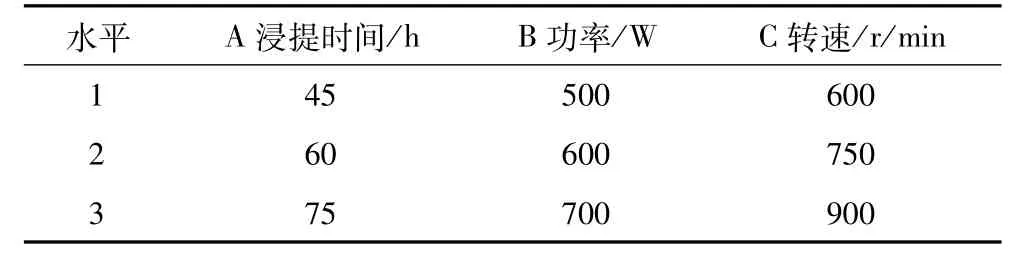
表2 微波辅助提取亚麻籽胶的正交试验因素水平表
1.2.5 亚麻籽胶得率、多糖提取率以及亚麻籽胶中蛋白、多糖含量相关计算
亚麻籽胶得率Y1=冷冻干燥后粗亚麻籽胶质量/本组亚麻籽质量×100%
亚麻籽胶中多糖含量M1=吸光值对应的亚麻籽胶多糖浓度×稀释倍数/干燥样品亚麻籽胶浓度×100%
亚麻籽胶中蛋白含量M2=吸光值对应的亚麻籽胶蛋白浓度×稀释倍数/干燥样品亚麻籽胶浓度×100%
亚麻籽胶多糖提取率Y2=冷冻干燥后粗亚麻籽胶质量×M1/本组亚麻籽质量×100%
1.2.6 两种方法亚麻籽胶得率、多糖提取率等的比较
采用热水浸提法和微波辅助提取法(分别在优化提取条件下)提取亚麻籽胶,通过相关计算比较亚麻籽胶得率、亚麻籽胶多糖提取率、亚麻籽胶中蛋白及多糖含量。
1.2.7 扫描电镜(SEM)
随机选取几颗提取前后的亚麻籽,置于铜台上,经喷金处理后,置于扫描电镜下观察亚麻籽表面形态。
1.2.8 红外分析(IR)
取3 mg冷冻干燥后亚麻籽胶样品与溴化钾混合研磨压片,室温条件下在4 000~400 cm-1范围内进行红外光谱扫描,分辨率为1 cm-1,扫描频率32/cm-1,记录扫描图谱。
2 结果与讨论
2.1 标准曲线的绘制
木糖标准曲线的回归方程为y=0.020x-0.022,R2=0.995;蛋白标准曲线的回归方程为y =0.005x+0.088,相关系数R2=0.999。
2.2 热水浸提法条件优化
本研究中,热水浸提法的优化实验结果表明:①亚麻籽胶得率随着浸提温度的增加而逐步增加(图2a),到了80℃得率增加比较缓慢,温度过高会使亚麻籽中其它成分溶出[14],从而影响亚麻籽胶的纯度,同时也会给后续亚麻籽胶的分离过程带来困难。因此,试验选择80℃作为后续浸提温度。②亚麻籽胶得率随着浸提时间的增加而逐步增加,最后趋于平稳状态(图2b)。在5~6 h的时候增加幅度最大,考虑提取效率,试验选择浸提时间为6 h。③随着料液比的增加,亚麻籽胶得率逐渐提高,当料液比大于1∶10时,亚麻籽胶的增长不显著(图2c),却会增加后续浓缩干燥的耗能,耗时,因此试验选择料液比为1∶10。④亚麻籽胶得率随着提取次数的增加而提高,提取1次时,亚麻籽胶得率为7.19%,达到了提取4次时得率的80.71%(图2d),可认为提取1次已将大部分亚麻籽胶浸提出来,再增加提取次数对亚麻籽胶的得率影响不大,但会加大后续浓缩,离心,干燥的工作量,增加能耗,所以试验选择提取次数为1次。
通过表3极差分析可知,各因素对亚麻籽胶得率影响的顺序为A>B>C,即:浸提温度>浸提时间>料液比。根据方差分析,亚麻籽胶的最佳浸提条件是A3B2C2,但考虑到温度过高会影响亚麻籽胶的性质及纯度,因此本试验选取最优工艺为A2B2C2,即在浸提温度80℃、反应时间6 h、料液比为1∶10。经试验验证,本工艺条件下,亚麻籽胶得率最高为7.28%。
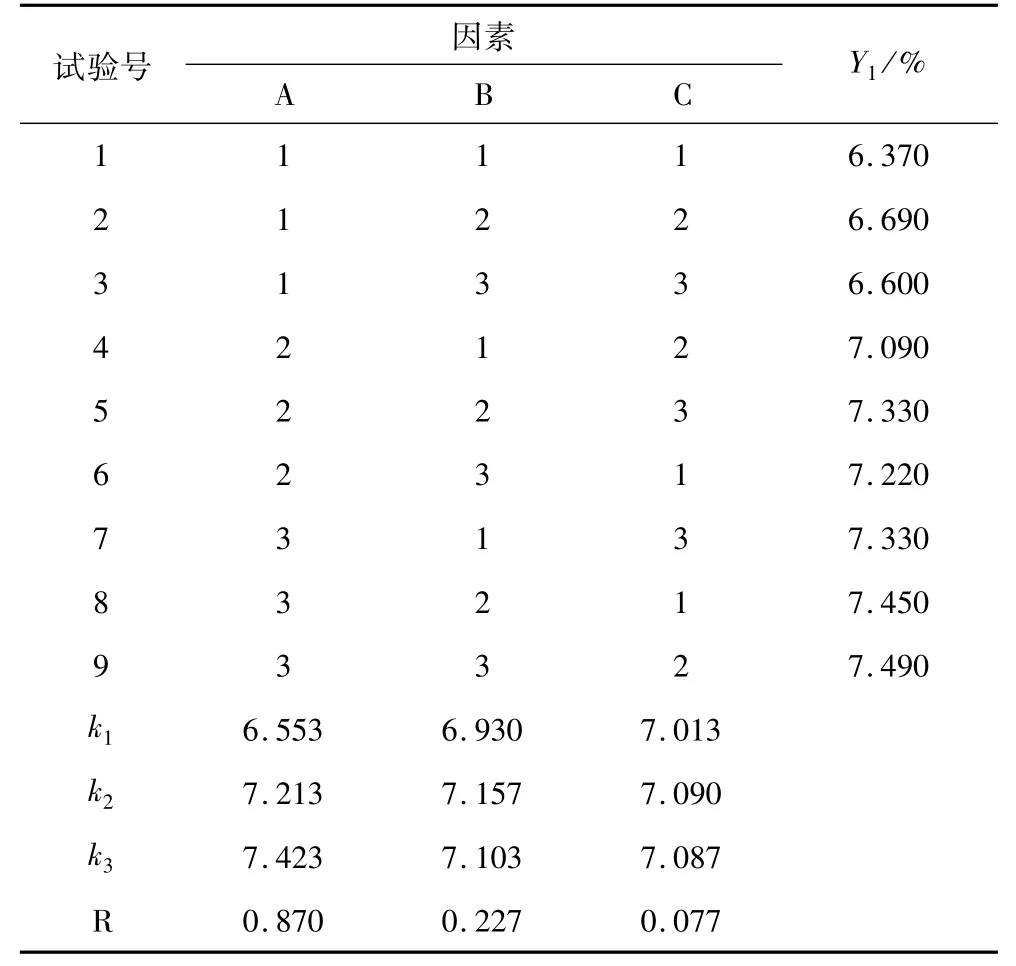
表3 热水浸提亚麻籽胶的正交试验结果
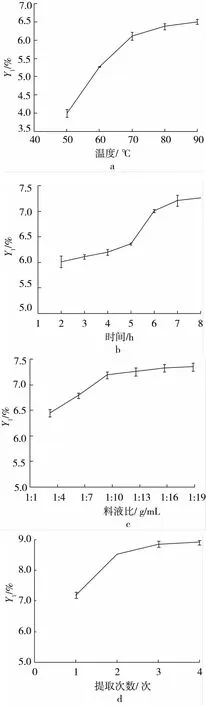
图2 热水浸提不同因素对亚麻籽胶得率的影响
2.3 微波辅助提取法条件优化
本研究中,微波辅助提取优化试验结果表明:①亚麻籽胶得率随着微波辅助浸提时间的增加而逐步增加(图3a),在60 min以后增长幅度不大,考虑提取效率,试验选择60 min作为后续浸提时间。②亚麻籽胶得率随着提取功率的增加先增加后减少(图3b)在600 W的时候达到最大值,试验选择输出功率为600 W。③随着搅拌速度的增加,亚麻籽胶得率逐渐提高,最后趋于平稳(图3c),试验选择搅拌速度为750 r/min。
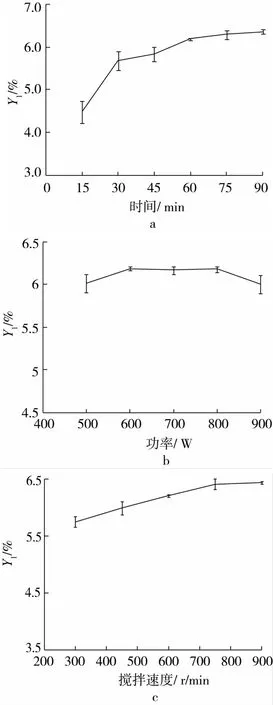
图3 微波辅助浸提不同因素对亚麻籽胶得率的影响
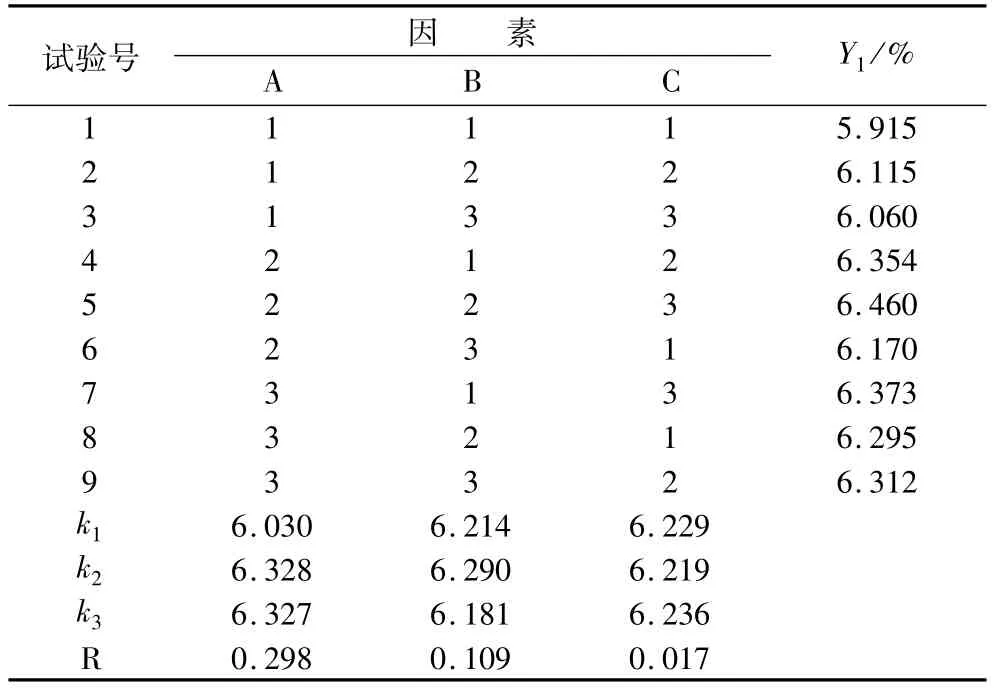
表4 微波辅助浸提亚麻籽胶的正交试验结果
通过表4极差分析可知,各因素对亚麻籽胶得率影响的顺序为A>B>C,即:浸提时间>输出功率>搅拌速度。根据方差分析,亚麻籽胶的最佳浸提条件是A2B2C3,即在浸提时间60 min、输出功率600 W、搅拌速度900 r/min,经试验验证,本工艺条件下,亚麻籽胶的得率最高为6.46%。
2.4 两种方法得率、提取率比较
由表5可知,热水浸提亚麻籽胶得率较微波辅助提取高了11.26%,亚麻籽胶中多糖提取率提高了17.14%,但它使用的时间为微波辅助浸提的6倍,提胶效率低;微波辅助提取时间短,亚麻籽胶得率略低于热水浸提。叶垦等[15]报道的湿法中试提取亚麻籽胶的得率为6.26%,略低于本研究热水浸提的7.28%,原因可能是本研究中的提取温度高于其提取温度。Cui等[16]在优化条件下,亚麻籽胶得率为8.00%左右,与本研究热水浸提结果接近。Qian
等[17]以亚麻籽壳为原料,室温下浸泡整夜,最后粗亚麻籽胶产率为9.70%,与本研究中以亚麻籽为原料,80℃下浸泡6 h,粗亚麻籽胶得率为7.28%比较,前者较后者亚麻籽胶得率相差2.42%,但其使用的时间为后者的2倍,且亚麻籽胶主要存在于亚麻籽壳中。
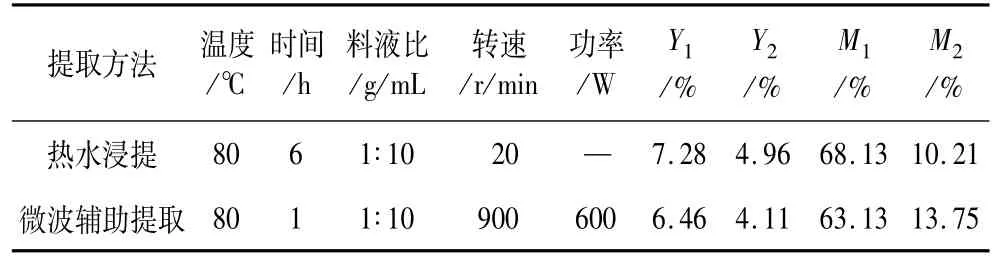
表5 不同方法提取亚麻籽胶的测定结果
两种方法提取出来的亚麻籽胶均为黄色,但微波辅助提取物颜色要深于热水浸提,有微香,溶于水,不溶于乙醇、丙酮等有机溶剂。微波辅助提取法和热水浸提法提取出来的总糖质量分数分别为68.13%与63.13%,蛋白质质量分数分别为10.21%与13.75%。热水浸提亚麻籽胶中多糖的含量高于微波辅助浸提而蛋白含量低于微波辅助浸提,原因可能是微波热效应造成多糖的分解以及更多的蛋白游离出来。另外,与传统的水提法相比,微波辅助提取时间缩短,提取效率高,但微波辅助提取需要特定的设备,能耗较高,造成生产成本增加。综合比较,本研究中的热水浸提有一定优势。
2.5 SEM分析结果
Gutterman 等[18]在研究奇亚籽(Chia seeds)时,发现胶液的溶出与细胞壁及次生细胞壁关系密切。亚麻籽胶主要存在于亚麻籽的黏膜表层,为了进一步确认两种不同提取方法对亚麻籽表面微观变化的影响,我们采用扫描电镜对亚麻籽表面形态进行分析。图4a、图4b显示了提取前亚麻籽的扫描电镜图,亚麻籽胶主要存在于亚麻籽表面,经浸提后表层往往会产生胶液。图4中分别显示了热水浸提以及微波辅助提取后的亚麻籽,亚麻籽经浸提后,表面的细胞像间隔的网状结构覆盖了整个表层,同时胶液的溶出使得表面光滑的胶质薄膜明显变得凸凹不平[19]。对比图4c和图4d,发现微波辅助提取较热水浸提法对亚麻籽的表面破坏更大,热水浸提的亚麻籽表面保存相对完整;而对比图4e和图4f可以发现微波辅助提取的细胞表面凹陷程度大于热水浸提,这可能是由于微波穿透萃取介质到达物料内部的细胞组织和维管束层,细胞温度快速上升,导致细胞内压超过细胞壁所能承受的压力,造成细胞破裂,使得内部活性成分游离出来[20]。综合表明,胶液的溢出使亚麻籽表面由平滑变得粗糙,并且微波辐射较热水浸提加快了细胞破碎,对亚麻籽表层结构起到更大的破坏作用。
2.6 红外分析结果
为了进一步确定微波提取和水提的亚麻籽胶结构差异,本研究分别对2种亚麻籽胶进行红外光谱的分析,结果如图5所示。2种亚麻籽胶均在3 390~3 429 cm-1之间具有较宽的吸收峰,可能为O—H的伸缩振动或者N—H的伸缩振动;在2 930 cm-1附近具有弱吸收峰为烷基的C—H伸缩振动;在1 610 cm-1附近,具有强吸收峰,可能是羧基的伸缩振动,也有可能是结晶水特征峰;在1 410 cm-1附近为C—H变角振动特征峰,它和C—H的伸缩振动构成了糖环的特征吸收;而在1 039 cm-1处有强吸收峰为O—H的变角振动,也是糖环的特征吸收峰[21]。说明水提法与微波辅助浸提法所得的亚麻籽胶基团无显著性差异,且所得的亚麻籽胶中都具有明显糖环的特征吸收峰。
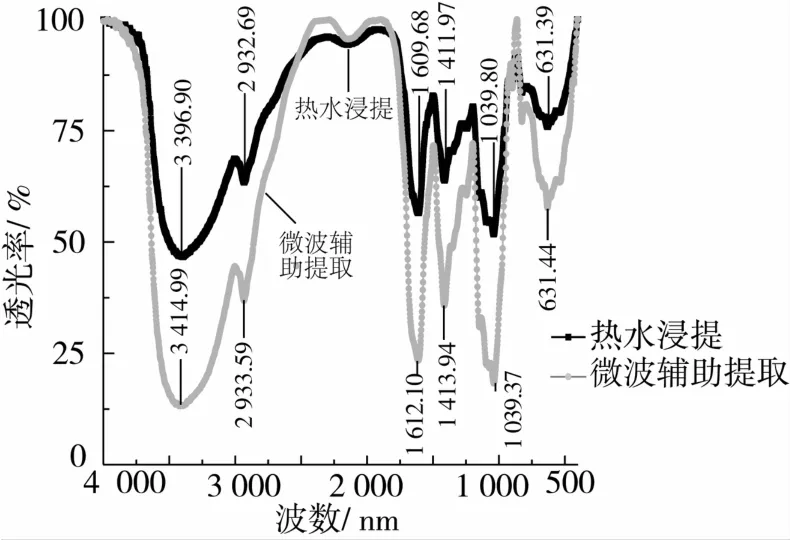
图5 热水浸提和微波辅助提取亚麻籽胶的红外图谱
3 结论
本研究以亚麻籽胶得率为指标,优化了热水浸提和微波辅助提取亚麻籽胶的操作条件,结果表明热水浸提最佳条件为:温度80℃,时间6 h,料液比1∶10,提取次数为1次;在热水浸提的基础上对微波辅助提取进行优化的最佳条件为:温度80℃,时间1 h,料液比1∶10,功率600 W,转速900 r/min,提取1次。热水浸提法较微波辅助浸提法,亚麻籽胶的得率较高约7.28%,其中多糖质量分数为68.13%。微波辅助提取亚麻籽胶,提取时间短,提取效率较高,具有潜在的应用价值。同时,SEM图表明微波对亚麻籽的破坏能力大,造成更多的胞内物质游离出来,与吸光光度法测定其蛋白含量高于热水浸提相吻合。另外热水浸提和微波辅助提取的亚麻籽胶红外分析的结果,间接证明提取物含有大量的多糖,结合吸光光度法测定的多糖和蛋白质量分数约为65%和10%,即可判定提取物即所要的亚麻籽胶。
[1]高凤云,张辉,贾霄云,等.不同播种期对亚麻产量和品质的影响[J].中国麻业科学,2014,36(3):146 -150
Gao Fengyun,Zhang Hui,Jia Xiaoyun,et al.Study on Effect of Sowing Dates on Yield and Quality of Flaxseed[J].Plant fiber sciences in China,2014,36(3):146 -150
[2]Shim Y Y,Wang Y,Reaney M JT,et al.Flaxseed(Linum usitatissimum L.)bioactive compounds and peptide nomenclature:a review[J].Trends in Food Science & Technology,2014,38:5 -20
[3]Oomah B D.Flaxseed proteins- a review[J].Food Chemistry,1993,48:109 -141
[4]Hosseinian F.Antioxidant properties of flaxseed lignans using in vitro model systems[J].Journal of the American Chemists'Society,2006,83(10):835 -840
[5]Bemiller JN.Industrial gums:polysaccharides and their deribatives[M].New York:Elsevier Science,1993
[6]Zhang W B.Demucilaging and dehulling flaxseed with a wet process[J].Food Science and Technology,2009,42:1193 -1198
[7]Kitahara K,Ookita K,Kobayashi Y.Recovery of viscous substance from seeds by non-extractive process:日本,JP03179001A25[P].1991 -06 -03
[8]杨金娥,黄庆德,黄凤红,等.打磨法提取亚麻籽胶粉的工艺[J].农业工程学报,2013,29:270 -276
Yang Jin'e,Huang Qingde,Huang Fenghong,et al.Process of extracting flaxseed gum powder by abrasion[J].Ziolkovsa A.Laws of flaxseed mucilage extraction[J].Food Hydrocolloids,2012,26:197 -204
[10]黎海彬,王邕,李俊芳,等.微波辅助提取技术在天然产物提取中的应用[J].现代食品科技,2005,21(3):148 -150
Li Haibin,Wang Yong,Li Junfang,et al.Application of microwave assisted extraction technology to extraction of natural proucs[J].Modern Food Science and Technology,2005,21(3):148 -150
[11]Ganzler K,Szinai I.Effective sample preparation method for extraction biologically active compounds from different matrices by a microwave technique[J].Journal of Chromatography A,1990,520:257 -262
[12]Thirugnanasambandham K,Sivakumar V,Prakash Maran J.Microwave-assisted extraction of polysaccharides from mulberry leaves[J].International Journal of Biological Macromolecules,2015,72:1 -5
[13]陈海华,许时婴.亚麻籽胶中多糖含量的测定[J].粮油加工,2003(10):116 -117
Chen Haihua,Xu Shiying.Detection of polysaccharide in flaxseed gum[J].Machinery for cereals oil and food processing,2003,10:116 -117
[14]申玉军,杨宏志.亚麻胶制备工艺研究[D].黑龙江:黑龙江八一农垦大学,2010
Shen Yujun,Yang Hongzhi.Research on preparation technics of flaxseed gum[D].Hei Longjiang:Heilongjiang Bayi Agricultural University,2010
[15]叶垦,张铁军,张存劳.用浸提法提取亚麻籽胶的中试研究[J].中国油脂,2001,26(4):8 -10
Ye Ken,Zhang Tiejun,Zhang Cunlao.Study on extraction of linseed gum[J].Chian oils and fats,2001,26(4):8 -10
[16]Cui W,Mazza G,Oomah B D,et al.Optimization of an aqueous extraction process for flaxseed gum by response surface methodology[J].Food Science and Technology,1994,27(4):363 -369
[17]Qian K Y,Cui SW,Wu Y,et al.Flaxseed gum from flaxseed hulls:extraction,fraction,and characterization [J].Food Hydrocolloids,2012(28):275 -283
[18]Gutterman Y,Shem -tov S.Mucilaginous seed coat structure of Carrichtera Annua and Anastatica Hierochuntica from the negev desert highlands of Israel,and its adhesion to the soil crust[J].Journal of the Arid Environment,1997 (35):695-705
[19]Marianela L,Capitani Susana M,Nolasco Mabel C.Effect of mucilage extraction on the functional properties of Chia Meals[EB/OL].[2013 -01 -16].http://dx.doi.org/10.5772/53171
[20]印方平,郑先哲.微波辅助萃取南瓜中多糖及叶黄素的研究[D].哈尔滨:东北农业大学,2010
Yin Fangping,Zheng Xianzhe.Study on polysaccharides and lutein from pumpkin by microwave assisted extraction[D].Haerbin:Northeast Agricultural University,2010.
[21]Xu W T,Zhang F F,Luo Y B,et al.Antioxidant activity of a water-soluble polysaccharide purified from pteridium aquilinum[J].Carbohydrate Research,2009,344(2):217 -222.
Comparison of Microwave Assisted Extraction Methods and Hot Water Extraction on Flaxseed Gum Extraction
Li Xiaofeng1,2Zhao Qianzhu1,2Teng Yinglai1,2Liao Wenzhen1,2Li Aijun1,2Wang Yong1,2Martin J.T.Reaney1,3
(Department of Food Science and Engineering,Jinan University “Oilseed Preparation and Nutrition”Joint Laboratory of Guangdong -Saskatchewan University1,Guangzhou 510632)
(Engineering Technology Research Center for Oils and Fats Biorefinery2,Guangzhou 510632)
(Department of Plant Sciences,University of Saskatchewan3,Canada Saskatoon SK S7N 5A8)
The optimum conditions of hot water extraction and microwave assisted extraction methods on flaxseed gum extraction were optimized by single factor and orthogonal experiments,respectively.Our results found that the optimum conditions of hot water extraction method were as follows:temperature 80 ℃ for 6 h,the ratio of solid to liquid at 1∶10,extraction frequency 1;The maximum yield of flaxseed gum was 7.28%with the content of polysaccharide and protein about 68.13%and 10.21%,respectively under the above conditions.The optimum conditions of microwave assisted extraction method were as follows:temperature 80 ℃ for 1 h,the ratio of solid to liquid at 1∶10,output power 600 W,mixing speed 900 r/min,extraction frequency 1.The maximum yield of flaxseed gum was 6.46%,the content of polysaccharide and protein was about 63.13%and 13.75%,respectively.The micromorphology changes of the flaxseeds were observed by scanning electron microscopy(SEM)which indicates that the surface of flaxseeds can be destroyed by gum dissolution.In addition,the influence of flaxseeds surface structure by microwave treatment was greater than the hot water extraction.Infrared spectroscopy(IR)indicates that the C -H variable angular vibrations at 1 410 cm-1,C -H stretching vibrations at 2 930 cm-1and O -H variable angular vibrations at 1039 cm-1were constituted of the characteristic absorption of saccharide ring,which indicates the extractions were the desired flaxseed gum.
whole flaxseed,flaxseed gum,hot water extraction,microwave assisted extraction,scanning electron microscopy(SEM),infrared absorption spectroscopy(IR)
TS222+.1
A
1003-0174(2016)08-0055-07
教育部“新世纪优秀人才”支持计划(NCET-12-0675),大学生创新训练计划(20140559042),广州南沙区技术攻关项目(2014GG-05)
2014-12-08
李小凤,女,1990年出生,硕士,油料生物炼制
汪勇,男,1977年出生,研究员,油料生物炼制
