热处理对玉米象保护酶活性的影响
2016-01-03张会娜吕建华白旭光刘淑丽
张会娜 吕建华 白旭光 刘淑丽
热处理对玉米象保护酶活性的影响
张会娜 吕建华 白旭光 刘淑丽
(河南工业大学谷物资源转化与利用省级重点实验室,郑州 450052)
分别以43、47、51、55℃对玉米象(SitophiLus zeamais)成虫进行热处理,测定不同处理时间后其超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)的活性。在43、47℃的高温处理条件下,保护酶活性存在应激性升高的阶段,最大值分别达到13.49 U/mgSOD、0.39 U/mgPOD、4.20 mgH2O2/(min·mg)CAT,酶活性显著增强,随着处理时间的延长活性受到抑制。51、55℃高温处理后,CAT活性均不高于对照水平,最低值仅为对照组的70%,SOD、POD活性在55℃处理不同时间后,明显低于43、47、51℃处理后的酶活性。结果表明,玉米象成虫体内3种酶活性与高温处理温度、处理时间有一定的相关性,升高温度和延长高温处理时间能导致保护酶活性降低。
热处理 玉米象 SOD POD CAT
热处理杀虫是一种防治卫生害虫及检疫害虫的有效方法,具有致死时间短、不产生抗性、无化学残留等优点[1-2]。科学合理的热处理不会损害粮食的品质,并且对粮食的加工品质具有一定改善作用[3-4]。目前热处理已初步应用于检疫害虫和卫生害虫的防治,在防治储藏物害虫方面也有一定的研究与应用[5]。在北美,热处理已经广泛应用于食品厂、面粉加工厂的害虫除治,并得到美国环保局(EPA)、食品药品监督局(FDA)的充分认可。当前对于热处理杀虫的研究报道主要集中于处理条件、处理效果等,而对于热处理后害虫的生理生化变化研究较少[6]。
昆虫体内存在多种抗氧化酶,据报道[7-9],SOD、POD、CAT 3种酶组成保护酶系统,能保证机体自由基代谢正常,维持昆虫体内的生理活动正常进行。对昆虫进行热处理后,能引起昆虫体内的保护酶系统调控机制的应答,在一定程度上保证昆虫体内的生理活动正常进行。因此,昆虫体内保护酶活性的变化可以作为昆虫热处理条件选择的重要指标。
玉米象(S.zeamais)是全世界重要的储藏物害虫,而目前对玉米象的防治主要依靠化学防治方法。受害虫抗药性的增加、有效熏蒸剂减少等因素的影响,化学防治的效果面临严峻挑战。此外,环境保护理念的产生、绿色储粮技术的应用也对储藏物害虫的防治方法提出新的要求[10]。因此,热处理作为一种非化学防治方法,在替代化学防治方面具有较为广阔的应用前景。目前,关于储藏物害虫在热处理后,害虫机体的保护酶调控机制还鲜有报道。本研究利用实验室饲养的玉米象成虫测定在不同的热处理条件下,试虫体内的保护酶活性变化,研究试虫体内保护酶系统对高温的应答,以期为科学合理实施热处理杀虫提供借鉴。
1 材料与方法
1.1 供试昆虫
供试昆虫为河南工业大学储藏物昆虫实验室饲养的玉米象,在温度(28±1)℃、相对湿度(75±5)%的条件下以整粒小麦饲养,小麦使用前放入烘箱(60℃)中消毒2 h,调节含水量至(13±1)%,取羽化后1~2周的成虫供试。
1.2 试验处理
将玻璃瓶(直径4 cm,高9.5 cm)置于恒温水浴锅中(保证水浸没瓶身高度8 cm),将温湿度计探头置于玻璃瓶中心以测瓶内温度,待达到设定温度并稳定后快速接入20头羽化后1~2周的玉米象成虫(不分雌雄),用脱脂棉封口减少瓶内温湿度与外界的传递。高温处理条件设定为:43℃处理时间分别为165、205、245、285、325、365、405、445 min;47 ℃处理时间分别为10、20、30、40、50、60、70 和80 min;51 ℃处理时间分别为2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5 min;55 ℃ 处理时间分别为40、50、60、70、80、90、100、110 s。将试虫在不同处理温度下处理不同时间后快速取出,并在液氮中研磨制备酶液,重复3次。
1.3 酶活性测定
1.3.1 酶液的制备
参照李周直等[8]的方法并加以改进。取经过高温处理的玉米象成虫20头,用PH 7.2的Tris-HCl缓冲液(内含1%的聚乙烯吡咯烷酮和1%的EDTA)清洗干净,液氮研磨,将研磨液转入2.0 mL预冷的离心管中,用Tris-HCl缓冲液冲洗研钵后并入研磨液中,用缓冲液补充至2.0 mL,于0~4℃以11 000 r/min离心20 min,取上清液作为提取酶液,储存于4℃冰箱中。
1.3.2 蛋白质的测定
参照Bradford[11]的考马斯亮蓝G-250方法测定酶液中蛋白质含量(以mg/mL表示)。
1.3.3 酶活性测定
SOD活性的测定参考马志卿等[12]的邻苯三酚法。总反应体系为2.2 mL H2O、25μL邻苯三酚、2.25 mL PH 8.2的Tris-HCl缓冲液(含1%聚乙烯吡咯烷酮和1%的EDTA),50μL酶液,于波长为420 nm测定吸光度值,按公式计算SOD的活性。
SOD 活性(OD420/mg)= (OD1- OD2)/(OD1×0.5×蛋白质含量)
式中:OD1为邻苯三酚2 min吸光度;OD2为样品所测吸光度。1个酶活单位(U)相当于4.525 mL反应液达到50%的抑制所需的酶量,酶活性以U/mg表示。
POD活性的测定参考Simon等[13]的愈创木酚法。反应混合液为2.0 mL PH 4.0的醋酸缓冲液、50 μL酶液、1.0 mL 0.05 mol/L 愈创木酚、1.0 mL 0.3 mol/L的H2O2,加入试管立即摇匀并迅速倒入比色皿中,于470 nm波长下比色,以蒸馏水调零,以缓冲液代替酶液作对照,记录4 min后的吸光度值,酶活性以U/mg表示。
POD 活性(U/mg)=OD1/t/蛋白质含量
式中:OD1为混合液470 nm的吸光度;t为反应时间/min。
CAT活性的测定参考杨兰芳等[14]的标准曲线法。取A、B 2支试管,A为对照管,B为样品管。在A中按顺序加入1.5 mL PH 7.8 Tris-HCl缓冲溶液(内含1%的聚乙烯吡咯烷酮和1%的EDTA)、0.1 mL 酶液、1.4 mL H2O、1.0 mL 8%H2SO4。B管里依次加1.5 mL Tris-HCl缓冲溶液、0.1 mL酶液、1.1 mL H2O,0.3 mL 0.3mol/L 的H2O2,摇匀,反应3 min后加入1.0 mL 8%H2SO4终止反应。用A管调零,在波长为240 nm处测定样品管的吸光度,酶活性以每分钟每毫克蛋白质消耗H2O2毫克数计。

式中:A2为对照的吸光度;A1为样品的吸光度;t为反应时间/min;a、b为标准曲线回归方程中的常数。
1.4 数据处理与分析
数据采用Microsoft Excel 2010、SAS 9.0软件进行方差分析,采用Duncan's新复极差法进行多重比较,检验试验结果的可信度以及各处理间差异显著性。
2 结果与分析
2.1 43℃高温处理对玉米象酶活性的影响
43℃高温处理对玉米象保护酶活性的影响如表1所示。由表1可知,在整个高温处理过程中,随着高温处理时间的延长,SOD活性升高后降低,POD活性逐渐降低,CAT活性则呈现降低-升高-降低的趋势。SOD、POD活性在高温处理时间不高于245 min时变化不大,方差分析表明酶活性无显著性差异(P>0.05)。在高温处理时间为285 min时SOD活性在达到峰值,约是对照组的1.16倍,POD和CAT活性则在325 min时达到最大,但与对照组无显著性差异(P>0.05),之后随着时间的延长3种保护酶活性降低,表现为抑制作用。
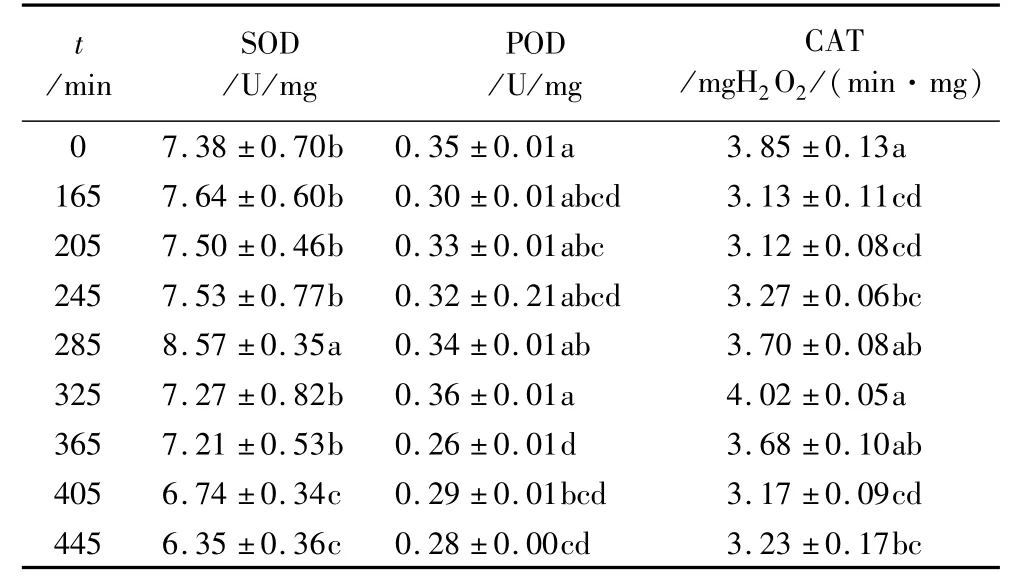
表1 43℃高温处理对玉米象体内保护酶活性的影响
2.2 47℃高温处理对玉米象酶活性的影响
由表2可以看出,在47℃高温处理条件下,随着处理时间的延长,玉米象的POD、CAT活性呈现先下降又上升再下降的趋势,SOD活性则随着处理时间延长升高后降低。SOD活性达到峰值的时间较43℃处理时短,在处理时间为20 min时即达到了13.49 U/mg,活性在短时间内得到了增强,且整个处理过程中活性都比对照组高。POD活性在高温处理时间为80 min时被明显抑制,与对照组相比差异显著(P<0.05)。CAT活性在处理时间为60 min时显著增强,活性值高出对照组0.39 mgH2O2/(min·mg),表明适当提高处理时间对CAT活性起激活作用。
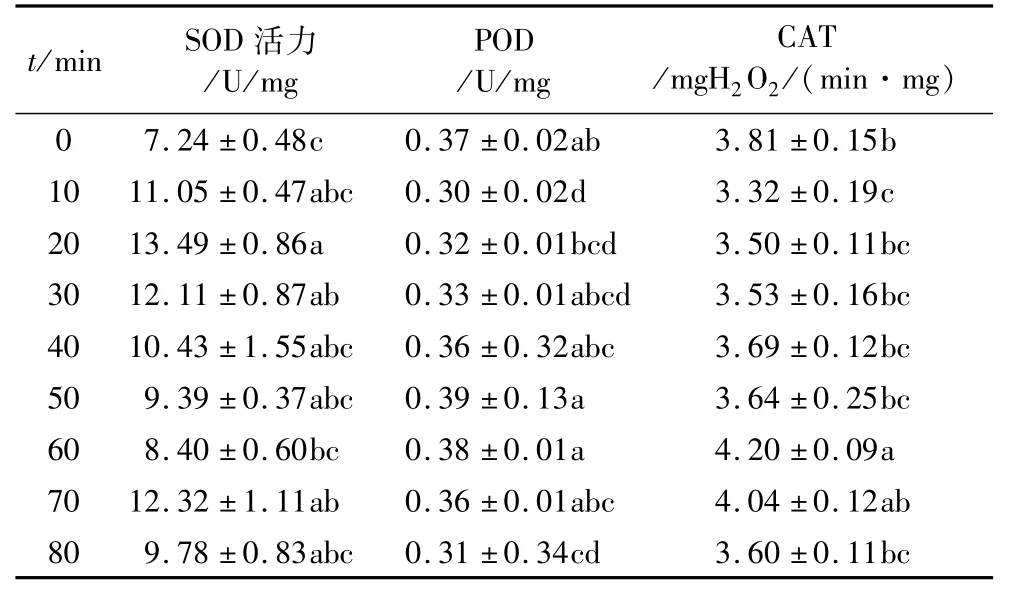
表2 47℃高温处理对玉米象体内保护酶活性的影响
2.3 51℃高温处理对玉米象酶活性的影响
玉米象经51℃高温处理后,随着高温处理时间的延长,SOD、POD活性先升高后降低,CAT活性逐渐下降。SOD在整个处理时间段活性均高于对照组,但只有处理时间为3、3.5 min时的活性与对照存在显著性差异(P<0.05)。POD活性在2.5、3 min时达到峰值,之后随着处理时间的延长活性逐渐被抑制。51℃高温短时处理对CAT活性影响较小,表现为处理时间不大于5 min时,不同处理时间之间酶活性无显著性差异(P>0.05),在高温处理时间为5.5 min时CAT活性显著下降,表现为抑制作用。
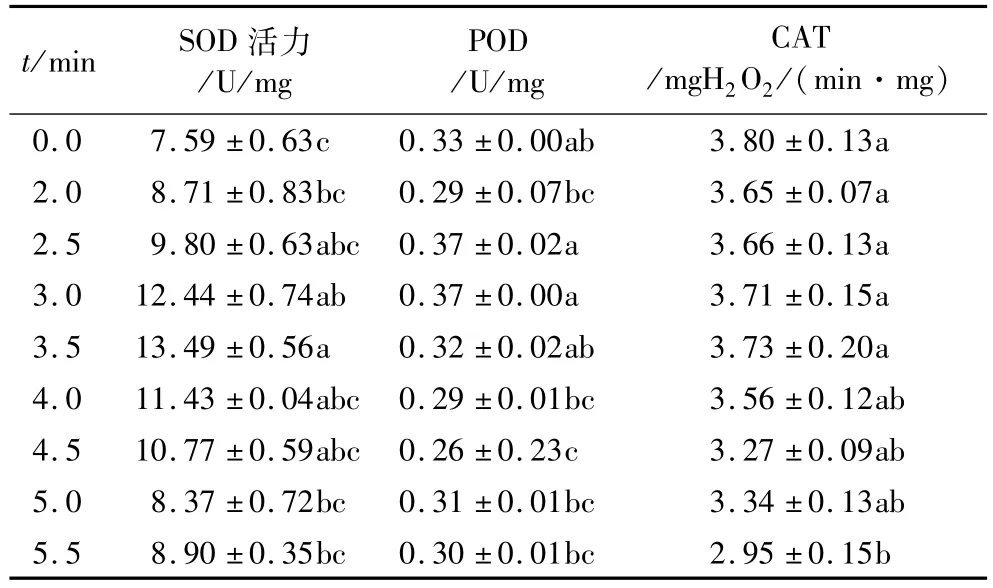
表3 51℃高温处理对玉米象体内保护酶活性
2.4 55℃高温处理对玉米象酶活性的影响
在55℃高温处理条件下,玉米象体内SOD活性随着处理时间的延长而上升,POD和CAT活性则随着处理时间的延长先下降后又上升。SOD在处理时间低于70 s时、POD和CAT在整个处理时间段内,其活性均低于对照组,表现为抑制作用。POD和CAT活性分别在处理时间为60、70 s时到达最低值,分别为0.25 U/mg 和2.64 mgH2O2/(min·mg),显著低于对照组(P<0.05)。
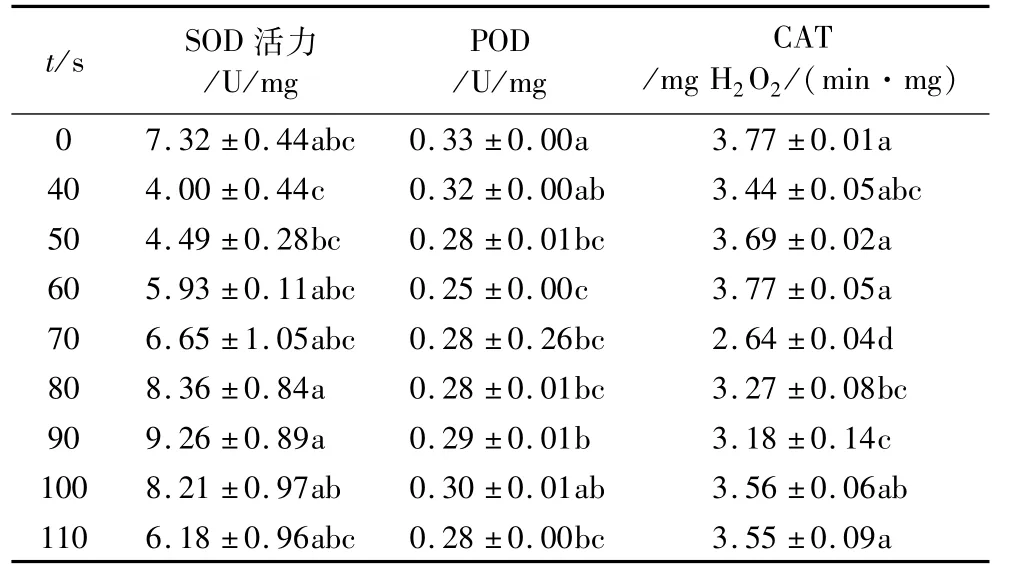
表4 55℃高温处理对玉米象体内保护酶活性
3 讨论与结论
昆虫处于逆境环境,体内活性氧增加,而SOD、POD和CAT这3种酶组成的防御系统能维持自由基代谢的稳定[15]。因此,保护酶活性的大小可以影响昆虫的耐受高温胁迫的能力。
玉米象的保护酶活性与处理的温度、时间有一定的相关性。温度是影响SOD活性的重要因素,适度升高温度能增加SOD的活性,但温度过高则产生抑制作用。55℃高温处理不同时间后,POD和CAT活性受到抑制。温度相同时,保护酶活性受处理时间的影响显著,整体上保护酶活性在高温处理的最后阶段均显著降低。由研究结果可知,提高处理温度或延长处理时间能抑制保护酶活性,55℃高温处理玉米象能使保护酶活性在短时间内降低,可作为快速致死害虫的有效温度。
昆虫体内除SOD、CAT和POD组成的保护酶系统维持的自由基代谢平衡外,还有谷胱甘肽转移酶(GSH),多功能氧化酶(MFO)等,这些自由基代谢酶系在热处理时对昆虫生理生化的调控作用,则有待进一步研究[16-18]。
[1]ISPM—2009,International standards for phytosanitary measures[S]
[2]白旭光.储藏物害虫与防治[M].第二版.北京:科学出版社,2002
Bai X G.The pests and prevention of storage[M].The second edition.Bei Jing:Science Press,2002
[3]张习军,熊善柏,赵思明.微波处理对稻谷品质的影响[J].中国农业科学,2009,42(1):224 -229
Zhang X J,Xiong SB,Zhao SM.Effect of microwave on paddy quality[J].Scientia Agricultura Sinca,2009,42(1):224 -229
[4]朱邦雄,邓树华,周剑宇,等.热处理控制稻米害虫危害的研究[J].粮食储藏,2009,38(6):10 -13
Zhu B X,Deng SH,Zhou JX,et al.Stored grain pests control by heat treatment[J].Grain Storage,2009,38(6):10 -13
[5]Tang J.Heat treatments for postharvest pest control:theory and practice[M].2007
[6]Du Y,Ma C,hao Q,et al.Effects of heat stress on physiological and biochemical mechanisms of insects:a literature review[J].Acta Ecologica Sinica,2007,27(4):1565 -1572
[7]Fridovich I.Oxygen is toxic[J].Bioscience,1977,27(7):462-466
[8]李周直,沈惠娟,蒋巧根,等.几种昆虫体内保护酶系统活力的研究[J].昆虫学报,1994,37(4):399 -403
Li Z Z,Shen H J,Jiang QG,et al.A study on the activities of endogenous enzymes of protective system in some insects[J].Acta Entomologica Sinica,1994,37(4):399 -403
[9]杜尧,马春森,赵清华,等.高温对昆虫影响的生理生化作用机理研究进展[J].生态学报,2007,27(4):1565 -1571
Du Y,Ma CS,Zhao Q H,et al.Effects of heat stress on physiological and biochemical mechanisms of insects:a literature review[J].Acta Ecologica sinica,2007,27(4):1565 -1571
[10]程小丽,武传欣,刘俊明,等.储粮害虫防治研究进展[J].粮油仓储科技通讯,2010(6):26 -29
Cheng X L,Wu C X,Liu J M,et al.Study of different ways to prevent insect pests of stored grain[J].Liangyou Cangchu Keji Tongxun,2010(6):26 -29
[11]Bradford M M.A rapid sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal.Biochem,1976(72):255 -260
[12]马志卿,颜瑞莉,陈根强,等.松油烯-4-醇对粘虫体内保护酶活力的影响[J].西北农林科技大学学报(自然科学版),2004,32(10):85 -88
Ma Z Q,Yan R L,Chen G Q,et al.Effect of terpinen -4 -ol on the activities of endogenous enzymes of protectives system in armyworm(Mythimna Separate Walker)[J].Jour.of Northwest Sci- Tech Univ.of Agri and For.(Nat.Sci.Ed.),2004,32(10):85 -88
[13]Simon L,Fatrai Z,Jonas D,et al.Study of peroxide metabolism enzymes during the development of Phaseolus vulgaris[J].Biochem Physiol Pflanz BPP,1974:387 -392
[14]杨兰芳,庞静,彭小兰,等.紫外分光光度法测定植物过氧化氢酶活性[J].现代农业科技,2009(20):364-366
Yang L F,Pang J,Peng X L,et al.Measurement of catalase activity in plants by ultraviolet spectrophotometry[J].Modern agricultural science and technology,2009,20:364 -366
[15]刘缠民,马捷琼.温度对大黑蚁存活率及其保护酶系影响的相关分析[J].四川动物,2007,25(4):796 -797
Liu C M,Ma J Q.Correlation analysis between survival rate and protection enzymes ofpolyrhachis vicina under different temperatures[J].Sichuan Journal of Zoology,2007,25(4):796-797
[16]冯纪年,田宏刚,郭付振,等.昆虫细胞色素P450研究进展[J].当代昆虫学研究——中国昆虫学会成立60周年纪念大会暨学术讨论会论文集,2004:200-206
Feng J N,Tian H G,Guo F Z,et al.Review on cytochrome P450 of insect[J].Contemporary entomological research -the Vol.in 60thanniversary of Chinese society of insect and academic seminar,2004:200 -206
[17]张永国,亢晋勇.谷胱甘肽硫转移酶的生理功能述评[J].忻州师范学院学报,2006(22):125 -128
Zhang Y G,Kang JY.A review of physiological roles of Glutathione S - Transferases[J].Journal of Xizhou Teachers U-niversity,2006,22:125 -128
[18]豆威,王进军.昆虫谷胱甘肽S-转移酶研究进展[J].农业生物灾害预防与控制研究,2005:426-431
Dou W,Wang JJ.Review on insect GlutathioneS-Transferases[J].Prevention and Control of Agricultural Biological,2005:426 -431.
Effect of Heat Treatment on the Activities of Protective Enzymes in Sitophilus Zeamais
Zhang Huina Lü Jianhua Bai Xuguang Liu Shuli
(School of Food Science and Technology,Henan University of Technology,Zhengzhou 450052)
The adults of Sitophilus zeamais were treated for a series of times in laboratory under 43,47,51 ℃and 55 ℃ respectively.The activities of superoxide dismutase(SOD),peroxidase(POD)and catalase(CAT)in S.zeamais adults were determined after heat treatment.Irritability increase stage was observed in activities of protective enzymes when high temperature treatment under 43,47 ℃,with the maximum value being 13.49 U/mg(SOD),0.39 U/mg(POD),4.20 mg H2O2/(min·mg)(CAT)respectively.The activities of enzymes were enhanced significantly and then restricted with the extension of time.The activity of CAT was lower than the control after high temperature under 51,55 ℃,the lowest was only 70%of that in the control.The activities of SOD and POD were lower than that in 43,47,51 ℃ after high temperature under 51,55 ℃.Analysis showed that the activities of three protective enzymes of S.zeamais adults had a certain relationship with the treatment temperatures and treatment times.Improving temperature and prolonging heat treatment time could result in lower activity of protective enzyme.
heat treatment,Sitophilus zeamais,SOD,POD,CAT
TQ646
A
1003-0174(2016)08-0090-05
863计划(2012AA101705-2),河南省基础与前沿技术研究(152300410078),谷物资源转化与利用省级重点实验室开放课题(001255)
2014-12-11
张会娜,女,1989年出生,硕士,储粮害虫综合治理与安全储粮技术
吕建华,男,1971年出生,副教授,储粮害虫综合治理与安全储粮技术
