基于高通量测序的思茅松微卫星位点的特征分析
2016-01-02邓丽丽李德龙蔡年辉唐红燕王大玮许玉兰
邓丽丽,李德龙 ,蔡年辉 ,周 军 ,孙 琪 ,唐红燕 ,王大玮 ,许玉兰
(1. 西南林业大学 云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650224;2. 普洱市林业科学研究所,云南 普洱 665099)
基于高通量测序的思茅松微卫星位点的特征分析
邓丽丽1,李德龙1,蔡年辉1,周 军1,孙 琪1,唐红燕2,王大玮1,许玉兰1
(1. 西南林业大学 云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650224;2. 普洱市林业科学研究所,云南 普洱 665099)
以思茅松针叶为材料,采用Illumina Hiseq2000平台测序,得到121 882条无冗余的序列,对这些序列进行SSR位点搜索,共获得3534个SSR位点,出现频率为2.9%,分布平均距离25kb。所搜索的SSR以单核苷酸重复类型最多,其次为三核苷酸和二核苷酸,而四、五、六核苷酸重复类型较少(<1%)。单核苷酸重复类型中以A/T基元较丰富(43.58%);二核苷酸中出现频率最高的是AT/TA基元(14.04%),AG/CT次之,AC/GT和CG/CG较低;三核苷酸重复类型中AAG/CTT最多,AGC/CTG和AGG/CCT次之,以CCG/CGG、ACG/CGT和ACT/AGT较少(<1%);四、五、六核苷酸类型中各重复基元相差不大,均较少。SSR数量随对应的重复类型重复次数的增加而降低,也随重复区段碱基长度的增加而降低。
思茅松;高通量测序;微卫星
思茅松Pinus kesiyavar.langbianensis(A. Chev.)Gaussen是卡西亚松P.kesiyaKoyle ex Gordon的一个地理变种[1],在我国分布于云南省亚热带、准热带地区,是主要用材树种[2]。自20世纪80年代以来对思茅松的遗传改良做了许多工作,取得了阶段性的成果和成熟的经验[3]。目前,有关思茅松苗木培育[4]、森林资源管理[5]、遗传变异[6]等方面开展多方位的研究,而从分子水平开展研究不多,集中在实验方法的建立[7-9],利用分子标记对种质资源的评价研究更为鲜见,仅有少数利用同工酶及RAPD开展天然种群及种子园遗传多样性的研究[10-11],迄今为止对思茅松的遗传多样性和遗传结构的了解仍十分欠缺,缺乏系统的遗传学、群体遗传学等基础研究工作,仅局限于部分地区的有限群体或种子园,而且所选用的检测手段以表型或显性标记为主,信息含量较少。因此,从DNA水平上深入研究思茅松群体遗传结构与分化就显得更为重要,可为该种质资源的保护与利用提供科学指导。
微卫星是一种共显性的分子标记,因其多态性丰富、重复性高、覆盖面广、易于检测、稳定性好等优点,广泛应用于遗传多样性分析、亲缘关系分析、品种鉴定和辅助选择育种等方面[12-19]。尽管微卫星在许多在很多领域中得到广泛应用,但存在微卫星的分离问题[20]。传统的方法是先构建文库,再采用探针对所建立的文库进行筛选[21],该方法耗时、耗力,且效率低,后来研究者相继提出一些改进的方法,如选择性杂交、磁珠富集等,这些方法很快就取代传统的耗时耗力的建库扫描的方法[20]。近年来随着高通量测序技术的发展,EST序列开发SSR分子标记也越来越多,是一个比较有效的途径[22-24],与基因组SSR相比,EST-SSR具有通用性好、开发简便等特点,且来源于基因编码序列,获得基因表达信息,可开展功能基因的直接鉴定[25],这方面的研究也越来越受到人们的关注。但是,目前关于思茅松基于EST序列的SSR研究未见报道。鉴于此,本研究基于Illumina Hiseq 2000平台对思茅松转录组测序,搜索并分析SSR位点信息与分布特征,为思茅松微卫星分子标记的开发提供信息,以丰富思茅松分子标记信息,为分子水平上深入研究思茅松遗传变异奠定基础,同时也可为近缘种特种SSR标记开发及其遗传分析提供便利。
1 材料与方法
1.1 研究材料
采集思茅松植株当年生幼嫩针叶,干冰保存,核酸提取、测序(Illumina Hiseq2000)与组装(Trinity软件)由北京华诺时代科技有限公司完成。
1.2 SSR位点的搜索与统计
使 用 Micro Satellite(MISA,http://pgrc.ipkgatersleben. de/misa/)搜索转录组序列中潜在的1~6 bp的SSR,搜索标准为:单核苷酸至少重复10次、二至四核苷酸至少重复5次、五核苷酸和六核苷酸至少重复4次。采用Excel软件统计SSR的数量、出现频率、分布距离与密度、重复类型、基元组成、重复区段长度变化等,分析思茅松转录组SSR的分布特征。
2 结果与分析
2.1 思茅松转录组微卫星序列的分布丰度与距离
组装获得的思茅松转录组共121 882条无冗余的转录本序列,按标准搜索1~6 bp的SSR,共搜索到3 534个SSR位点,其中复合型SSR的数量为96个,分布于3205条序列上,发生频率(含SSR序列数/总序列数)为2.63%,其中2 924条序列含有单个SSR,281条序列含有2个或2个以上的SSR,总的SSR序列出现频率(检出的SSR个数/总序列数)为2.90%,平均距离为25.12 kb,即每25.12 kb出现1个SSR位点(表1)。

表1 思茅松转录组SSR位点的分布Table 1 The distribution of SSR repeat types in Piuns kesiya var. langbianensis transcriptome
在所搜索到的SSR中单核苷酸重复类型所占比例较高(44.74%),三核苷酸重复类型占总数的29.68%,二核苷酸重复类型占总数的23.80%,而四、五、六核苷酸重复单元所占比例均较低,分别为0.03%、0.01%和0.01%;若不考虑单核苷酸的情况下,二、三核苷酸占总数的96.77%。相应地各重复单元类型的出现频率、分布密度与SSR含量的变化规律相同,表现为:单核苷酸>三核苷酸>二核苷酸>四核苷酸>五核苷酸>六核苷酸;不同重复类型核苷酸的平均距离各不相同,其顺序依次为:单核苷酸<三核苷酸<二核苷酸<四核苷酸<五核苷酸<六核苷酸,其中单核苷酸与六核苷酸重复类型的分布距离差异达113倍,即该转录组序列中每出现113个单核苷酸重复类型才出现一个六核苷酸重复类型的SSR。由表也可以看出,不同重复类型SSR位点的出现频率或数量越高,其平均距离越小,分布密度越大。
2.2 思茅松转录组微卫星序列的重复基元类型和比例
思茅松转录组微卫星序列各重复基元统计如表2所示。
不同核苷酸重复类型的重复基元所占的比例差异较大,单核苷酸重复类型中以A/T基元居多,占43.58%,而C/G较少,仅占总数的1.16%;二核苷酸重复类型中各基元所占比例依次为:AT/AT(14.04%)>AG/CT(8.09%)>AC/GT(1.61%)>CG/CG(0.06%);三核苷酸重复类型中AAG/CTT较多(6.28%),其次是AGC/CTG(5.69%)和AGG/CCT(4.73%),而以ACT/AGT、ACG/CGT和CCG/CGG较低(<1%);四核苷酸重复类型中共搜索到20种重复基元,各重复基元的比例较低,最高的仅为0.14%;五、六核苷酸中出现的基元种类少、比例低。四、五、六核苷酸中各重复基元出现的频率均比较低,因此表2中未列出具体的基元类型。

表2 思茅松转录组SSR各重复基元及其比例Table 2 The relative percentage of SSR repeat motif in Piuns kesiya var. langbianensis transcriptome
2.3 思茅松转录组微卫星序列重复次数
重复基元的重复次数变异引起重复片段序列长度的变异,思茅松转录组微卫星序列各重复类型的SSR重复次数如图1所示。
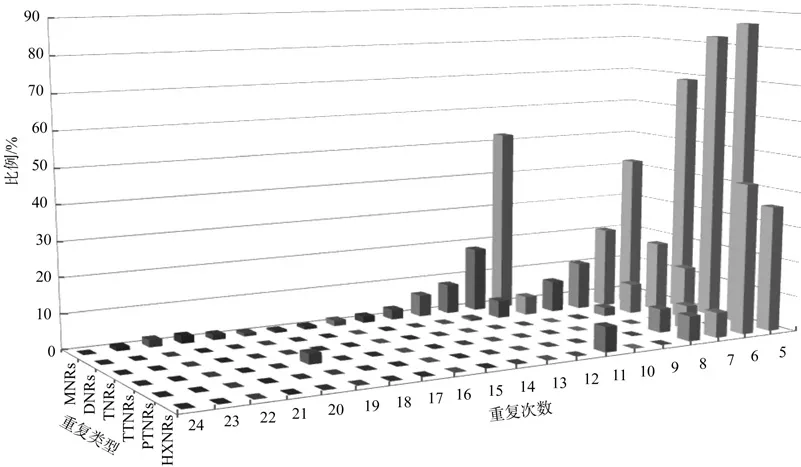
图1 思茅松转录组各微卫星重复类型重复次数分布频率Fig.1 Frequency of SSR repeat types for the various number of repeats in Piuns kesiya var. langbianensis transcriptome
由图1可知,各重复类型的重复次数差异较大,波动于5~24次,总体表现为重复次数随重复单元中核苷酸数量的增加而减少,其中单核苷酸重复10~23次,二核苷酸重复6~13次、其余核苷酸重复5~9次,不同核苷酸重复类型主导的重复次数也不相同。由图也可以看出,SSR出现的频率随重复次数的增加而降低;与此同时,随着SSR重复类型碱基数的增加,重复次数减少。总体来看(见图2),SSR的重复次数以5~10次占多数,占77.31%,11~15次的占18.08%,而重复次数在15次以上的不足5%,表现为随着重复次数的增加,SSR数量呈降低的趋势。
2.4 思茅松转录组微卫星序列长度分布
思茅松转录组SSR重复片段的长度波动于10~76 bp,其中以10~24 bp居多(见图3)。由图3和表1可知,单核苷酸重复类型的长度和二核苷酸重复类型的长度均变化于10~24 bp,平均长度分别为11.75 bp和14.53 bp;三核苷酸重复类型变化于15~27 bp,平均长度为16.35 bp;四核苷酸重复类型长度20~24 bp,另有一个重复较高的,重复19次(76 bp),平均长度为22.24 bp;五核苷酸重复类型长度25~40 bp,平均26.67 bp;六核苷酸30~66 bp,平均37.29 bp。综合来看,各重复区段碱基片段长度变化表现为随着重复类型碱基数的增加,片段的平均长度也随之增加,即从单核苷酸至六核核苷酸,片段的平均长度呈递增的趋势(表1)。从图3也可以看出,除六核苷酸外,其余核苷酸的重复类型表现为SSR出现的频率随重复区段碱基片段长度的增加而降低,微卫星重复区段片段长度与其对应的SSR数量或比例成相反的变化趋势,即重复区段碱基片段短的,其SSR数目较多。从全部核苷酸来看,90%以上的重复区段片段长度为10~20 bp,而大于30 bp的SSR不足1%。

图2 思茅松转录组微卫星重复次数分布频率Fig.2 Frequency of repeat number of SSR in Piuns kesiya var. langbianensis transcriptome

图3 思茅松转录组各SSR重复类型片段长度分布频率Fig.3 Frequency of SSR repeat types for the various sequence length in Piuns kesiya var. langbianensis transcriptome
3 结论与讨论
思茅松转录组中SSR的发生频率为2.63%,平均分布距离为25.12 kb,39个SSR/Mb,与云南松Pinus yunnanensis转录组中SSR的分布及发生频率较为接近[26],而与杨树Populus(14.83%)、桉树Eucalyptus(14.99%)的发生频率相比较低[27-28],这种差异大小可能与SSR搜索标准、数据库大小以及物种有关[29],也可能与含有微卫星的基因的表达丰度有关[27]。思茅松转录组序列所检测的SSR中,单核苷酸重复类型所占比例接近一半,另一半主要是由三核苷酸重复类型和二核苷酸重复类型组成,这在红松Pinus koraiensis转录组的研究中也提到,单核苷酸重复类型占总的46.90%[30],杨树转录组检测到的核苷酸也表现出相同的规律,即单核苷酸>三核苷酸>二核苷酸[31],但在云南松转录组中以三核苷酸较多[26],这种占优势的重复类型在不同植物中有所差异,许玉兰等[32]对多物种的统计可知以二、三核苷酸较为集中。若不考虑单核苷酸的情况下,在2~6 bp的SSR中,思茅松也以2~3 bp重复类型为主,这在地中海松Pinus halepensis、马尾松Pinus massoniana和火炬松Pinus taeda等研究中也有类似的报道[22,33-35]。不同重复类型的SSR多态水平存在一定的差异[36],在研究报道中,扩增出多态性位点的引物重复单元以二、三核苷酸重复为主[30,37-38],李淑娴等[27]在桉树研究中也发现微卫星长度的变异速率与其长度之间存在一定的关系,表现为低级基元SSR理论多态性较高[39]。因此,思茅松转录组含有较多低级基元单、二、三核苷酸,多态性SSR分子标记的开发具有很大的潜力。
不同重复类型中各重复基元所在比例存在差异,在单核苷酸重复类型中,以A/T占绝多数,二核苷酸重复类型中,AT/TA占多数,表现出AT优势。这种现象在云南松[26]、红松[30]、火炬松和马尾松[33]中均有研究报道。AT含量较多可能与其能量有关,因为A-T间为两氢键,C-G间为三氢键,打破AT所需的能量低于CG[40]。但是,在三核苷酸重复类型中以AAG/CTT、AGC/CTG和AGG/CCT较多,分别为6.28%、5.69%和4.73%,与其它的松树报道的比较相似,如红松中以AGC/CTG、AGG/CCT和AAG/CTT三种较多,分别占总数的7.63%、6.66%和6.55%[30];云南松中也以AGC/CTG、AAG/CTT和AGG/CCT[26]。在前期对多树种的统计中也可看出以AAG、AGC和AGG较多,而在如柽柳Tamarixspp.、橡胶树Hevea brasiliensis、白桦Betula platyphylla等中还出现少量其它优势基元,如AAT、AGA、TCA等[32],表明不同植物SSR基元组成存在一定的差异,但一些优势基元如AAG、AGC和AGG在多种植物中均存在。因此,推测这些重复基元可能在EST序列中的存在较为普遍,可能是优势的蛋白和DNA家族[36]。CG重复单元可能与某些特定的功能相关[41],在思茅松转录组中发现一定数量的CG,如二核苷酸CG,三核苷酸ACG、AGC等,这些重复类型是否能加其它的生命活动需要进一步的研究。但是CG的含量很少,有研究认为CG重复类型少是因为基因组DNA中的CpG甲基化,极易发生突变,较少的GC是维持热力学稳定必须的因素[42],这些将为思茅松SSR引物的开发提供启示。
微卫星位点多态性主要原因是基元重复数和碱基数不同而形成的序列长度多态性[43],微卫星核心序列重复次数与该位点等位基因数存在较强的正相关,一般重复次数多,其变异性越大,该位点的等位基因数越多[41],思茅松转录组SSR丰度随各对应重复类型碱基数的增加而减少,这在其它的研究中也有类似的报道,如唐古特红景天Rhodiola algida中核苷酸类型表现为长度变化与其对应的重复类型的碱基长度成反比,同种重复类型中,微卫星的长度与对应的SSR数成反比[41]。云南松中也出现随着重复次数的增加、重复片段的增长,SSR出现的数量降低[26]。由此表明,这种重复类型特征不是思茅松所特有。一般来说,重复区段碱基片段长度随着重复次数的不同而发生变化,而SSR长度变异是产生SSR多态性的主要原因[39],不同长度微卫星的分布及变化的分析有利于多态性高的SSR标记的获得[41]。从思茅松转录组SSR分析来看,重复次数为5~24次,其中单核苷酸因容易发生错配排除外[43],其余的核苷酸重复类型重复次数也有5~13次,甚至有高达19次的。从片段长度来看,90%的长度≤20 bp,按照Temnykh等[39]的提出SSR长度≤20 bp时多态性高,当>20 bp时,仍以低级基元类型为主(72.94%),这部分SSR可能也具有较多的多态性潜能。由此推测,思茅松转录组挖掘的3 534个SSR位点大部分具有多态性潜能,可用于分子标记的开发。当然,本研究仅针对SSR位点分布特征进行分析,对于引物的开发以及功能标记的研究还需入进一步深入。
4 小 结
思茅松转录组SSR出现频率较高,类型丰富,且分布密度也较大。在搜索到的3 534个SSR位点中,以单核苷酸占多数,其次为三、二核苷酸重复类型,而四、五、六核苷酸重复类型的SSR数量较少。单核苷酸和二核苷酸重复类型中,以A/T、AT/TA基元出现的比例较高,CG含量相对较低。SSR位点出现的频率越高,其平均距离越小;各重复单元片段长度变随着重复单元碱基数的增加而增加;SSR出现的频率随对应重复类型重复区段碱基片段长度的增加而降低;同样地,随着重复次数的增加,SSR数量呈降低的趋势。结合其它研究,评价思茅松转录组所挖掘的3 534个SSR位点具有较高多态性潜能,可用于分子标记的开发。
[1]中国科学院昆明植物研究所. 云南植物志: 第四卷[M]. 北京:科学出版社, 1986.
[2]中国树木志编委会. 中国主要树种造林技术[M]. 北京: 中国林业出版社, 1981.
[3]许玉兰, 段安安. 思茅松遗传改良研究现状及育种策略的探讨[J]. 西南林学院学报, 2004, 24(4): 68-72.
[4]徐玉梅, 杨德军, 史富强, 等. 思茅松人工林不同空间配置模式下不同密度生长试验与分析[J]. 南京林业大学学报: 自然科学版, 2015, 39(1): 162-166.
[5]欧光龙, 胥 辉, 王俊峰, 等. 思茅松天然林林分生物量混合效应模型构建[J]. 北京林业大学学报, 2015, 37(3): 101-111.
[6]李帅锋, 苏建荣, 刘万德, 等. 思茅松天然群体种实表型变异[J]. 植物生态学报, 2013, 37(11): 998-1009.
[7]王曙光, 杨文武, 普晓兰. 思茅松大配子体DNA的提取及ISSR反应体系的建立[J]. 四川林业科技, 2012, 33(2): 90-95.
[8]姚鹏强, 李 培, 王曙光, 等. 思茅松AFLP分子标记体系的建立[J]. 西南林业大学学报, 2013, 32(6): 30-33.
[9]魏 博, 汪元超, 王大玮, 等. 思茅松SRAP-PCR反应体系的建立与优化[J]. 江苏农业科学, 2014, 42(3): 27-30.
[10]陈少瑜, 赵文书, 王 炯. 思茅松天然种群及其种子园的遗传多样性[J]. 福建林业科技, 2002, 29(3): 1-5.
[11]朱云凤, 陈少瑜, 郝佳波, 等. 思茅松种子园遗传多样性的RAPD分析[J]. 西部林业科学, 2015, 43(2): 141-146.
[12]陈赢男, 张新叶, 戴晓港. 利用微卫星标记鉴别油茶品种[J].经济林研究, 2014, 32(4): 140-143.
[13]Sanchez M, Ingrouille M J, Cowan R S,et al. Spatial structure and genetic diversity of natural populations of the Caribbean pine,Pinus caribaeavar.bahamensis(Pinaceae), in the Bahaman archipelago[J]. Botanical Journal of the Linnean Society, 2014,17(3): 359-383.
[14]管俊娇, 张建华, 张 惠, 等. 辣椒杂交种纯度鉴定的SSR核心引物筛选[J]. 生物技术通报, 2014, 30(9): 97-101.
[15]魏琦琦, 林 青, 贾宝光, 等. 枣转录组序列的微卫星特征分析[J]. 中南林业科技大学学报, 2015, 35(6): 93-97.
[16]黄少勇, 张智俊, 罗淑萍, 等. 山核桃EST-SSR引物的筛选及通用性分析[J]. 经济林研究, 2013, 31(3): 10-15.
[17]卢代华, 王 剑, 伏荣桃, 等. 水稻对稻曲病不同抗性品种遗传多样性SSR分析[J]. 西南农业学报, 2015, 28(2): 457-464.
[18]闫丽君, 王红霞, 黄芳芳, 等. 伯乐树SSR-PCR反应体系的优化[J]. 中南林业科技大学学报, 2014, 34(12): 83-86.
[19]Mason A S. SSR Genotyping[J]. Methods in Molecular Biology,2015, 1245: 77-89.
[20]Zane L, Bargelloni L, Patarnello T. Strategies for microsatellite isolation: a review[J]. Molecular Ecology, 2002, 11(1):1-16.
[21]Rassmann K, Schlotterer C, Tautz D. Isolation of simple sequence loci for use in polymerase chain reaction-based DNA fingerprinting[J]. Electrophoresis, 1991, 12(2-3): 113-118.
[22]杨维泽, 许宗亮, 杨绍兵, 等. 三种植物EST-SSR引物在滇重楼上的通用性分析[J]. 西南农业学报, 2014, 27(4): 1686-1690.
[23]Pinosio S, González-Martínez S C, Bagnoli F,et al. First insights into the transcriptome and development of new genomic tools of a widespread circum-Mediterranean tree species,Pinus halepensisMill[J]. Molecular Ecology Resources, 2014, 14(4):846-856.
[24]Liu J J, Hammett C. Development of novel polymorphic microsatellite markers by technology of next generation sequencing in western white pine[J]. Conservation Genetic Resource, 2014, 6(3): 647-648.
[25]Ellis J R, Burke J M. EST-SSRs as a resource for population genetic analyses[J]. Heredity, 2007, 99(2): 125-132.
[26]蔡年辉, 许玉兰, 徐 杨, 等. 云南松转录组SSR的分布及其序列特征[J]. 云南大学学报: 自然科学版,2015,37(5):770-778.
[27]李淑娴, 张新叶, 王英亚, 等. 桉树EST序列中微卫星含量及相关特征[J]. 植物学报, 2010, 45(3): 363-371.
[28]张新叶, 宋丛文, 张亚东, 等. 杨树EST-SSR标记的开发[J].林业科学, 2009, 45(9): 53-59.
[29]Nicot N, Chiquet V, Gandon B,et al.Study of simple sequence repeat (SSR) markers from wheat expressed sequence tags(ESTs)[J]. Theoretical & Applied Genetics, 2004, 109(4): 800-805.
[30]张 振, 张含国, 莫 迟, 等. 红松转录组SSR分析及ESTSSR标记开发[J]. 林业科学, 2015, 51(8): 114-120.
[31]雷淑芸, 张发起, Khan G, 等. 利用高通量测序分析青藏高原地区青杨的SSR和SNP特征[J]. 林业科学研究, 2015, 28(1):37-43.
[32]许玉兰, 蔡年辉, 康向阳, 等. EST-SSR标记的开发及其在木本植物中的分布特点[J]. 中国农学通报, 2012, 28(4): 1-7.
[33]Bai TD, Xu L, Xu M,et al. Characterization of masson pinePinus massonianaLamb. microsatellite DNA by 454 genome shotgun sequencing[J]. Tree Genetics & Genomes, 2014, 10(2):429-437.
[34]Pinosio S, González-Martínez SC, Bagnoli F,et al.First insights into the transcriptome and development of new genomic tools of a widespread circum-Mediterranean tree species,Pinus halepensisMill[J]. Molecular Ecology Resources, 2014, 14(4):846-856.
[35]Bérubé Y, Zhuang J, Rungis D,et al. Characterization of ESTSSRs in loblolly pine and spruce[J]. Tree Genetics & Genomes,2007, 3(3): 251-259.
[36]张得芳, 李淑娴, 夏 涛. 蔷薇科6个属植物EST-SSR特征分析[J]. 植物研究, 2014, 34(6): 810-815.
[37]Pan F, Shihui N, Huwei Y,et al. Development and Characterization of 25 EST-SSR markers inPinus sylvestrisvar.mongolica(Pinaceae)[J]. Applications in Plant Sciences, 2014,2(1): 1300057.
[38]Xiang X, Zhang Z, Wang Z,et al.Transcriptome sequencing and development of EST-SSR markers inPinus dabeshanensis, an endangered conifer endemic to China[J]. Molecular Breeding,2015, 35(8): 1-10.
[39]Temnykh S, Declerck G, Lukashova A,et al. Computational and experimental analysis of microsatellites in rice (Oryza sativaL.):Frequency, length variation, transposon associations, and genetic marker potential[J]. Genome Research, 2001, 11(8): 1441-1452.
[40]童治军, 肖炳光. 3种烟草基因组SSR位点信息分析和标记开发[J]. 西北植物学报, 2014, 34(8): 1549-1558.
[41]雷淑芸, 高庆波, 付鹏程, 等. 基于Solexa高通量测序的唐古特红景天Rhodiola algida微卫星信息分析[J]. 植物研究,2014, 34(6): 829-834.
[42]Schorderet D F, Gartler S M. Analysis of CpG suppression in methylated and nonmethylated species[J]. Proceedings of the National Academy of Sciences, 1992, 89(3): 957-961.
[43]王 森, 张 震, 姜倪皓, 等. 半夏转录组中的SSR位点信息分析[J]. 中药材, 2014, 37(9): 1566-1569.
Characteristic analysis of microsatellite inPinus kesiyavar.langbianensisby using high-throughput sequencing
DENG Li-li1, LI De-long1, CAI Nian-hui1, ZHOU Jun1, SUN Qi1, TANG Hong-yan2, WANG Da-wei1, XU Yu-lan1
(1. Key Laboratory for Forest Genetic and Tree Improvement & Propagation in Universities of Yunnan Province, Southwest Forestry University, Kunming 650224, Yunnan, China;2. Puer City Institute of Forestry Sciences, Puer 665099, Yunnan, China)
Needle sample ofPinus kesiyavar.langbianensiswas sequenced with high-throughput sequencing technology (Illumina Hiseq 2000). In total 121 882 transcripts ofPinus kesiyavar.langbianensis.were screened using MISA software. 3534 SSRs were identi fied, and the frequency of SSR was 2.9% and mean distribution density was 25 kb. The mono-nucleotide repeats were the highest,followed by tri-nucleotide and di-nucleotide repeat types. The tetra-nucleotide, petra-nucleotide and hexa-nucleotide were all less than 1%.Among the mononucleotide repeats, the A/T repeats motifs were the highest frequency (43.58%). AT/AT was the most frequent repeat motifs in di-nucleotide repeats (14.04%), followed by AG/CT. AC/GT and CG/CG were minimum. AAG/CTT repeats motifs was the highest in tri-nucleotide followed by AGC/CTG and AGG/CCT, while CCG/CGG, ACG/CGT and ACT/AGT were lowest (<1%). The repeat motifs were very few in tetra-nucleotide, petra-nucleotide and hexa-nucleotide and had no obvious differences. The SSR number of decreased with the increased number of repeats and length of repeats.
Pinus kesiyavar.langbianensis; high-throughput sequencing; microsatellite
S791.259
A
1673-923X(2016)10-0072-06
10.14067/j.cnki.1673-923x.2016.10.013
2016-01-19
西南林业大学科技创新基金(15092);国家自然科学基金项目(31500536);西南林业大学科研启动基金项目(01102-111436)
邓丽丽,硕士研究生
许玉兰,副教授,博士;E-mail:xvyulan@163.com
邓丽丽,李德龙,蔡年辉,等. 基于高通量测序的思茅松微卫星位点的特征分析[J].中南林业科技大学学报,2016, 36(10):72-77, 93.
[本文编校:吴 彬]
