液相色谱-串联质谱法测定卷烟中的黄曲霉素
2015-12-31陈伟华
陈伟华
(河北中烟工业有限责任公司,河北 石家庄 050051)
黄曲霉素(aflatoxin,AFT)是一类由黄曲霉和寄生曲霉产生的真菌毒素,为二氢呋喃香豆素的衍生物,目前发现的黄曲霉素主要有B1、B2、G1、G2、M1、M2等几种。其中,B1的毒性最强[1],M1、M2主要存在于牛奶中[2-3]。人体摄入黄曲霉素后,通过破坏肝脏组织引起急、慢性中毒,长期摄入会诱发癌症。近年来,AFB1污染事件的发生已引起世界各国对食品安全的关注[4-6]。美国、欧盟等国家对食品中黄曲霉素的含量进行了严格限制,我国也已颁布食品和乳制品中黄曲霉素的检测标准,并对其含量作了严格规定。
卷烟是一种以吸食为主要目的的快速消费品,其质量卫生安全日益受到人们的重视。一直以来,不法分子为牟取暴利,以低等级和霉变烟叶作为原料,通过硫磺熏蒸[7]或使用其他非法添加物等手段,改善烟叶外观,以假乱真,蒙蔽消费者,严重损害了国家和消费者的利益。另外,因储存不当,易致烟叶或卷烟发生霉变[8-10]。卷烟霉变后,不但燃烧性和吸味质量显著下降,而且对人体会造成潜在危害。目前,黄曲霉素的测定方法主要有薄层层析法(thin layer chromatography)[11]、免疫亲和柱净化液相色谱 法 (immune affinity column cleanse,HPLC)[12-13]、酶 联 免 疫 法 (enzyme-linked immune sorbent assay)[14-15]、高 效 液 相 色 谱-串 联 质 谱 法(high performance liquid chromatography-tandem mass spectrometry)[16]等,这些方法要么前处理繁琐,要么不易单一定量或出现假阳性。HPLC法具有快速准确、灵敏度高、检出限低等优点,近年来得到快速发展和广泛应用,配合质谱联用技术,可实现对大部分化合物的分离和准确定量。目前,国外对烟草及其制品中的黄曲霉素的测定已有相关研究报道[17-19],但在占世界卷烟消费1/3的中国还未见报道。因此,准确测定卷烟中的黄曲霉素,可对疑似霉变烟叶和卷烟的处理提供依据和参考。
1 实验部分
1.1 方法原理
样品以三氯甲烷萃取,净化并浓缩后,在选定的仪器参数下,进行液相色谱-质谱分析。采用对照标准品的保留时间和特征碎片离子定性,外标标准曲线法定量。
1.2 仪器与试剂
Agilent 1200液相色谱仪;Agilent 6430三重四极杆质谱仪,Paker NitroFlowLab氮气发生器;Millipore Milli-Q 超纯水制备系统;Binder FD53热风干燥箱;AG285型电子天平(感量0.000 1g);KQ-700型超声波清洗机;RE-52AA型旋转蒸发仪。
黄曲霉素 M1、M2、G1、G2混标(混合标准溶液)supelco;甲醇、异丙醇、三氯甲烷、正己烷,色谱纯,dikma;乙酸铵,优级纯,国药试剂;硅胶SPE柱,agilent,500mg/(5mL);烟叶样品取自仓库,卷烟样品购自市场。
1.3 样品制备与净化
按YC/T 31-1996要求制备试样。称取研磨好的试样5.0g,置于50mL具塞锥形瓶中,加入20mL三氯甲烷,超声提取30min。过滤,收集滤液于带有刻度尾管的浓缩瓶内,并用三氯甲烷洗涤滤渣,收集清洗液。用旋转蒸发仪将上述滤液在50℃水浴中浓缩至约1mL,加入4mL正己烷混匀,注入活化好的硅胶SPE小柱中。依次用5mL正己烷、5mL三氯甲烷淋洗,弃去流出液。然后,用10mL三氯甲烷-甲醇溶液(体积比为9∶1)分2次洗脱,收集洗脱液于带有刻度尾管的浓缩瓶内。在氮气保护,50℃水浴条件下,用旋转蒸发仪将样品浓缩至0.5mL。待液相色谱、质谱分析。
1.4 标准溶液配制
用甲醇将黄曲霉素混标稀释为系列标准溶液,各目标化合物质量浓度如表1所示。
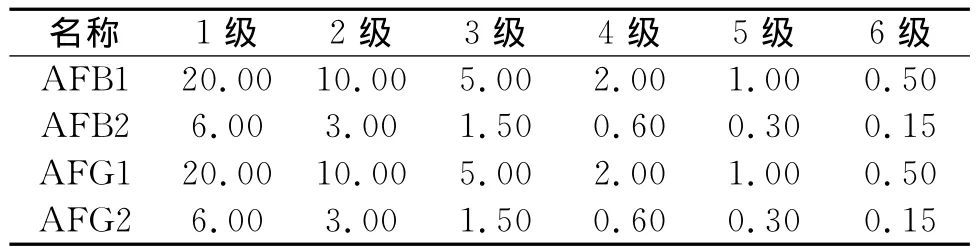
表1 黄曲霉素标准溶液质量浓度 ng/mL
1.5 仪器条件
1.5.1 色谱条件
进样量:10μL;色谱柱:Zorbax SB-C18(2.1×50mm,1.8μm);柱温:45℃;流速:0.5mL/min;流动相:A——10mmol/L 乙酸铵-水溶液,B——10mmol/L乙酸铵-甲醇溶液;梯度洗脱:0minw(B)=5%、10minw(B)=40%、15minw(B)=100%、20minw(B)=100%,后运行5min。
1.5.2 质谱条件
离子源:ESI;干燥气温度:325℃;干燥气流量:10L/min;雾化器压力:344.75kPa(50psi);毛细管电压:4 000V;采集方式:MRM;三重串联四极杆液质多反应监测模式(MRM),参数见表2。
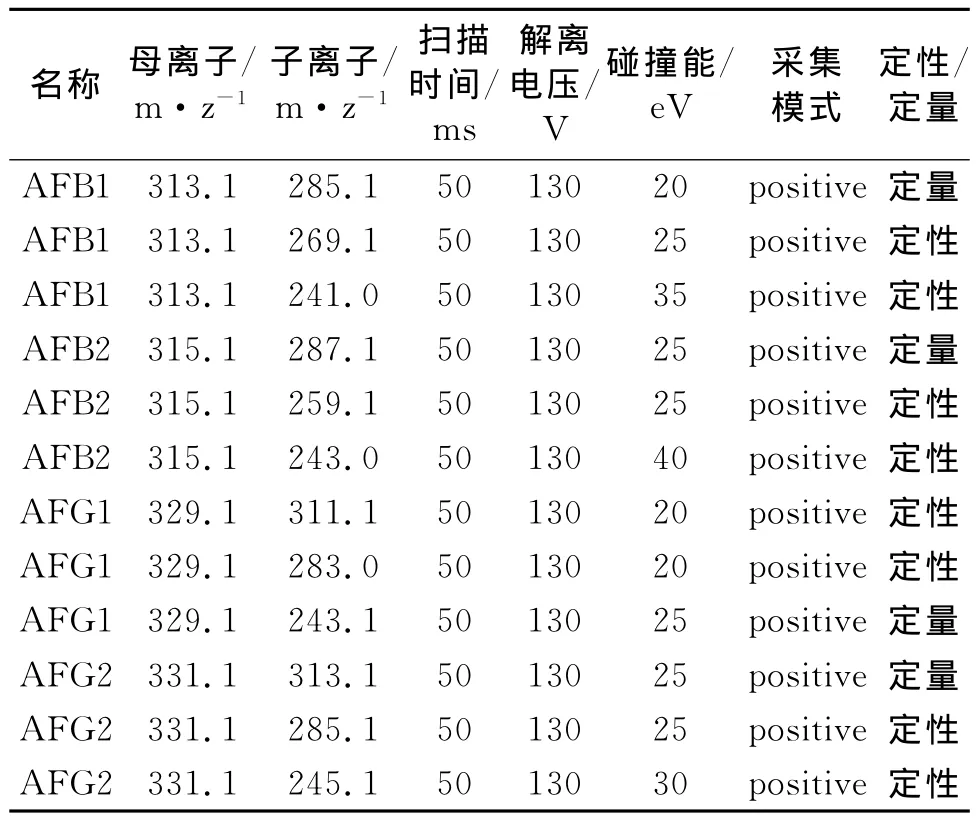
表2 MRM采集参数表
2 结果与讨论
2.1 仪器条件的优化
以乙腈-水为流动相时,乙腈抑制黄曲霉素化合物离子化导致质谱信号降低,并且色谱峰出现拖尾现象。以甲醇-水作为流动相,质谱信号提高,峰形对称。实验在甲醇-水中添加乙酸铵提高质谱灵敏度,当流动相中乙酸铵的浓度达到10mmol/L时质谱信号最强。采用梯度洗脱条件,4种黄曲霉素在13min内即达到较好的分离效果。因此,本实验选择甲醇-乙酸铵混合体系作为流动相。标准样品色谱图和实际样品色谱图见图1和第31页图2。
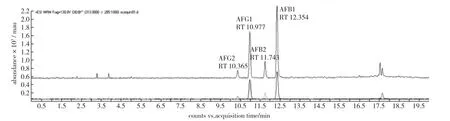
图1 标准样品色谱图
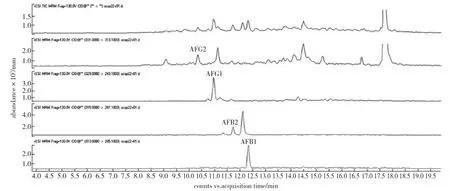
图2 实际样品色谱图
由于黄曲霉素化合物分子结构中羰基具有强的电负性,有利于分子获取氢离子,因此选择正离子扫描较合理。同时,实验考察了正、负离子扫描方式对黄曲霉毒素B1、B2、G1、G2灵敏度的影响。结果显示,正离子扫描模式下质谱信号明显高于负离子扫描。然后,利用安捷伦自动参数优化软件(mass hunter optimizer)可以自动得到每个待测组分的最佳碰撞电压和碰撞能,并确定最优的子离子。
2.2 样品提取和净化
实验考察了超声和振荡2种方式对4种黄曲霉素的提取效果。在5.0g烟末样品中加入1.0mL 4种黄曲霉素的混标溶液,待溶液完全被样品吸收后,再分别用乙酸铵水溶液、甲醇、异丙醇、三氯甲烷进行超声波,振荡提取,测定4种待测物。结果发现,乙酸铵的提取效果不好;甲醇和异丙醇的提取液颜色较深,回收率在120%~200%;而用三氯甲烷提取时,样品中4种待测物的干扰较小,回收率在70%~103%,故选三氯甲烷作为提取剂。经实验,确定用20mL三氯甲烷,超声提取30min即可达到较好的效果。
烟草中含有几千种化学成分,其提取物基质较为复杂,且黄曲霉素的检测在痕量范畴,因此,要通过合适的净化方式去除干扰。查阅相关文献,常用的净化方法有传统固相萃取法、免疫亲和固相萃取法以及多功能净化柱法,这几种方法均有着各自的优缺点。传统固相萃取处理过程复杂,但回收率和精密度较好;免疫亲和柱和多功能净化柱处理过程相对简单,但价格昂贵、不易保存、易失效,且回收率和精密度不如传统固相萃取。因此,本实验选用SPE固相萃取柱净化提取液。
2.3 标准曲线及检出限
对1.4中所配制的标准溶液按1.5所述仪器条件进行检测,以质量浓度X(ng/mL)对峰面积Y进行线性回归,计算标准曲线;将最低浓度的标准溶液重复进样10次,其3倍标准偏差为检出限。结果如表3所示。
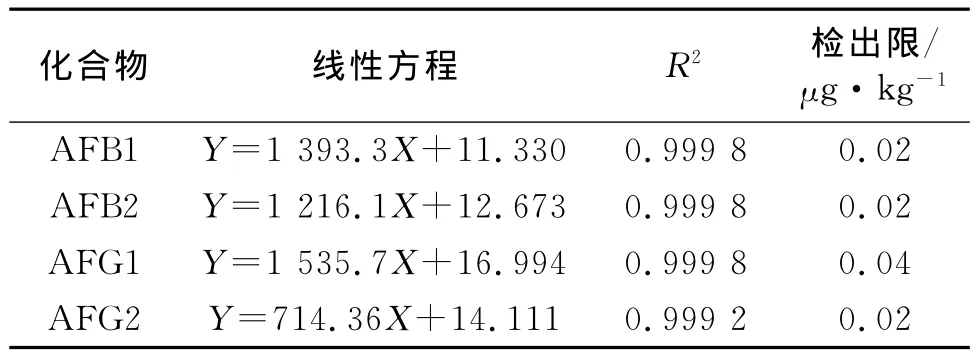
表3 4种黄曲霉素的线性方程与检出限
2.4 精密度与回收率
按高、中、低3个加入水平,向不含黄曲霉素的空白试样中加入黄曲霉素混标,每个加标水平进行6次平行测定,结果见第32页表4。结果表明,采用本方法对空白样品加标实验,除黄曲霉G2的回收率较低为66.3%~70.7%,这可能是由于G2的测定重复性较差所致外,其他3种的平均回收率均在85.0%以上,且重复性小于10%。说明本方法比较可靠。
2.5 实际样品检测
用本方法对部分假冒卷烟或可疑霉变卷烟及烟叶样品进行了检测,结果见第32页表5。正常卷烟中未检出黄曲霉素;部分可疑霉变烟叶中检出B1,个别假冒卷烟中检出G1,但含量均低于5μg/kg。
3 结论
采用液相色谱-质谱联用法对烟草中黄曲霉素的含量进行了检测,方法重复性较好,检出限低,快速准确,适合可疑霉变烟叶和卷烟中黄曲霉素的同时快速测定。

表4 精密度与加标回收率
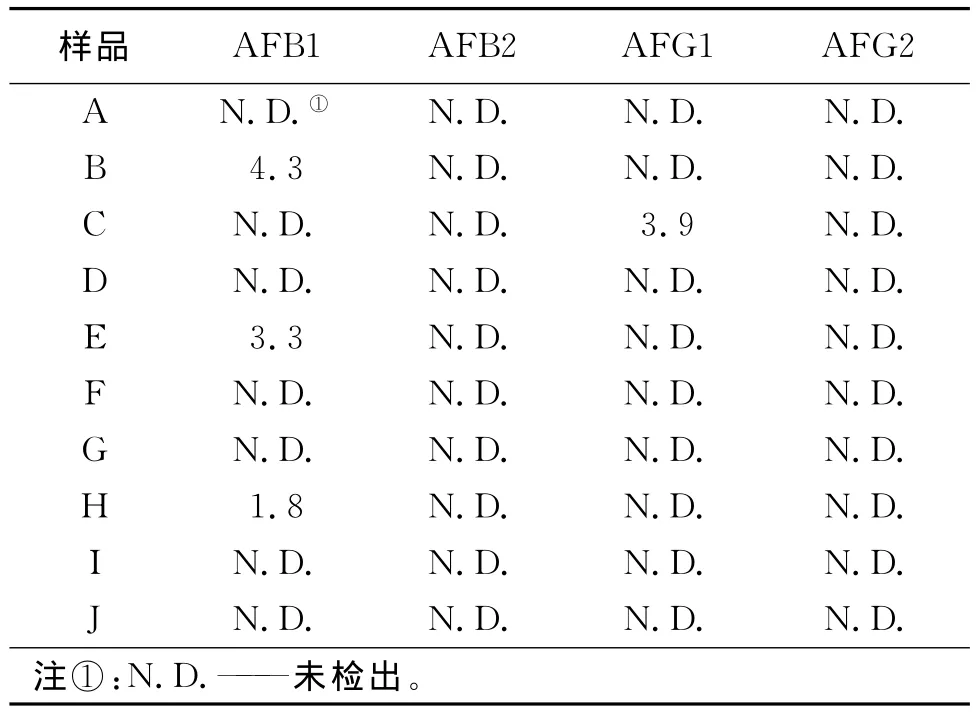
表5 部分假冒伪劣卷烟黄曲霉素的含量 μg/kg
[1] Yu J.Genetics and biochemistry of mycotoxin synthesis[M]//Arora D K.Handbook of fungal biotechnology.2nd ed.New York:Marcel Dekker,2002:167-206.
[2] 张东升,赵晓联.黄曲霉毒素 M1的危害、污染现状及检测方法进展[J].中国卫生检验,2004(6):266-269.
[3] 王君,刘秀梅.部分市售食品中黄曲霉素污染的监测结果[J].中华预防医学,2006(1):33-37.
[4] Brown R L,Bhatnagar D,Cleveland T E,et al.Recent advances in preharvest prevention of mgcotoxin contamination[M]//Sinha K K.Mycotoxins in agriculture and food safety.New York:Marcel Dekker,1998:351-379.
[5] Charles L,Wilson,Samir Droby.Microbial food con-tamination[M].New York:CRC Press,2001:208-229.
[6] Akiyama H.Determination of aflatoxins B1、B2、G1and G2in spices using a multifunctional column clean-up[J].Journal of Chromatography:A,2001,932:153-157.
[7] 郝红玲,鲍峰伟,范运涛,等.假冒卷烟所用硫磺熏蒸烟叶的鉴定及探讨[J].食品工业,2011(11):97-98.
[8] 陈越立,肖明礼,杨庆.烟叶霉变及预防[J].广东化工,2011,38(4):49-50.
[9] 赵文姬.云南仓储烟叶霉变及其生物防治研究[D].北京:中国农业科学院,2004.
[10]王革,张中义,孔华忠,等.云南烟叶贮藏期霉变研究(1)——曲霉[J].云南农业大学学报,2002,17(4):356-359.
[11]Stroka J.Development of a simplified densitometer for the determination afaflatoxins by thin-layer chromatography[J].Journal of Chromatography:A,2000,904:263-268.
[12]柳杰,何碧英.高效液相色谱法测定食品中黄曲霉素的方法研究[J].现代预防医学,2002,29(2):137-140.
[13]宋欢.液相色谱法测定饲料中的黄曲霉毒素B[J].山西农业大学学报,2001,21(3):257-258.
[14]陈达民.微柱法快速测定饲料中黄曲霉素的总量[J].饲料工业,1993,14(1):29-30.
[15]Poole G H.The potential of hyperspectral imaging for the detection of aflatosin[C]//Corn refiners aassocimion(eds).Proceedings of the 2nd fungal genomics,3rd fumonisin elimination and 15th atlatoxin elimination workshops.Texas:CRA,2002:55.
[16]David Casasent,Xue Wenchen,Songyot nakariyakul.Hyper spectral methods to detect aflatoxin in whole kernel corn[C]//Corn refiners association(eds).Proceedings of the 2nd fungal genomics,3rd fumonisin elimination and 15th atlatoxin elim.ination Workshops.Texas:CRA,2002:56.
[17]Lindholm J,Wiernik A,Grandin B,et al.Development and validation of a UPLC-MS/MS method for quantification of mycotoxins in tobacco and smokeless tobacco products[C].CORESTA Meeting smoke Sci-prod.Techno Groups,Graz:CORESTA,2011:15.
[18]Lane K.Method and system for continuous assay and removal of harmful toxins during processing of tobacco products:US,8786221[P].2004-09-09.
[19]Pattee H E.Production of aflatoxins by aspergillus flavus cultured on flue-cured tobacco[J].App Micro,1969,18:952-953.
