食管早期癌及上皮内瘤变内镜黏膜下剥离术16 例临床分析
2015-12-31胡文华武育卫王仰坤
胡文华,武育卫,王仰坤
河南省洛阳市解放军150 中心医院1. 消化内科;2.病理科,河南 洛阳471031
我国是食管癌发病率和死亡率最高的国家[1],通过合理应用内镜检查、食管黏膜染色及指示性活检可以有效地诊断食管早期癌及癌前病变。不伴有明显临床转移的食管早期癌及癌前病变是内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)的主要适应证[2]。通过ESD 根除食管癌前病变可以阻断食管癌的发生,根除早期癌则可以使食管早期癌患者的5 年生存率接近90%。收集2011 年1 月-2013 年7 月经洛阳解放军150 中心医院消化内科行ESD 治疗的16例食管早期癌及上皮内瘤变患者,疗效满意,现报道如下。
1 资料与方法
1.1 一般资料 收集2011 年1 月-2013 年7 月在解放军150 医院行ESD 的患者16 例,男10 例,女6 例,年龄42 ~74 岁,平均年龄(53.2 ±11.8)岁。患者术前均签署知情同意书,告知可能的益处和风险。
1.2 器械与方法 Pentaxi-scan 主机,EG-2990i 电子胃镜,NM-4L-1 注射针,Olympus FD-410LR 热活检钳,Olympus KD-650Q 刀,ERBE VIO-200S 高频电切装置和APC200 氩气刀。对胃镜发现的食管可疑病变首先行卢戈氏液(Lugol's solution)碘染色和超声内镜检查,确定病变边界、范围和深度。所有患者均在气管插管静脉麻醉条件下行ESD,术后1、3、6 个月内镜复查评估治疗效果。(1)标记:染色确定病灶范围后应用APC 于病灶边缘以外0.2 ~0.5 cm 处进行标记,每个标记点间隔约0.2 cm;(2)黏膜下注射:自肛侧向口侧方向,于病灶边缘标记点外侧进行多点注射,每次注入液体约2 ml,使病灶抬举征阳性,病灶与肌层充分分离,以利于ESD 完整切除病灶。液体配方:3 ~5 ml 靛胭脂,1 ml 肾上腺素和100 ml 甘油、果糖混合而成溶液;(3)切开:沿抬举征阳性病灶标记点外侧应用Olympus KD-650Q 刀直接切开病变周围部分黏膜,切开过程中如发生出血,可冲洗创面,明确出血点后应用该针形刀进行电凝止血,如效果不明显,改用Olympus FD-410LR 热活检钳电凝止血;(4)剥离病灶:在操作过程中,要反复进行黏膜下注射,以确保病灶充分抬举,在透明帽的辅助下,应用针刀沿黏膜下层剥离病灶,且要始终保持剥离层次在黏膜下层。要积极对裸露的血管进行针刀或热活检钳预防性止血,确保视野清晰,防止穿孔发生。剥离过程必须注意抽吸消化道腔内气体,防止压力较高所致较小的肌层裂伤而造成的穿孔;(5)创面处理:切除病灶后,对创面可见的小血管,应用热活检钳电凝止血,并反复沖洗观察,确保没有活动性出血后方可结束治疗并退镜;(6)送检病理:完整回收剥离的病灶,体外固定展开,予卢戈氏液(Lugol's solution)再次染色,确保切缘无病灶累及。送检组织病理学分析,明确病灶边缘及基底无病变残留。
1.3 术中出血及穿孔的判定 术中出血为活动性出血,量大且内镜止血困难。术后24 ~72 h 出现呕咖啡色样液体,呕血或黑便为迟发性出血。术中出现颈胸部皮下气肿或术后胸部CT 证实有纵膈气肿或气胸者定义为术中穿孔。
2 结果
2.1 卢戈氏液碘染色及内镜检查结果 16 例共24处食管黏膜病变,常规胃镜检查表现为局部黏膜充血、糜烂或黏膜斑块、粗糙和结节及浅表隆起或浅表凹陷。病灶大小为1.6 cm×2.5 cm ~8.0 cm ×3.0 cm,卢戈氏液碘染色内镜下表现为边界清晰,规则或不规则的淡染区或拒染区,严重病例可见粉色征(见图1 ~3)。
2.2 病理检查结果 治疗前病理检查:高级别上皮内瘤变11 例共19 处病变,黏膜内癌3 例共3 处病变,原位癌2 例共2 处病变。16 例22 处病变成功完成ESD治疗,手术成功率为91.67%(22/24)。术后病理示6例12 处高级别上皮内瘤变与术前诊断相符,3 例原诊断为高级别上皮内瘤变共3 处,其中2 处为黏膜内癌,1 处为原位癌。术前3 例共3 处黏膜内癌,2 例共2 处原位癌ESD 术后病理与术前相符。ESD 成功剥离的病例术后病理分析显示病灶边缘及基底均未见病变残留。
2.3 手术时间 从术前碘染至病变ESD 完整剥离手术时间为25 ~36 min,平均(32 ±2)min。
2.4 并发症 2 例高级别上皮内瘤变未能成功实施ESD,1 例病灶为7.0 cm×3.0 cm,1 例病灶为5.0 cm×2.8 cm,均因病变剥离过程中出现术中出血,且操作时间过长,平均(45 ±3)min,为避免穿孔的严重并发症发生,改行电圈套器分片切除。图4 ~5 展示一个典型病例,术前诊为高级别上皮内瘤变,术后病理证实原位鳞状细胞癌。
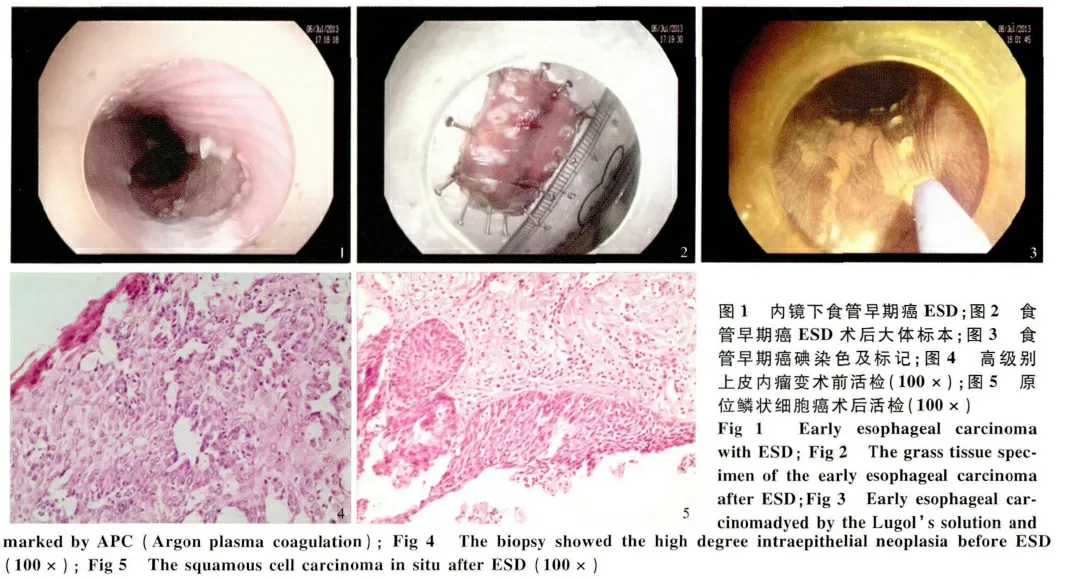
3 讨论
内镜下治疗食管早期癌及癌前病变在日本及欧州等国家已被普遍接受[3]。国内先进单位开展的ESD对食管早期癌及癌前病变的疗效研究也充分证明ESD是治疗上消化道早期癌及癌前病变的有效治疗方法[4],其优势为创伤小、疗效好、恢复快。
食管早期癌及癌前病变内镜下表现不具特征性,可呈现为局部黏膜充血、糜烂或黏膜斑块、粗糙和结节及浅表隆起或浅表凹陷。利用食管癌细胞内糖原含量减少或消失,利用卢戈氏液对可疑病变进行碘染色,病变因淡染或拒染而被凸显出来[5],而且病变的边界可以很准确地确定下来,以保证病变被完整地剥离出来不留残余。判断食管早期癌病变的深浅、层次及是否存在淋巴结的转移主要通过超声内镜。小探头超声内镜可将消化管壁的层次分为4 层,食管早期癌的超声内镜图像表现为管壁黏膜层次增厚,层次紊乱、中断及较小的不规则低回声影。需要说明的是超声内镜对病变侵犯深度的判别也存在分期过度或分期不足的问题。由于我院开展ESD 治疗食管早期癌及上皮内瘤变时间不长,本组病例主要选择病变位于黏膜层及黏膜下浅层的患者以确保病灶能完整剥离且基底部无残留。本组16 例共24 处食管黏膜病变中,14 例22 处病灶均得以完整及完全剥离,术后病理均证实未发生残留现象。术前病理与术后病理的差异进一步提示,内镜组织活检标本对病变性质的判别能力弱于大块组织标本所提供的病理信息。对发现的可疑食管早期癌或癌前病变,不应仅局限于定期内镜随访及内镜下组织活检所取得的病理信息。有条件的医院应该积极争取开展食管早期癌及癌前病变的ESD,以阻断食管癌的发生。本组病例中2 例患者出现较为严重的出血,且ESD 操作时间较先进医院偏长,为避免严重并发症的发生,后改为电圈套器分片切除病变,也说明我们还需不断积累病例并改进操作技术。由于我院开展食管早期癌及上皮内瘤变的ESD 治疗时间仍有不足,对ESD 术后患者肿瘤是否复发,食管有无重度狭窄等远期并发症尚有待进一步观察。
[1] Li P,Zhang ST. The early esophageal carcinoma diagnosed by endoscopy[J]. Chin J Dig Endosc,2013,30(1):8-9.李鹏,张澍田. 早期食管癌的内镜诊断[J]. 中华消化内镜杂志,2013,30(1):8-9.
[2] Zhang XL,Lu ZS,Yang YS. Evolving the endoscopic submucosal resection (EMR)and the endoscopic submucosal dissection (ESD)followed by the specifications of quality[J]. Chin J Dig Endosc,2012,29(5):241-242.张修礼,卢忠生,杨云生. 规范开展内镜黏膜切除术和内镜黏膜下剥离术[J].中华消化内镜杂志,2012,29(5):241-242.
[3] Van vilsteren FGI,Pouw RE,Seewald S,et al. Stepwise radical endoscopic resection versus radiofrequency ablation for Barrett's oesophagus with high-grade dysplasia or early cancer:a multicentre randomised trial[J].Gut,2011,60:765-773.
[4] Liu J,Linghu EQ,Lu ZS,et al. Risk factors for incomplete resection in ESD for precancerous lesions and early cancer in upper digestive tract[J]. Chin J Dig Endosc,2012,29(10):554-557.刘杰,令孤恩强,卢忠生,等. 上消化道癌前病变及早期癌内镜黏膜下剥离术切除标本阳性的多因素分析[J]. 中华消化内镜杂志,2012,29(10):554-557.
[5] Hashimoto CL,Iriya K,Baba ER,et al. Lugol's dye spray chromoendoscopy establishes early diagnosis of esophageal cancer in patients with primary head and neck cancer[J]. Am J Gastroenterol,2005,100(2):275-282.
