预测重度溃疡性结肠炎患者需手术治疗的临床指标
2015-12-31金鑫鑫袁柏思路又可王少东汪芳裕
魏 娟,金鑫鑫,袁柏思,刘 炯,路又可,王少东,汪芳裕
中国人民解放军南京军区南京总医院/南京大学医学院附属金陵医院消化内科,江苏 南京210002
过去的30 年,重度溃疡性结肠炎(ulcerative colitis,UC)的病死率由31% ~61%降至1% ~2%,很大程度上受益于激素及适时的手术治疗[1],静脉激素输注对重度UC 的缓解率为70%左右,但仍有约1/3 的患者对静脉激素治疗无反应[2]。因此,如何尽早识别静脉激素治疗无效的重度UC 患者,适时转换为二线药物或手术治疗,对于改善病情预后,提高患者生活质量和降低治疗费用等,均显得尤为重要。本研究通过观察中国人民解放军南京军区南京总医院近10 年来收治的重度UC 患者的临床表现及各种检测指标等,归纳经静脉激素治疗无效的重度UC 患者的临床特征,并进一步观察随访1 年的病情变化和预后,旨在求证药物或手术治疗的适当转换时机。
1 资料与方法
1.1 一般资料 收集中国人民解放军南京军区南京总医院2000 年2 月-2013 年1 月82 例疑似重度UC患者,20 例被排除(12 例失访,8 例后期诊断为克罗恩病结肠型),余62 例患者纳入研究,男39 例,女23 例,年龄21 ~41,平均(31.2 ±5.3)岁。UC 诊断符合临床、内镜和组织学标准,疾病活动度评估按Truelove and Witt's 评分标准[3],分值>8 分定义为重度。观察时间点为入院时、静脉激素治疗的第3 天、二线药物或手术开始治疗时。静脉激素包括氢化可的松、甲强龙,氢化可的松的剂量统一换算为甲强龙的用量。
1.2 观察指标 记录重度UC 患者临床特征、药物治疗及实验室指标,包括性别、年龄、病史、既往住院次数、住院前3 d 平均大便次数、结肠病变范围、是否合并结肠扩张、平均住院日、体温、脉搏、血红蛋白、白细胞、C-反应蛋白(CRP)、血沉、粪便钙卫蛋白。入院后治疗包括静脉激素、肠外营养、抗生素治疗、中药灌肠等。4 种临床常用的预测指数:(1)Oxford 指数:CRP>45 mg/L,大便次数3 ~8 次/d,或第3 天大便次数>8 次/d 定义为阳性[4];(2)Swedish 指数:第3 天(大便次数/d+0.14 ×CRP mg/L)如≥8 分定义为阳性[5];(3)Edinburgh 指数:①大便次数(0 ~4 分),②结肠扩张4 分,③第1 天的低蛋白血症如≥4 分定义为阳性[6];(4)Seo 指数:60X1+13X2+0.5X3-0.4X4-1.5X5+200(X1=大便带血,X2=每天大便次数,X3=血沉,X4=血红蛋白,X5=白蛋白),如≥180 分定义为阳性[7]。
1.3 预后评估 短期预后评估:静脉激素治疗的短期效应观察,即静脉激素治疗第3 天,观察各种指标及指数;长期预后评估:即出院后1 年随访,结合患者用药情况临床特点可分成以下:保持缓解或疾病复发且活动度至少为中度以上。激素依赖定义:需激素治疗6个月以上,因激素治疗的中断曾导致病情反复。
1.4 统计学方法 采用SPSS 16.0 统计软件进行分析,利用单因素分析方法,定量资料用t 检验,定性资料用χ2检验,比较两个预测指数诊断一致性用Kappa检验。P <0.05 为差异有统计学意义。ROC 曲线反应各预测激素治疗无效指数的预测效率。
2 结果
2.1 患者临床特征 62 例重度UC 患者纳入研究,所有患者均在激素治疗的第1 天在临床评分、临床特征方面均无显著性差异(见表1)。

表1 入院时静脉激素治疗第1 天重度UC 患者的临床特点Tab 1 Clinical characteristics of patients with severe UC at first day treated by intravenous normone therapy
2.2 7 项预测因子和4 种预测指数的预测价值比较62 例使用静脉激素治疗的患者中,38 例有效,在使用静脉激素治疗后(14 ± 5. 8)d 出院,缓解率为61.3%。24 例激素无反应的患者,在使用静脉激素治疗后(15 ±10.5)d 需手术治疗,3 例并发中毒性巨结肠,其中1 例死亡。
在激素治疗的第3 天,以下7 项预测因子能预测激素治疗失败,有显著意义,单项预测因子包括年龄、病史、结肠病变范围、大便次数、CRP 水平、白蛋白、粪便钙卫蛋白、水平肠外营养、抗生素、中药灌肠治疗(见表2)。
4 种预测指数均能有效地鉴别出激素治疗无效的患者。Oxford 指数预测手术效率与Swedish 指数有较好的吻合性(k=0.844,P =0.000);Oxford 指数与Seo指数、Edinburgh 指数有显著性差异(P = 0. 032,0.028,见表3,见图1)。
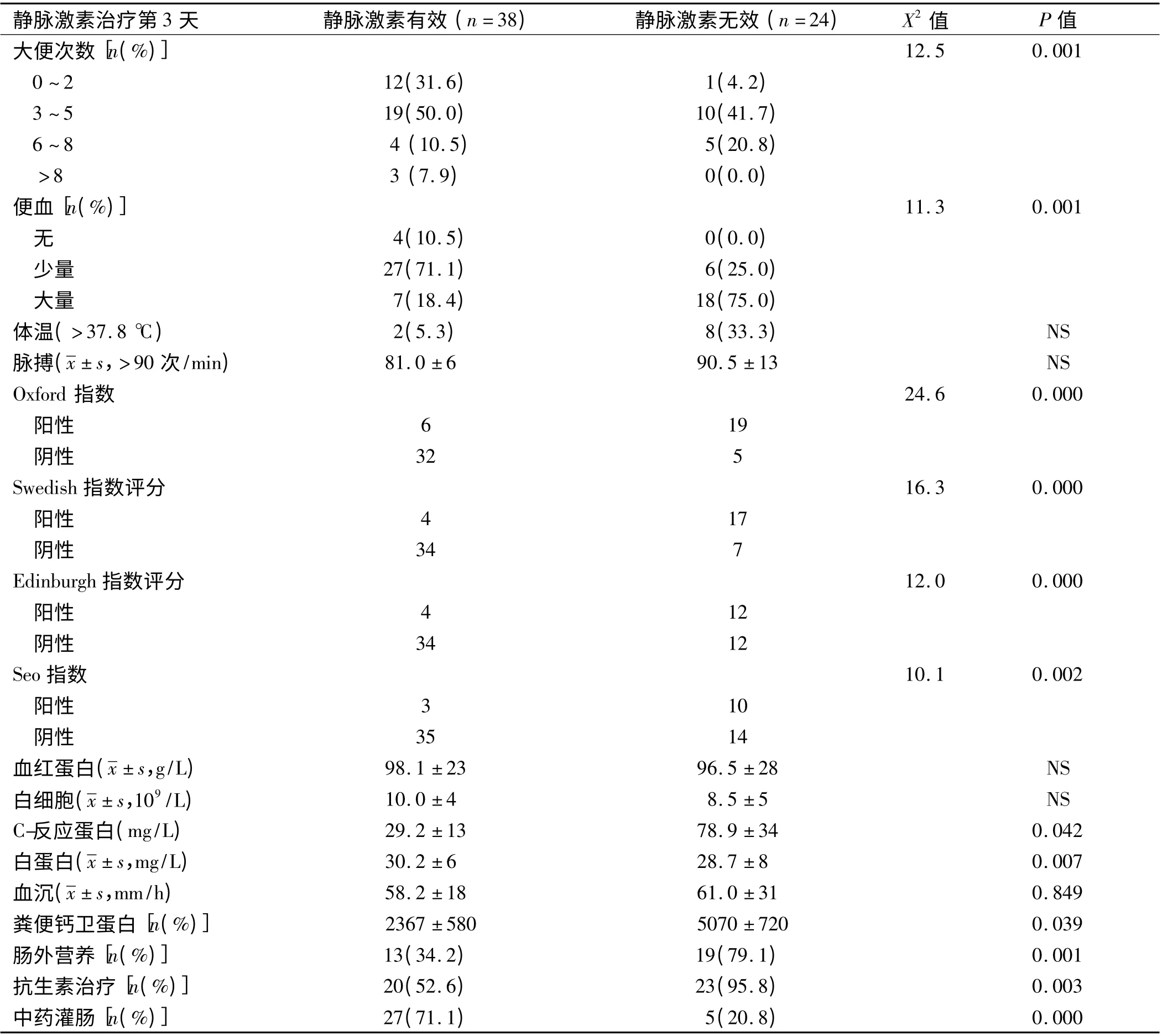
表2 静脉激素治疗的第3 天患者的各项临床指标Tab 2 Clinical indicators at third days after intravenous hormone therapy

表3 4 种预测指数的预测效率(%)Tab 3 Forecasting efficiency of 4 kinds of forecasting index (%)
2.3 随访结果 在发病后1 年的随访中,38 例激素治疗有效患者激素逐渐减量至停用,保持临床缓解(n=11)或轻度活动(n=10),其中仅8 例使用硫唑嘌呤维持治疗,其余皆为美莎拉嗪维持治疗;11 例患者间断出现中度活动,5 例出现二次重度活动的打击,但再次激素均治疗有效;1 例患者因激素依赖主动要求行手术治疗。

图1 各种预测指数在预测手术切除准确率的ROC 曲线Fig 1 ROC curves for predicting the accuracy of surgical resection with various predictive indices
3 讨论
1978 年,Truelove 等[8]报道重度UC 患者静脉使用60 mg 泼尼松龙,缓解率为60%。一项涉及32 个中心的临床研究收集了1974 年-2006 年的2 000 例重度UC 患者,激素治疗的缓解率为67%[2],本研究62例重度UC 患者,激素冲击治疗的缓解率为61.3%,与既往研究结果相近。目前,激素治疗仍然是中重度UC的一线治疗方法。二线药物治疗如环孢素或英夫利西,作为拯救性治疗能降低短期内手术风险,近期研究发现环孢素及英夫利西作为重度UC 的拯救性治疗药物有着相似的治疗效果[9]。2005 年欧美已使用类克治疗激素抵抗型UC[10],日本也于2010 年将英夫利西应用于中重度UC 的治疗,现已纳入相关诊治指南[11-12]。印度近期也有英夫利西应用于治疗重度UC患者的报道[13]。但英夫利西应用于中重度UC 的拯救性治疗,国内尚处于起步阶段,有待于进一步研究证实其有效性和安全性。
尽管如此,手术治疗仍是重度UC 经激素治疗无效的主要方法,目前,接近1/3 的重度UC 患者仍需手术。中毒性巨结肠、肠穿孔、不能缓解的消化道大出血是外科急诊手术绝对指征。重度UC 的治疗方案需要内外科医师共同慎重制定。由于患者可能会排斥手术治疗,内科医师在作出转外科手术治疗决定时难免会犹豫不决,而外科医师为减少术后并发症,通常希望在长时间使用静脉激素之前手术,以免因持续内科治疗无效而延误手术时机。因此,手术时机及指征的制定是重度UC 治疗的重点之一。Nicholls 等[14]研究发现需要院内缓解的UC,选择性结肠切除的患者3 年内死亡率最低。因此寻找需手术治疗的预测因子显得尤为重要。
近期有研究证明老年患者病情相对较轻[15],预测需手术治疗的临床指标如大便次数、脉搏、体温。住院第3 天大便次数≥8 次是手术治疗的重要预测因素,在本研究中也验证其预测准确率高。Travis 等[4]在一项前瞻性研究中,包括51 例重度UC,患者强化治疗第3 天,如大便次数≥8 次/d,则预测手术率为85% (P<0.001)。而脉搏、体温在两组中无显著性差异。有研究观察CRP,手术组明显高于非手术组,CRP 是重要的生化标志,也是一个有预测手术的重要的客观指标[16],同时其与大便次数是Oxford 指数和Swedish 指数的重要构成成分。入院治疗第3 天,如CRP≥4 mg/L,同时大便次数3 ~8 次/d,预测手术率为85%(P <0.00625)。低血白蛋白水平也是预测重度UC 需手术的重要因素,早期某项研究中,患者入院治疗第1 天,如血白蛋白<30 g/L,则42%患者需行手术治疗[15]。在2004 年Ho 等[6]研究发现白蛋白水平辅以临床、影像学证据等,其预测手术敏感性明显升高。Lees 等[17]指出在运用静脉激素治疗的第3 天,血白蛋白水平能预测患者对英夫利西治疗的敏感性,即运用英夫利西的第3 天,如血白蛋白<34 g/L,提示其需要行结肠切除,其敏感度为57%,特异度为90%。
本研究发现入院后需给予肠外营养支持或应用抗生素治疗的患者更趋向于手术治疗。中药灌肠有效的患者手术风险小。当患者大便次数明显增多,尤其脓血便加重时,临床医师通常嘱患者禁食,同时全肠外营养支持,Ananthakrishnan 等[18]提示出血、需要输血、营养不良和全肠外营养都是结肠切除的独立预测因子。Mir 等[19]报道那些病程短及需要输血的UC 患者更倾向于手术治疗。McIntyre 等[20]提出全肠外营养或肠道休息在UC 治疗中疗效不肯定,但全肠外营养可纠正营养不良、水电解质紊乱和酸碱平衡等。Mantzaris等[21]指出抗生素不能为重度UC 患者带来益处,但即便粪便细菌培养为阴性,临床医师通常也会给予经验性预防感染治疗。本研究中,手术组中接受肠外营养支持、抗生素治疗患者比例明显大于对照组,考虑与临床医师根据客观指标及经验,综合判断患者病情更为危重,需给予上述治疗有关。
目前,国内外研究有关重度UC 患者需手术治疗,有多种预测因子,大致分为临床特征、实验室指标、影像学特征、内窥镜表现、基因指标等5 类,临床特征如大便次数,实验室指标如CRP、白蛋白、粪便钙卫蛋白等作为独立的预测因子。我们过去的研究显示粪便钙卫蛋白水平可反映UC 的疾病活动度[22]。在本研究中,粪便钙卫蛋白水平也是重度UC 静脉激素治疗无效的独立预测因子。其他多种因素也可作为预测因子,国内外报道的如乳铁蛋白、M2 型丙酮酸激酶、纤维蛋白原、胆碱酯酶及血液pH >7.4,影像学特征如结肠扩张>5.5 cm[23]、黏膜岛、MRI 和内窥镜表现,基因指标如HLA DRB1* 103[24]。
多种预测因子纷繁复杂,临床可操作性欠佳,故目前某些简洁、易记,由可靠的客观依据构成的综合指数应运而生,常用的如Oxford 指数、Swedish 指数、Edinburgh 指数和Seo 指数,但目前尚无金标准[25]。本研究中,Oxford 指数与Swedish 指数预测效率有一致性,且优于Edinburgh 指数。因此可运用Oxford 指数与Swedish 指数指导临床工作,把握外科手术指征,及时为患者选择合适的治疗方法。重度UC 手术治疗的预测因素尚需多中心、大样本进一步研究,选择更准确的预测因子及合适的转换治疗时机。
[1] Truelove SC,Willoughby CP,Lee EG,et al. Further experience in the treatment of severe attacks of ulcerative colitis[J]. Lancet,1978,2(8099):1086-1088.
[2] Turner D,Walsh CM,Steinhart AH,et al. Response to corticosteroids in severe ulcerative colitis:a systematic review of the literature and a meta-regression [J]. Clin Gastroenterol Hepatol,2007,5 (1):103-110.
[3] Truelove SC,Witts LJ. Cortisone in ulcerative colitis:preliminary report on a therapeutic trial[J]. Br Med J,1954,2(4884):375-378.
[4] Travis SPL,Farrant JM,Ricketts C,et al. Predicting outcome in severe ulcerative colitis[J]. Gut,1996,38(6):905-910.
[5] Lindgren SC,Flood LM,Kilander AF,et al. Early predictors of glucocorticoid treatment failure in severe and moderately severe attacks of ulcerative colitis[J]. Eur J Gastroenterol Hepatol,1998,10(10):831-835.
[6] Ho GT,Mowat C,Goddard CJ,et al. Predicting the outcome of severe ulcerative colitis:development of a novel risk score to aid early selection of patients for second-line medical therapy or surgery[J]. Aliment Pharmacol Ther,2004,19(10):1079-1087.
[7] Higgins PD,Schwartz M,Mapili J,et al. Patient defined dichotomous end points for remission and clinical improvement in ulcerative colitis[J].Gut,2005,54(6):782-788.
[8] Truelove SC,Willoughby CP,Lee EG,et al. Further experience in the treatment of severe attacks of ulcerative colitis[J]. Lancet,1978,2(8099):1086-1088.
[9] Singh S,Loftus EV Jr. Management of severe steroid-refractory ulcerative colitis:cyclosporine or infliximab?[J]. Gastroenterology,2013,144(5):1138-1140.
[10] Targan SR,Salzberg BA,Mayer L,et al. A phase I-II study:multiple dose levels of visilizumab are well tolerated and produce rapid and sustained improvement in ulcerative colitis patients refractory to treatment with intravenous steroids (IVSR-UC)[J]. Gastroenterology,2005,128 (Suppl 2):A75.
[11] Katsuno T,Saito K,Yokosuka O. Should colectomy be the end-point to evaluate the effectiveness of drug therapies in severe ulcerative colitis?[J]. Aliment Pharmacol Ther,2013,37(1):161.
[12] 長堀正和,藤井俊光,齊藤詠子,等. 潰瘍性大腸炎に対する生物学的製剤による治療[J]. 日本消化器病学会雑誌,2013,110(11):1909 -1915.
[13] Sood A,Midha V,Sharma S,et al. Infliximab in patients with severe steroid-refractory ulcerative colitis:Indian experience[J]. Indian J Gastroenterol,2014,33(1):31-34.
[14] Nicholls S,Stephens S,Braegger CP,et al. Cytokines in stools of children with inflammatory bowel disease or infective diarrhea[J].J Clin Pathol,1993,46(8):757-760.
[15] Lennard-Jones JE,Ritchie JK,Hilder W,et al. Assessment of severity in colitis:a preliminary study[J]. Gut,1975,16(8):579-584.
[16] Monterubbianesi R,Aratari A,Armuzzi A,et al. Infliximab threedose induction regimen in severe corticosteroid-refractory ulcerative colitis:early and late outcome and predictors of colectomy[J]. J Crohns Colitis,2014,8(8):852-858.
[17] Lees CW,Heys D,Ho GT,et al. A retrospective analysis of the efficacy and safety of in fliximab as rescue therapy in acute severe ulcerative colitis[J]. Aliment Pharmacol Ther,2007,26(3):411-419.
[18] Ananthakrishnan AN,McGinley EL,Binion DG,et al. Simple score to identify colectomy risk in ulcerative colitis hospitalizations[J]. Inflamm Bowel Dis,2010,16(9):1532-1540.
[19] Mir SA,Nagy-Szakal D,Smith EO,et al. Duration of disease may predict response to infliximab in pediatric ulcerative colitis [J]. J Clin Gastroenterol,2014,48(3):248-252.
[20] McIntyre PB,Powell-Tuck J,Wood SR,et al. Controlled trial of bowel rest in the treatment of severe colitis[J]. Gut,1986,27(5):481-485.
[21] Mantzaris GJ,Hatzis A,Kontogiannis P,et al. Controlled trial of intravenous metronidazole as an adjunct to corticosteroids in acute,severe ulcerative colitis[J]. Gut,1986,27(10):1210-1212.
[22] Wang S,Wang Z,Shi H,et al. Faecal calprotectin concentrations in gastrointestinal diseases [J]. J Int Med Res,2013,41 (4):1357-1361.
[23] Lennard-Jones JE,Ritchie JK,Hilder W,et al. Assessment of severity in colitis:a preliminary study[J]. Gut,1975,16(8):579-584.
[24] Roussomoustakaki M,Satsangi J,Welsh K,et al. Genetic markers may predict disease behavior in patients with ulcerative colitis[J].Gastroenterology,1997,112(6):1845-1853.
[25] Pagoldh M1,Lange S,Jennische E,et al. Faecal analysis and plasma complement factor 3c levels at admission for an acute attack of ulcerative colitis are predictive of the need for colectomy[J]. Eur J Gastroenterol Hepatol,2014,26(3):295-300.
