细胞外信号调节激酶1/2对糖尿病脑缺血再灌注大鼠海马区Bax表达的调控作用
2015-12-31李建民,周娜,赵雅宁等
细胞外信号调节激酶1/2对糖尿病脑缺血再灌注大鼠海马区Bax表达的调控作用
李建民周娜赵雅宁薛承景陈长香张盼李淑杏
(河北联合大学康复医学院神经研究所,河北唐山063000)
摘要〔〕目的探讨细胞外信号调节激酶1/2对糖尿病脑缺血再灌注大鼠海马区Bax表达的调控。方法采用链脲佐菌素诱导联合改良的Pulsineli 4血管阻断(4-VO)法制作糖尿病全脑缺血再灌注模型,并应用ERK1/2抑制剂U0126对糖尿病脑缺血再灌注大鼠预处理。分别在缺血1、6、24和48 h应用光镜观察海马区神经细胞形态变化;免疫组织化学法检测磷酸化ERK1/2和Bax表达水平。结果糖尿病脑缺血组各时间存活神经元密度显著低于血糖正常脑缺血组、磷酸化ERK1/2表达水平低于血糖正常脑缺血组、Bax表达水平高于血糖正常脑缺血组;应用U0126处理后,各时间点海马区神经元细胞存活密度降低、磷酸化ERK1/2表达降低、Bax表达增高。结论ERK1/2活化通过介导Bax表达参与并介导了糖尿病加重全脑缺血再灌注后神经细胞的丢失。
关键词〔〕细胞外信号调节激酶1/2;糖尿病;脑缺血再灌注;Bax;海马区
中图分类号〔〕R743.31〔文献标识码〕A〔
基金项目:河北省自然科学基金 (H2012401007);河北省卫生厅课题(20110527)
通讯作者:赵雅宁(1974-),女,副教授,博士,主要从事神经病学研究。
第一作者:李建民(1962-),男,教授,博士,主要从事神经病学研究。
研究表明高血糖能加重脑缺血所致的各种脑损伤,是脑缺血发病率和死亡率增高的重要的独立危险因素〔1,2〕, 糖尿病患者脑卒中发病率明显高于非糖尿病患者,且脑损害的严重程度、脑卒中死亡的可能性均增加,预后较差〔3〕。但糖尿病加重脑缺血损伤的机制尚未明确。细胞外信号调节激酶1/2 (ERK1/2)是有丝分裂原活化蛋白激酶(MAPKs)家族重要组成部分,活化后经多级激酶的级联反应把细胞外刺激信号向细胞内传递,至细胞核中,激活下游的激酶或多种转录因子从而介导细胞产生各种生物学反应,在细胞增殖、分化及凋亡等的过程中具有至关重要的作用。目前ERK1/2在脑损伤疾病的作用尚存在争议。本研究应用糖尿病联合脑缺血再灌注模型,观察实验大鼠海马区磷酸化ERK1/2和Bax表达变化以及神经细胞丢失情况,并应用ERK1/2通路抑制剂U0126进行处理,探讨ERK1/2在糖尿病加重脑缺血再灌注神经元损伤中的作用及对Bax的调控作用。
1材料和方法
1.1实验动物及试剂本实验共用健康雄性SD大鼠80只,由北京维通利华实验动物中心提供;多克隆磷酸化ERK1/2和Bax免疫组化试剂盒购自中杉生物有限公司(北京)。
1.2动物分组和处理80只雄性SD大鼠〔SCXK(京)2005-0013〕,体质量(185±19)g,随机分为假手术组(SO)和血糖正常全脑缺血再灌注组(NI/R)和糖尿病全脑缺血再灌注组(DCI)和DCI +ERK1/2抑制剂U0126干预组;每组又随机平均分为缺血再灌注1、6、24和48 h时间亚组。
1.3分别作如下处理SO组:分离暴露血管,但不电凝椎动脉、不夹闭颈总动脉;NI/R组:采用改良的Pulsineli 4血管阻断(4-VO)法〔4〕制作大鼠全脑缺血模型:动物常规麻醉,颈正中切口,分离双侧颈总动脉,在其下置线备用。枕后部正中切开,暴露双侧第1颈椎横突翼孔,直视下热凝其下通过的椎动脉,电凝每次时间约2~4 s,使翼小孔后双侧椎动脉永久闭塞。术后大鼠缝皮回笼,24 h后以无创性微动脉夹夹闭双侧颈总动脉,缺血30 min后松开动脉夹,实行再灌注。缺血及再灌注期间用红外线测温仪监测耳内鼓膜温度,并使之维持在(37±0.2)℃。DCI组:大鼠术前禁食12 h,按55 mg/kg腹腔注射链脲佐菌素(STZ),72 h后空腹血糖超过16.7 mmol/L,有多尿、体质量下降等表现的大鼠为糖尿病造模成功。然后按上述全脑缺血模型进行手术,制作糖尿病+全脑缺血再灌注模型。DCI+ERK1/2抑制剂U0126干预组:预先将U0126用二甲基亚砜溶解,于动物在制作形成糖尿病模型后再完成脑缺血再灌注模型前30 min经尾静脉注射(0.01 mg/kg)。
1.4病理组织学检测各组动物在规定时间点以戊巴比妥钠麻醉(40 mg/kg),用40 g/L多聚甲醛经左心室灌注固定后取脑,在视交叉后1~6 mm处冠状面切开,取中间块入4 %多聚甲醛固定液固定,石蜡包埋,切片(片厚5 μm),进行HE染色。在有测微尺的光学显微镜(200×)下观察海马区神经元形态变化并计数(200×)倍视野下的神经细胞数,即神经元密度(ND),取均值。
1.5磷酸化ERK1/2和Bax蛋白免疫组化切片常规脱蜡至水,枸橼酸盐微波修复,分别滴加磷酸化ERK1/2和Bax抗体(ERK1/2:1∶200;Bax:1∶150), 湿盒中4℃过夜,IgG抗体-HRP多聚体(PV 二步法),37℃温箱 30 min,DAB 显色,脱水、透明、封片。以 PBS代替一抗作阴性对照。镜下观察并摄片,阳性率的定量分析:每个标本取4张切片,200倍光镜下每张切片在海马随机选取4个视野,在有测微尺的光学显微镜(200×)下观察海马区阳性细胞变化并计数(200×)倍视野下的阳性细胞数量。
2结果
2.1形态学结果SO组海马区神经元排列紧密,神经元胞体较大,胞核大而圆,核仁清晰,胞质着色浅而均匀。NI/R 组海马区细胞轮廓模糊,排列紊乱,胞体收缩呈多角形或不规则,部分胞质自溶;各时间点存活神经元密度均明显减少(P<0.05);DCI 组中海马区神经元结构损伤加重,大部分胞质自溶,各时间点神经元细胞存活密度进一步降低(P<0.05);U0126组神经细胞结构损伤明显,存活神经细胞数量较DCI明显减少(P<0.05)。表1。
2.2磷酸化ERK1/2和Bax免疫组化结果磷酸化ERK1/2阳性表达主要位于细胞核,少量位于细胞质,阳性细胞的胞核或胞质内可见细小的棕黄色颗粒(图1)。SO组可见少量磷酸化ERK1/2阳性细胞,染色浅淡。与SO组比较,NI/R 组1 h和6 h时间点磷酸化ERK1/2阳性细胞增多,24 h和48 h迅速下降但显著高于SO(P<0.05);与NI/R组比较,DCI组各时间点磷酸化ERK1/2阳性细胞减少(P<0.05);U0126组各时间点磷酸化ERK1/2阳性细胞较DCI明显减少(P<0.05)。Bax:Bax阳性表达主要位于细胞质,阳性细胞的胞质可见细小的棕黄色颗粒(图2)。SO组偶见Bax阳性细胞,染色浅淡。与SO组比较,NI/R 组各时间点Bax阳性细胞均增多(P<0.05);与NI/R组比较,DCI组中1 h、6 h和24 h Bax阳性细胞增多,48 h下降但仍高于NI/R 组(P<0.05);U0126组Bax阳性细胞较DCI组明显减少(P<0.05),见表2。

组别1h6h24h48hSO组33.60±2.5131.80±1.4834.80±2.9532.20±3.77NI/R组30.22±2.281)26.00±1.231)24.80±2.171)18.20±1.481)DCI组26.90±2.301)2)20.26±2.001)2)18.78±2.061)2)16.60±1.701)2)U0126组24.12±2.101)2)3)18.60±1.141)2)3)16.80±1.201)2)3)14.10±1.081)2)3)
与SO组同一时间点比较:1)P<0.05;与NI/R组同一时间比较:2)P<0.05;与DCI组同一时间点比较:3)P<0.05,下表同
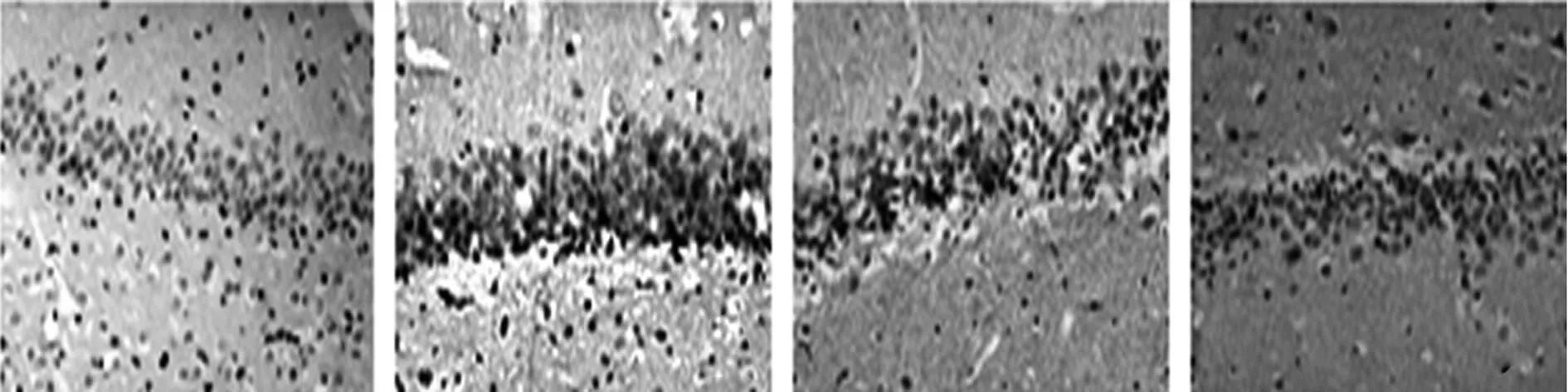
SO组 NI/R组 DCI组 U0126组 图1 各组24 h海马区磷酸化ERK1/2阳性 细胞变化免疫组织化学法(×200)
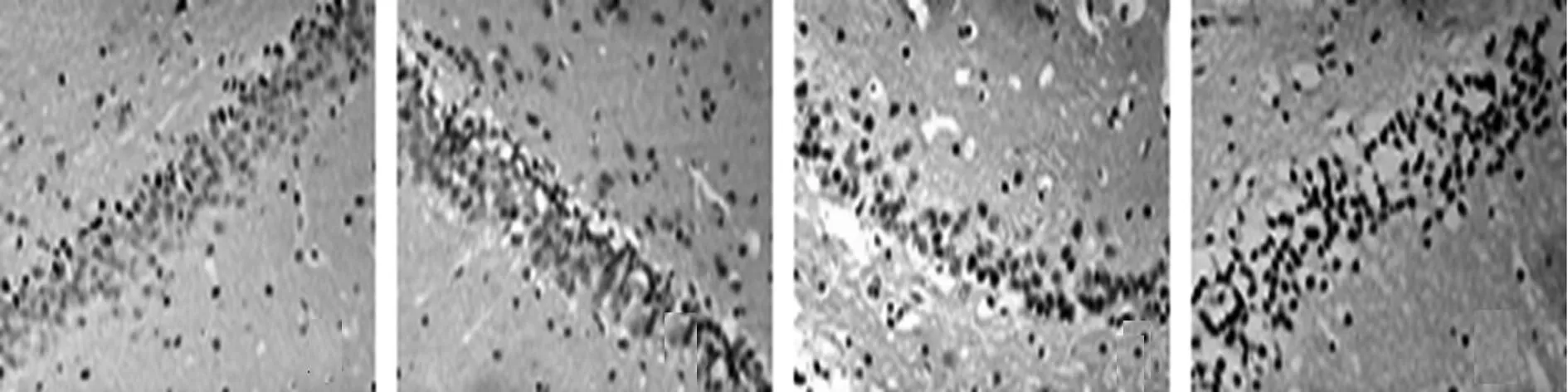
SO组 NI/R组 DCI组 U0126组 图2 各组24 h海马区Bax阳性细胞 变化免疫组织化学法(× 200)
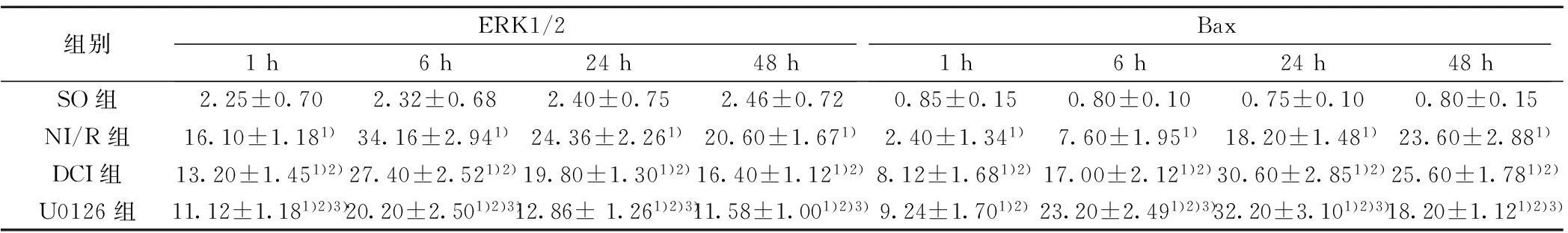
组别ERK1/21h6h24h48hBax1h6h24h48hSO组2.25±0.702.32±0.682.40±0.752.46±0.720.85±0.150.80±0.100.75±0.100.80±0.15NI/R组16.10±1.181)34.16±2.941)24.36±2.261)20.60±1.671)2.40±1.341)7.60±1.951)18.20±1.481)23.60±2.881)DCI组13.20±1.451)2)27.40±2.521)2)19.80±1.301)2)16.40±1.121)2)8.12±1.681)2)17.00±2.121)2)30.60±2.851)2)25.60±1.781)2)U0126组11.12±1.181)2)3)20.20±2.501)2)3)12.86±1.261)2)3)11.58±1.001)2)3)9.24±1.701)2)23.20±2.491)2)3)32.20±3.101)2)3)18.20±1.121)2)3)
3讨论
MAPKs信号通路是连接大多数细胞外信号与膜受体、转录因子和各基因调节的中央信号通路,其家族成员包括细胞外信号调节激酶(ERK1/2)、C-Jun氨基末端激酶(JNK)和p38 MAPK等。目前在多种中枢神经系统疾病中均证实存在 ERK1/2活性改变,但ERK1/2活化在脑损伤的作用尚存在一定争议〔5,6〕。马轶等〔7〕应用双血管阻塞联合放血法建立糖尿病大鼠全脑缺血模型,发现在糖尿病大鼠脑缺血1 h和3 h磷酸化ERK1/2显著高于正常血糖脑缺血组,表明ERK1/2活性增高介导了糖尿病加重的脑缺血再灌注神经元的损伤。本研究结果提示糖尿病加重缺血神经细胞损伤与ERK1/2活性下降有关,进一步应用抑制剂U0126阻断糖尿病大鼠脑缺血后ERK1/2通路活化,海马区存活神经元数量降低明显,视野内几乎大多是坏死的神经细胞,更有力的说明糖尿病脑缺血再灌注后ERK1/2的活化对神经细胞具有保护作用。研究显示〔8〕激活的ERK1/2可转录上调脑缺血缺氧模型中抗氧化系统的保护因子而促进神经元的存活;有学者认为活化的 Ras/ERK1/2级联是神经元耐受脑缺血应激反应的核心〔9〕。笔者认为糖尿病合并脑缺血情况下,ERK1/2活性下降,使神经细胞耐受缺血缺氧能力下降,细胞死亡严重,是糖尿病鼠脑缺血后神经损伤加重的原因之一。
正常情况下,Bax蛋白含量极低,且Bax蛋白以非活性形式分布于细胞质或细胞骨架上,当受到凋亡刺激因素作用后构象发生改变,转位至线粒体外膜,促进膜上电压依赖离子通道开放、触发凋亡蛋白释放执行凋亡程序。实验表明在糖尿病脑病以及糖尿病脑缺血再灌注损伤中Bax表达增多,且表达在濒死的神经元上。抑制或降低糖尿病鼠脑内Bax表达,可显著减轻由于高血糖加重的脑缺血神经细胞的损伤〔10,11〕。本研究中DCI组Bax表达增多,采用ERK1/2通路抑制剂预处理DCI再灌注动物,发现阻断ERK1/2通路时Bax表达进一步升高,提示糖尿病加重脑缺血再灌注神经损伤过程中,ERK1/2活化可调控Bax表达,ERK1/2活性降低介导了Bax表达增加,而导致神经细胞丢失严重。目前虽然尚无有关ERK1/2磷酸化直接调控Bax表达的相关报道,但研究显示ERK1/2磷酸化可介导激活转录因子cAMP反应元件结合蛋白(CREB)以及CREB介导的bcl-2家族抗凋亡成员bcl-2表达增加〔9,12〕。
总之,本研究发现糖尿病加重了全脑缺血再灌注后神经细胞损伤,此过程中ERK1/2活性降低调控Bax表达增强,而导致神经细胞丢失严重。
4参考文献
1陈阳,帅杰.血糖与脑缺血〔J〕 .国外医学·脑血管疾病分册, 2002;10(3):217-9.
2Kagansky N,Levy S,Knor H.The role of hyperglycemia in acute stroke 〔J〕 .Arch Neurol,2001;58(8):1209-14.
3Liqun Z,Aji N, Kyle K,etal.Estrogen stimulates microglia and brain recovery from hypoxia-ischemia in normoglycemic but not diabetic female mice〔J〕.Clin Invest,2004;113(1):85-95.
4Kirino T,Tamura A,Sano K.A reversible type of neuronal injury following ischemia in the gerbil hippocampus〔J〕.Stroke,1986;17(5):455-6.
5郭玫,聂莹雪.ERK1/2通路在缺血预处理大鼠大脑皮质的表达和作用〔J〕.中风与神经疾病杂志,2011;12(28):1082-4.
6赵雅宁,高俊玲,崔建忠.依达拉奉对大鼠重型弥漫性脑创伤后细胞外信号调节激酶1/2信号通路的影响〔J〕.中国危重病急救医学,2010;22(4):230-4.
7马轶,景丽,郭凤英.磷酸化ERK1/2在糖尿病大鼠脑缺血再灌注损伤中的表达意义〔J〕.第四军医大学学报,2009;30(19):1872-5.
8Jin K,Mao XO,Zhu Y,etal.MEK and ERK protect hypoxic cortical neurons via phosphorylation of Bad〔J〕.Neurochem,2002;80:119-25.
9Biswas SC,Greene LA.Nerve growth factor(NGF)down-regulates the Bcl-2 homology3(BH3)domain-only protein Bim and suppresses its pro-apoptotic activity by phosphorylation〔J〕.Biol Chem,2002;277(5):49511-6.
10葛钢锋,张跃明,沈亚俐,等.补肾通窍方对糖尿病大鼠丘脑前背侧核神经元Bax与Bcl-2表达的影响〔J〕.浙江中医药大学学报,2012;36(6):701-6.
11郭蕾蕾,张宏,田国庆,等.中药筋脉通对高糖培养海马神经元细胞Bax、Bcl-2和Caspase-3蛋白表达的影响〔J〕.中国康复理论与实践,2012;18(4):324-9.
12Shibata M,Hattori H,Sasaki T,etal.Temporal profiles of the subcellular localization of Bim,a BH3-only protein,during middle cerebral artery occlusion in mice〔J〕.Cereb Blood Flow,2002;22(7):810-20.
〔2013-12-09修回〕
(编辑赵慧玲/曹梦园)
