柔嫩艾美耳球虫沉默信息调节因子2真核表达质粒的构建及在细胞中的表达
2015-12-31杨斯涵赵其平韩红玉朱顺海梁思婷杨亮宇
杨斯涵,赵其平,韩红玉,朱顺海,李 莎,翟 颀,梁思婷,杨亮宇,黄 兵,董 辉
(1.云南农业大学动物科学技术学院,昆明 650201;2.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241)
·研究论文·
柔嫩艾美耳球虫沉默信息调节因子2真核表达质粒的构建及在细胞中的表达
杨斯涵1,2,赵其平2,韩红玉2,朱顺海2,李 莎2,翟 颀2,梁思婷2,杨亮宇1,黄 兵2,董 辉2
(1.云南农业大学动物科学技术学院,昆明 650201;2.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241)
为构建柔嫩艾美耳球虫沉默信息调节因子2(Eimeria tenella silent information regulator 2,EtSIR2)的真核表达质粒,以柔嫩艾美耳球虫第二代裂殖子cDNA为模板,PCR扩增出EtSIR2基因,PCR产物经酶切回收纯化目的片段后与经相应酶切的真核表达载体pCAGGs连接。连接产物经PCR和酶切鉴定,再经测序鉴定正确后,分别转染DF-1细胞和BHK细胞进行表达,用Western blot 和间接免疫荧光鉴定EtSIR2基因的表达情况。结果表明:成功扩增了EtSIR2基因,长度为909 bp;Western blot可见大小约为37 kDa的表达蛋白条带;间接免疫荧光可以检测到特异性绿色荧光,表明成功构建了EtSIR2的真核表达质粒pCAGGs-EtSIR2,并能在哺乳动物细胞和禽类细胞中表达。该研究结果为深入研究EtSIR2的生物学特性和球虫DNA疫苗的研制打下了基础。
柔嫩艾美耳球虫;沉默信息调节因子2;DF-1细胞;BHK细胞;真核表达
鸡球虫病是一种全球性原虫病,其中集约化养鸡场是球虫爆发的主要场所,每年给全世界养殖业造成的直接经济损失高达5亿英镑,美国农业部将该病列为对禽类危害最严重的五大疾病之一[1]。目前,鸡球虫病的防治主要以抗球虫药物为主,但随着药物的不断使用,鸡球虫抗药性日益严重[2],兽药残留等引起的食品安全问题日益受到人们的重视,所以迫切需要更为理想的防治球虫病方法。实践表明,疫苗免疫预防鸡球虫病可获得良好的效果,成为鸡球虫病防治的趋势[3,4],其中,核酸疫苗作为第三代疫苗,具有安全、稳定、高效、使用方便等特点,逐渐成为人们研究的热点[5]。
沉默信息调节因子2 (silent information regulator 2, SIR2) 首先在酵母中被发现[6],是一类具有依赖烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)去乙酰化酶活性的组蛋白去乙酰化酶,存在于从古生菌到高等真核生物的多种生物细胞中,在染色质沉默、基因调控、代谢调节、调节细胞寿命等一系列细胞生物活动过程中起重要作用[7,8]。SIR2基因已在疟原虫(Plasmodium)[9]、锥虫(Trypanoma)[10]、刚地弓形虫(Toxoplasma gondii)[7]、犬新孢子虫(Neospora caninum)[7]、利什曼原虫(Leishmania)[11]、蓝氏贾第鞭毛虫(Giardia lamblia)[12]等寄生虫相继报道,并发现其在寄生虫的抗原变异、端粒沉默和DNA修复等生理过程中发挥重要作用[7]。
鄢远会等[13]首次对柔嫩艾美耳球虫沉默信息调节因子2(Eimeria tenella SIR2,EtSIR2)基因初步特性进行了研究,发现其氨基酸序列与鸡的同源性仅为25%,提示其蛋白质特性与宿主的明显不同,可作为药物靶标。本研究旨在构建EtSIR2的pCAGGs真核表达质粒,通过Western blot和间接免疫荧光(indirect immunofluorescence assay,IFA)鉴定真核质粒是否在DF-1细胞和BHK细胞中成功表达,为进一步研究EtSIR2的生物学特性和研制球虫DNA疫苗奠定基础。
1 材料与方法
1.1 材料柔嫩艾美耳球虫第二代裂殖子cDNA、兔源性抗rEtSIR2多抗、DF-1细胞和BHK细胞由本课题组制备保存;真核表达载体pCAGGs由中国农业科学院上海兽医研究所禽病研究室李泽君老师馈赠;2×Taq PCR Master Mix、DNA Marker DL2000、DNA胶回收试剂盒、质粒提取试剂盒、TOP10感受态细胞购自天根生化科技(北京)有限公司;pGEM-T-easy vector、T4 DNA连接酶购自Promega公司;限制性内切酶EcoRⅠ和XhoⅠ购自大连宝生物工程有限公司;Lipofectamine 2000购自Invitrogen公司;胎牛血清、DMEM、Opti-MEM购自Gibco公司;Western和IP细胞裂解液购自上海碧云天生物技术有限公司;近红外荧光羊抗兔二抗购自LICOR公司;绿色荧光标记山羊抗兔二抗购自Jackson Immuno Research公司。
1.2 EtSIR2基因的克隆根据http∶//www.genedb.org/Homepage/Etenella中EtSIR2基因(登录号:ETH 00033350)序列设计引物,扩增该基因完整的ORF序列,预计长度为909 bp。引物由上海赛百盛生物技术有限公司合成,其中上游引物序列为5'-GCGAATTCATGGGCCAGTGGT TAACAT-3',下游引物序列为5'-GCCTCGAG TCATTCATTTTCCCCTGGG-3',上下游引物分别引入EcoRⅠ和XhoⅠ酶切位点(标有下划线的碱基)。以柔嫩艾美耳球虫第二代裂殖子cDNA为模板进行常规PCR扩增,反应体系为20 μL。反应参数:95℃预变性3 min;95℃变性30 s,50℃退火30 s,72℃延伸1 min,共进行35个循环;72℃延伸10 min。用1.0%琼脂糖凝胶电泳检测PCR产物,切胶回收目的片段。
1.3 真核表达质粒的构建将EtSIR2的PCR产物和pCAGGs表达载体质粒分别经EcoRⅠ和XhoⅠ双酶切后,用琼脂糖凝胶电泳回收试剂盒回收目的片段,16℃连接过夜。连接反应液转入大肠杆菌TOP10感受态细胞中,涂板培养过夜,挑取单菌落于4 mL LB培养基中培养12 h后,进行PCR鉴定。对鉴定为阳性的菌液提取质粒,用EcoRⅠ和XhoⅠ内切酶进行双酶切鉴定,阳性克隆送至上海桑尼公司进行测序。
1.4 DF-1细胞和BHK细胞的复苏培养冻存的DF-1细胞和BHK细胞经复苏后,用含10%胎牛血清的DMEM培养,传代2代,至细胞生长状态良好。转染前,收集DF-1细胞和BHK细胞进行细胞计数,以每孔6×105个细胞铺被6孔板2块,37℃、5% CO2培养过夜,按照Lipofectamine 2000脂质体转染操作步骤,将重组质粒pCAGGs-EtSIR2分别转染DF-1细胞和BHK细胞,并设pCAGGs空载体以及正常DF-1细胞和BHK细胞对照组,用无血清的Opti-MEM培养基,置于37℃、5% CO2培养6 h后,更换为含2%胎牛血清的DMEM培养基,培养48 h后,取一块6孔板进行间接免疫荧光检测,收集另一块6孔板的细胞用于Western blot检测。
1.5 Western blot鉴定真核表达质粒在DF-1细胞和BHK细胞中表达情况收集步骤1.4中培养48 h的DF-1细胞和BHK细胞,加入Western及IP细胞裂解液200 μL,15 294×g 离心5 min,取上清进行SDSPAGE电泳。半干法电转移至PVDF膜上,5%脱脂奶粉4℃封闭过夜;PBST洗涤3次,加入1∶100稀释的抗rEtSIR2蛋白兔血清,室温孵育2 h;PBST洗涤3次,加入1∶10 000稀释的近红外荧光羊抗兔二抗,室温孵育2 h, PBS洗涤8次,用Odyssey双色红外激光成像系统进行拍照。
1.6 IFA鉴定真核表达质粒在DF-1细胞和BHK细胞中表达情况取步骤1.4中培养48 h的DF-1细胞和BHK细胞,弃去细胞培养液,自然风干后,PBS洗涤2次;每孔加2 mL 2%多聚甲醛固定15 min,PBS洗涤3次,每孔再加入1% TritonX-100 2 mL,室温下作用15 min,PBS洗3次;每孔加入2% BSA-PBS 2 mL,4℃封闭过夜,PBS洗涤3次;加入抗rEtSIR2蛋白兔血清(1∶100倍稀释),37℃作用1 h,PBS洗涤3次,PBS浸泡30 min;加入1∶400稀释的绿色荧光标记的山羊抗兔二抗,37℃作用1h,PBS洗涤3次,PBS浸泡30 min,在盖玻片上滴适量荧光猝灭剂,正置荧光显微镜下观察,拍照保存。
2 结果
2.1 EtSIR2基因的克隆以柔嫩艾美耳球虫第二代裂殖子cDNA为模板,用所设计合成的特异性引物扩增出1条大约1000 bp的目的条带,其大小与预期目的条带909 bp一致(图1)。
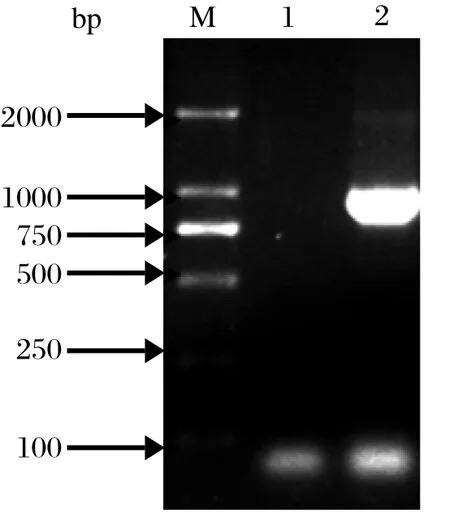
图1 EtSIR2 的PCR 扩增结果Fig.1 The result of PCR amplifi cation of EtSIR2 gene
2.2 真核表达质粒的构建与鉴定
2.2.1 pCAGGs-EtSIR2质粒的构建与鉴定 用限制性内切酶EcoRⅠ和XhoⅠ分别对EtSIR2的PCR产物和空载体pCAGGs进行双酶切,纯化后进行连接,对连接产物转化菌进行PCR和双酶切鉴定,结果均为阳性(图2、3),测序结果显示该基因正向插入,无移码突变(图略),表明pCAGGs-EtSIR2重组质粒构建成功。
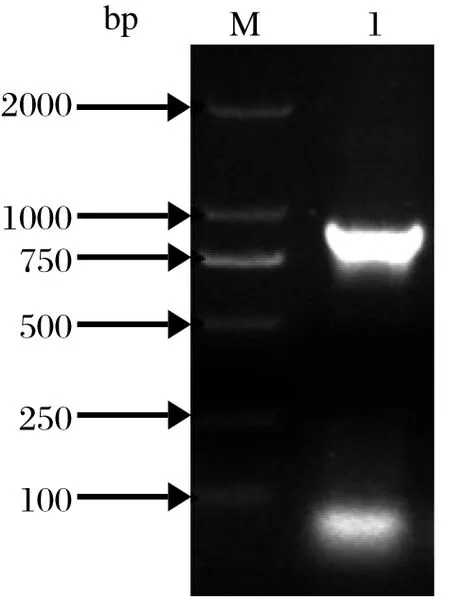
图2 重组质粒pCAGGs-EtSIR2 的PCR鉴定结果Fig.2 Identifi cation of recombinant plasmid pCAGGs-EtSIR2 by PCR

图3 重组质粒pCAGGs-EtSIR2 的双酶切鉴定结果Fig.3 Identifi cation of recombinant plasmid pCAGGs-EtSIR2 by enzyme digestion analysis
2.2.2 Western blot分析pCAGGs-EtSIR2在DF-1细胞和BHK细胞中的表达 结果显示,在pCAGGs-EtSIR2重组质粒转染的DF-1细胞和BHK细胞中均可检测到大小约为37 kDa的目的条带,而转染空载体的DF-1细胞和BHK细胞中均没有相应的条带出现(图4)。
2.2.3 间接免疫荧光检测pCAGGs-EtSIR2在DF-1细胞和BHK细胞中的表达 利用抗rEtSIR2蛋白的兔血清,分别对pCAGGs-EtSIR2重组质粒转染48 h后的DF-1细胞和BHK细胞进行了免疫荧光检测。结果显示,在pCAGGs-EtSIR2重组质粒转染的DF-1细胞和BHK细胞中,均可看到特异性的绿色荧光;而在转染了pCAGGs空载体的DF-1细胞和BHK细胞中,无绿色荧光(图5)。
3 讨论
核酸疫苗作为一种新型疫苗,成为近年来研究的热点。与传统的疫苗相比,核酸疫苗具有免疫效果好、安全性高、免疫应答持久、易于研制生产等优点[14]。影响核酸疫苗效果的因素包括适宜抗原、载体类型及免疫佐剂等[15]。
鸡球虫核酸疫苗的研制始于20世纪80年代末,至今已经筛选到了许多具有免疫保护性的球虫抗原,构建了一批基因重组疫苗。用于核酸疫苗研制的球虫抗原主要集中在与入侵相关的细胞器抗原(如微线蛋白MIC2、折光体蛋白SO7)、入侵宿主细胞阶段(包括子孢子和裂殖子)的表面抗原(如TA4、3-1E、cSZ-1)和配子体抗原(如GAM230、GAM82、GAM56),其保护效果已经被大量的研究所证实,但更多的抗原仍有待发现和研究[16]。

图4 真核表达质粒转染DF-1细胞和BHK细胞的Western blot鉴定结果Fig.4 Identifi cation of EtSIR2 protein in DF-1 and BHK cells transfected with eukaryotic recombinant plasmid by Western blot
本文所选用的抗原分子SIR2,能够改变染色质结构从而导致染色质沉默,而染色质沉默又是基因表达调控的重要方式[7]。SIR2在基因表达调控和调节细胞寿命等生命活动中发挥着重要的调节作用,近年来被作为抗病原微生物药物靶标成为了研究的热点[13]。目前已在疟原虫、贾第虫、锥虫等寄生虫发现了SIR2的同源蛋白,并发现它们在寄生虫的基因表达调控中发挥着重要作用[17,18]。疟原虫SIR2能直接作用于变异抗原var的启动子区域,与起始识别复合物1(origin recognition complex 1 protein,ORC1)共同介导端粒区沉默[19],影响var编码的毒力因子的表达[20,21],是疟原虫重要的毒力因子,并与表面抗原变异相关[22]。利什曼原虫SIR2基因与虫体的毒力相关,是虫体生存的必需基因[23,24],并可以诱导小鼠B细胞的增殖,产生特定抗体,在免疫反应中发挥重要作用[11]。锥虫SIR2的同源蛋白参与端粒沉默,但并不是其表面抗原变异所必须的[25]。在贾第鞭毛虫(Giardia lamblia)也发现了包括SIR2在内的多种组蛋白去乙酰化酶(histone deacetylases,HDACs)[12],使用HDACs抑制剂后,贾第鞭毛虫体内组蛋白的乙酰化水平增加;在成囊过程中使用HDACs抑制剂FR235222后,囊壁蛋白(cyst wall protein)的表达降低,影响包囊的形成。柔嫩艾美耳球虫SIR2氨基酸序列与疟原虫、弓形虫、新孢子虫等低等生物具有较高的相似性(42%~58%),说明寄生性原虫拥有保守的SIR2序列,而与高等生物人和鸡的氨基酸序列相似性仅有24%~25%,说明EtSIR2在蛋白结构上与其宿主具有明显差异,提示可作为抗寄生虫药物研究的重要靶标,已发现尼克酰胺(nicotinamide,NAM)能够抑制EtSIR2的活性[13]。
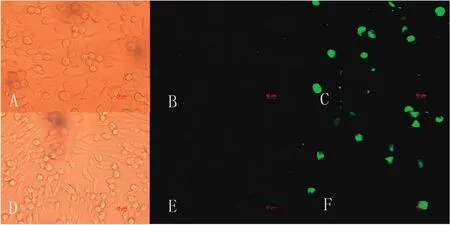
图5 真核表达质粒转染DF-1细胞和BHK细胞IFA检测结果Fig.5 Detection of EtSIR2 protein in DF-1 cells and BHK cells transfected with eukaryotic recombinant plasmid by IFA
质粒载体是核酸疫苗的主体,表达抗原蛋白的能力越强,有效激发免疫应答就越强。与原核表达系统相比,真核表达载体系统所表达的外源蛋白具有天然蛋白的生物活性,更能发挥其生物学功能。在球虫核酸疫苗研究中常用的真核表达质粒包括pcDNA3.1[26]、pVAX1[27,28]、pMPl3[29]。本研究所用的pCAGGs 载体含有鸡β-actin 启动子与CMV 增强子序列构成的杂合启动子,在基因的表达方面具有优势[30],已应用于H5亚型禽流感[31]、新城疫病毒[32]、H1亚型猪流感[33]、鸭坦布苏病毒[34]等动物疾病的核酸疫苗研制中。采用该载体,本实验室已成功构建了柔嫩艾美耳球虫棒状体颈部蛋白2(rhoptry neck protein 2,RON2)、钙依赖蛋白激酶 3(calcium-dependent protein kinases 3,CDPK3)、顶体膜蛋白1(apical membrane antigen,EtAMA1)、乳酸脱氢酶(Lactate dehydrogenase,LDH)等基因的真核表达质粒,动物免疫保护性试验结果表明,所构建的核酸疫苗对免疫鸡可产生较好的免疫保护性[35]。
所构建的抗原基因真核表达质粒能在细胞内成功表达是核酸疫苗成功的关键。本研究利用IFA和Western blot检测了所构建的pCAGGs-EtSIR2真核表达质粒在哺乳动物细胞(BHK细胞)和禽类细胞(DF-1细胞)情况,结果显示,所构建的真核表达质粒均可在这两种细胞内成功表达,表明真核表达质粒pCAGGs-EtSIR2构建成功,为进一步研究该蛋白的生物学功能和研制球虫DNA疫苗奠定了基础。
[1] Shirley M W, Smith A L, Blake D R.Challenges in the successful control of the avian coccidia[J].Vaccine, 2007, 25(30)∶ 5540-5547.
[2] Martin A, Danforth H, Barta J, et al.Analysis of immunological cross-protection and sensitivities to anticoccidial drugs among five geographical and temporal strains of Eimeria maxima[J].Int J Parasitol, 1997, 27(5)∶527-533.
[3] 安健, 刘月繁, 汪明.肉鸡球虫病和球虫抗药性的调查[J].中国兽医杂志, 2004, 40(60)∶ 29-31.
[4] 李玉剑, 岳城, 董辉, 等.鸡球虫病活疫苗的研究进展[J].中国动物传染病学报, 2009, 17(1)∶ 75-80.
[5] 陆承平.兽医微生物学[M].北京∶ 中国农业出版社, 2001∶ 193.
[6] Cubizolles F, Martino F, Perrod S, et al.A homotrimerheterotrimer switch in SIR2 structure differentiates rDNA and telomeric silencing[J].Mol Cell, 2006, 21(6)∶ 825-36.
[7] Agnieszka A, Andrew P.Sirtuin of parasitic protozoa∶In search of function(s) [J].Mol Biochem Parasit, 2012, 185(2)∶ 71-88.
[8] Landry J, Sutton A, Tafrov S T, et al.The silencing protein SIR2 and its homologs are NAD-dependent protein deacetylases[J].Pro Natl Acad Sci, 2000, 97(11)∶5807-5811.
[9] Freitas-Junior L H, Hernandez-Rivas R, Ralph S A.Telomeric heterochromatin propagation and histone acetylation control mutually exclusive expression of antigenic variation genes in malaria parasites[J].Cell,2005, 121(1)∶ 25-36.
[10] Garcia-Salcedo J A, Gijon P, Nolan D P, et al.A chromosomal SIR2 homologue with both histone NAD-dependent ADP-ribosyltransferase and deacetylase activities is involved in DNA repair in Trypanosoma brucei[J].EMBO J, 2003, 22(21)∶ 5851-62.
[11] Silvestre R, Cordeiro-da-Silva A, Tavares J, et al.Leishmania cytosolic silent information regulatory protein 2 deacetylase induces murine B-cell differentiation and in vivo production of specific antibodies[J].Immunology, 2006, 119(4)∶ 529-40.
[12] Sonda S, Morf L, Bottova I, et al.Epigenetic mechanisms regulate stage differentiation in the minimized protozoan Giardia lamblia[J].Mol Microbiol, 2010, 76(1)∶ 48-67.
[13] 鄢远会.柔嫩艾美耳球虫沉默信息调节因子2(EtSir2)功能的初步研究[D].昆明∶ 云南农业大学, 2013.
[14] Watine G J, Mcmanus D P.Nucleic acids vaccines of the future[J].Parasitol Today, 1995, 11(3)∶ 113-116.
[15] 王晔.柔嫩艾美耳球虫4种基因的真核重组质粒构建与EtAMA1核酸疫苗的保护效果初步评价[D].北京∶ 中国农业科学院, 2013.
[16] Kitandu A, Juranova R.Progress in control measures for chicken coccidiosis [J].Acta Veterinaria Brno, 2006, 75∶265-276.
[17] Merrick C J, Duraisingh M T.Plasmodium falciparum Sir2∶ an unusual sirtuin with dual histone deacetylase and ADP-ribosyltransferase activity[J].Eukaryot Cell, 2007, 6(11)∶ 2081-2091.
[18] Tavares J, Ouaissi A, Santaréant N, et al.The Leishmania infantum cytosolic SIR2-related protein 1(LiSIR2RP1) is an NAD+dependent deacetylase and ADP-ribosyltransferase[J].Biochem J, 2008, 415(3)∶ 377-386.
[19] Mancio-Silva L, Rojas-Meza AP, Vargas M, et al.Differential association of Orc1 and Sir2 proteins to telomeric domains in Plasmodium falciparum[J].J Cell Sci, 2008, 121(12)∶ 2046-2053.
[20] 方小楠.恶性疟原虫 var 基因家族与抗原变异研究进展[J].中国寄生虫学与寄生虫病杂志, 2010, 28(2)∶ 153-156.
[21] Merrick C J, Dzikowski R, Imamura H, et al.The effect of Plasmodium falciparum Sir2a histone deacetylase on clonal and longitudinal variation in expression of the var family of virulence genes[J].Int J Parasitol, 2010, 40(1)∶35-43.
[22] Tonkin C J, CarrEt C K, Duraisingh M T, et al.Sir2 paralogues cooperate to regulate virulence genes and antigenic variation in Plasmodium falciparum[J].PLoS Biol, 2009, 7(4)∶ e84.
[23] Vergnes B, Sereno D, Madjidian-Sereno N, et al.Cytoplasmic SIR2 homologue overexpression promotes survival of Leishmania parasites by preventing programmed cell death[J].Gene, 2002, 296(1-2)∶ 139-50.
[24] Vergnes B, Sereno D, Tavares J, et al.Targeted disruption of cytosolic SIR2 deacetylase discloses its essential role in Leishmania survival and proliferation[J].Gene, 2005, 363∶ 85-96.
[25] Alsford S, Kawahara T, Isamah C, et al.A sirtuin in the African trypanosome is involved in both DNA repair and telomeric gene silencing but is not required for antigenic variatio[J].Mol Microbiol, 2007, 63(3)∶ 24-736.
[26] 吴绍强, 蒋金书, 刘群.柔嫩艾美球虫BJ株核酸疫苗的构建及免疫保护效果研究[J].中国兽医杂志, 2004, 40(9)∶3-6.
[27] 张步彩.鸡柔嫩艾美耳球虫(E.tenella)DNA疫苗pEtK2-IL-2免疫程序、交叉免疫及稳定性研究[D].南京∶ 南京农业大学, 2006.
[28] 周婷婷.五种鸡堆型艾美耳球虫DNA疫苗免疫保护效果比较[D].南京∶ 南京农业大学, 2008.
[29] Song K D, Lillehoj H S.A DNA vaccine encoding a conserved Eimeria protective immunity against live Eimeria acervulina challenge [J].Vaccine, 2000, 19(2-3)∶243-250.
[30] 张树梅, 黄海碧, 滕巧泱, 等.表达3个外源基因真核表达载体的构建[J].中国预防兽医学报, 2011, 33(4)∶ 281-284.
[31] 姜永萍, 张洪波, 步志高, 等.表达载体pCAGGS显著增强禽流感DNA疫苗的免疫保护效果[J].中国农业科学, 2006, 39(4)∶ 825-830.
[32] 白志坤.鸡新城疫病毒F、HN基因的真核表达及免疫效力研究[D].哈尔滨∶ 东北农业大学, 2006.
[33] 杨馥如, 于海, 王斌, 等.H1亚型猪流感病毒HA基因密码子优化的DNA疫苗免疫保护效力研究[J].中国动物传染病学报, 2011, 19(4)∶ 13-19.
[34] 徐大伟, 李国新, 李雪松, 等.鸭坦布苏病毒E基因DNA疫苗构建及免疫原性的初步研究[J].中国预防兽医学报, 2012, 34(4)∶ 305-308.
[35] 王艳歌, 董辉, 韩红玉, 等.柔嫩艾美耳球虫乳酸脱氢酶真核表达质粒的构建与鉴定[J].中国动物传染病学报, 2014, 22(2)∶ 65-71
CONSTRUCTION AND EXPRESSION OF EUKARYOTIC EXPRESSION PLASMID CONTAINING SILENT INFORMATION REGULATOR 2 GENE OF EIMERIA TENELLA
YANG Si-han1,2, ZHAO Qi-ping2, HAN Hong-yu2, ZHU Shun-hai2, LI Sha2, ZHAI Qi2, LIANG Si-ting2, YANG Liang-yu1, HUANG Bing2, DONG Hui2
(1.College of Animal Science and Technology, Yunnan Agricultural University, Kunming 650201, China; 2.Key Laboratory of Animal Parasitology, Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
The full-length cDNA of silent information regulator 2 of Eimeria tenella (EtSIR2) was amplifi ed in PCR from the cDNA of the second-generation merozoites in order to construct the eukaryotic expression plasmid.The PCR products and pCAGGs vectors were digested with the same restriction enzymes and ligated.The recombinant EtSIR2 plasmid was confi rmed through PCR, enzyme digestion and sequencing and then transfected into DF-1 cells and BHK cells, respectively.The expression of recombinant EtSIR2 in the transfected cells was examined in indirect immunofl uorescence assay (IFA) and Western blot.The results showed that the EtSIR2 gene was 909 bp in length.Western blot also indicated that the antiserum to recombinant EtSIR2 strongly recognized a protein with molecular mass at 37 kDa in the transfected cells.Specifi c green fl uorescence was observed in IFA.Construction and eukaryotic expression of EtSIR2 has laid the foundation for future research on biological functions and DNA vaccine.
Eimeria tenella; silent information regulator 2; DF-1 cell; BHK cell; eukaryotic expression
S852.723
A
1674-6422(2015)02-0053-07
2014-12-02
国家自然科学基金(31272557)
杨斯涵,女,硕士研究生,临床兽医学专业
董辉,E-mail∶ donghui@shvri.ac.cn;杨亮宇,E-mail∶ yangliangyu2004@163.com
