鸭甲肝病毒VP1蛋白主要抗原域的原核表达及间接ELISA方法的初步建立
2015-12-31李传峰邓明俊岳志芹
孙 涛,李传峰,徐 彪,邓明俊,岳志芹
(1.山东出入境检验检疫局,青岛 266002;2.中国农业科学院上海兽医研究所,上海 200241)
·研究论文·
鸭甲肝病毒VP1蛋白主要抗原域的原核表达及间接ELISA方法的初步建立
孙 涛1,李传峰2,徐 彪1,邓明俊1,岳志芹1
(1.山东出入境检验检疫局,青岛 266002;2.中国农业科学院上海兽医研究所,上海 200241)
根据已发表的鸭甲肝病毒(Duck hepatitis A virus,DHAV)疫苗株 A66株基因组序列,利用生物学分析软件DNAStar进行VP1蛋白的二级结构和抗原域预测,确定其主要抗原域(major antigen domain of VP1, VP1M),设计并合成一对可扩增VP1M的特异性引物,PCR扩增获得长为327 bp的VP1M基因片段。将VP1M基因片段定向克隆至pGEX-4T-1表达载体中,鉴定正确后进行IPTG诱导表达,获得了以包涵体为主的重组蛋白。重组蛋白纯化后,经过Western blot检测表明重组蛋白具有良好的抗原性。以该蛋白作为包被抗原,成功建立了检测DHAV-1的间接ELISA方法。该方法具有良好的特异性、敏感性和重复性,为DHAV的快速诊断、流行病学调查和免疫鸭群的抗体检测提供了快速实用的检测手段。
鸭甲肝病毒;VP1;抗原域;间接ELISA
鸭病毒性肝炎(duck viral hepatitis,DVH)是由鸭甲肝病毒(Duck hepatitis A virus,DHAV)和/或鸭星状病毒(Duck astrovirus,DAstV)引起的一种传播迅速和高度致死性雏鸭传染病。该病以肝脏肿大和出血为主要病理特征,主要侵害3周龄以内的雏鸭,1周龄以内雏鸭致死率高达90%以上,严重制约了现代化养鸭产业的健康发展。DVH最早于1945年发现于美国,随后在许多国家相继报道,呈世界性分布。国内,黄均建于1963年首次报道了DVH的发生和流行。为防止境外DVH传入中国,农业部和国家质量监督检验检疫总局把该病列入了最新版《中华人民共和国进境动物检疫疫病名录》(联合公告第2013号)。
与DAstV比较而言,DHAV是DVH的主要病原,相关的研究资料也更为详实。DHAV主要包括血清1、2和3型,分别对应DHAV三个不同基因型:A、B和C型[1,2]。血清1型DHAV,也即传统的血清I型鸭肝炎病毒,在中国乃至世界仍为最主要的流行血清型。血清1型DHAV基因组仅包含1个6750 bp的开放阅读框(open reading frame,ORF),编码一条2249 aa的多聚蛋白前体,并最终经过蛋白酶水解加工形成3个结构蛋白(VP0、VP3、VP1)和9个非结构蛋白(2A1、2A2、2A3、2B、2C、3A、3B、3C、3D)。其中,VP1基因全长714 bp,编码238个aa的多肽。在小RNA病毒中,VP1蛋白是主要的宿主保护蛋白,包含了主要的抗原位点并具有主要的型特异性中和位点,能诱导机体产生保护性的中和抗体[3]。因此,VP1蛋白成为近年来的研究热点。文献资料显示,完整的VP1蛋白在大肠杆菌表达量普遍偏低,有的毒株甚至不表达。表达菌筛选、表达条件的优化以及密码子改造等在提高目的蛋白的表达量上具有一定的作用[4]。此外,大量研究证明通过选取蛋白主要抗原域进行原核表达,蛋白表达量会显著提高,抗原性保留较好而成本明显降低[5-7]。
本研究通过软件预测了DHAV疫苗株 A66株VP1蛋白的主要抗原域,并利用原核表达系统进行了高效表达。在此基础上初步建立了检测血清1型DHAV抗体的间接ELISA方法,为进一步研制DHAV-VP1抗体诊断试剂盒奠定了基础。
1 材料与方法
1.1 毒株、细胞和载体DHAV疫苗株 (A66株)由山东出入境检验检疫局食品农产品检测技术中心禽病实验室增殖和保存;Trans DH5α感受态细胞、BL21(DE3)感受态细胞购自北京全式金生物技术有限公司;pGEX-4T-1载体购自GE公司。
1.2 血清、抗体和主要试剂血清1型DHAV阳性血清购自中国兽医药品监察所;其他禽病毒血清和兔抗DHAV高免血清均为本禽病实验室保存;辣根过氧化物酶(HRP)标记的羊抗兔IgG购自北京中杉金桥生物技术公司;HRP标记的羊抗鸭IgG购自美国KPL公司;EcoR I、Xho I、T4 DNA连接酶、IPTG 和M-MLV逆转录酶购自宝生物工程(大连)有限公司;质粒小量抽提试剂盒、DNA凝胶回收试剂盒购自爱思进生物技术(杭州)有限公司;Trizol试剂购自Invitrogen公司;2×Pfu PCR MasterMix购自天根生化科技(北京)有限公司;BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所。
1.3 DHAV VP1蛋白主要抗原域的预测首先将DHAV疫苗株A66株 VP1基因的序列翻译成氨基酸序列,然后应用DNAStar Protean软件模块进行二级结构和抗原域预测,分别用Chou-Fasman法和Garnier-Robson法分析VP1 蛋白的二级结构(α螺旋、β折叠、转角和无规则卷曲),并结合Karplus-Schultz法预测VP1蛋白骨架区的柔韧性;采用Kyte-Doolittle法预测VP1蛋白的亲水区和疏水区;用Emini原则预测特定区域位于蛋白质表面的可能性;综合应用二级结构、柔韧性、亲水性和表面可能性4种参数并结合Jameson-wolf法预测的VP1蛋白的抗原指数来确定主要的抗原域(main antigenic domain,MAD),并命名为VP1M。
1.4 引物设计与合成根据GenBank中登录的DHAV疫苗株A66株全基因序列(GenBank登录号∶DQ886445)以及预测的主要抗原域VP1M,运用Primer Premier 5.0软件设计特异性引物进行扩增。VP1M-F:5'-CGGAATTCACACCACTCAGGCCAA CTC-3'; VP1M-R:5'-CCGCTCGAGTTCAATTTC CAGATCGAGTTC-3',下划线部分为EcoR I 和XhoI酶切位点。引物由上海英骏生物技术有限公司合成。
1.5 RT-PCR扩增和重组表达质粒的构建根据Trizol试剂的使用说明提取200 μL DHAV 鸡胚尿囊毒中的总RNA。以提取的总RNA和随机引物N6或特异性引物VP1M-R进行反转录获得cDNA作为PCR模板。反转录程序:42℃反应60 min,95℃反应5 min灭活逆转录酶。PCR反应采用50 μL反应体系:cDNA模板 4 μL、引物(VP1M-F和VP1M-R)各2.5 μL、2×Pfu PCR MasterMix 25 μL、ddH2O 16 μL。反应条件:95℃ 预变性5 min;94℃ 变性30 s,52℃退火30 s,72℃ 延伸30 s,35个循环;72℃ 延伸10 min。反应结束后取6 μL PCR产物用1%琼脂糖凝胶进行电泳分析。分析正确后,剩余PCR产物用琼脂糖凝胶回收试剂盒回收。
将回收的PCR产物与载体pGEX-4T-1分别用EcoR I和Xho I双酶切,用T4 DNA 连接酶于16℃连接过夜,连接产物转化Trans DH5α感受态细胞。挑取单菌落培养后提取质粒进行双酶切鉴定,鉴定正确后测序进一步确证,获得阳性重组质粒,命名为pGEX-4T-VP1M。
1.6 重组质粒的诱导表达及表达产物的鉴定将pGEX-4T-VP1M质粒和pGEX-4T-1空质粒分别转化大肠杆菌BL21(DE3)感受态细胞。挑取单个克隆接入4 mL含有100 μg/mL氨苄青霉素(Amp+)的新鲜LB液体培养基中,37℃、220 r/min振荡培养过夜。然后将培养物以1∶100的比例接种到新鲜含Amp+(100μg/mL) LB 液体培养基中,37℃振荡培养至菌液D600值达到0.4~0.8。采用不同诱导时间、不同温度和不同IPTG诱导浓度进行诱导表达,同时设置空载体诱导对照和重组质粒未诱导对照。不同诱导条件下各取1 mL 诱导产物,12 000×g离心1 min后收集菌体沉淀进行SDS-PAGE电泳分析,确定最佳诱导时间、温度和IPTG浓度。以最佳条件诱导表达后,超声破碎细胞,12 000×g离心15 min, 分别收集上清及沉淀进行SDS-PAGE分析,鉴定目的蛋白的表达形式。
1.7 表达产物的纯化和Western blot活性检测经过鉴定,目的蛋白以包涵体形式存在于沉淀中,包涵体蛋白的纯化参照文献[8],使用包涵体蛋白的分离方法进行,纯化的目的蛋白浓度用BCA法测定。取纯化的目的蛋白与pGEX-4T-1空载体诱导表达菌经变性处理后进行SDS-PAGE电泳,然后转印至硝酸纤维素膜上,5%脱脂乳4℃封闭过夜后与兔抗DHAV高免血清37℃反应2 h,PBST洗涤后加入HRP标记的羊抗兔IgG 37℃作用2 h,洗涤后,用DAB进行显色。
1.8 间接ELISA检测方法的建立利用方阵滴定的方法确定最佳的抗原(纯化的重组蛋白)包被浓度和血清稀释倍数。首先用抗原包被液(0.05 mol/L碳酸盐缓冲液)将抗原分别稀释至 0.1、0.2、0.5、1.0、2.0、3.0、4.0 μg/mL,100 μL/孔加入酶标板,4℃包被过夜。用1%明胶溶液37℃封闭1 h。 将除去大肠杆菌非特异性抗体的阳性血清和阴性血清分别按照1∶10、1∶20、1∶50、1∶100、1∶200、1∶500、1∶1000稀释,100 μL/孔加入酶标板,37℃作用1 h。PBST洗涤3次后,按照100 μL/孔加入经1∶1000~1∶5000系列稀释的酶标二抗,37℃温育1 h。经PBST洗涤后加入TMB底物,37℃孵育15 min,加入2 mol/ L H2SO4溶液终止反应,用酶标仪测定OD450吸光度值。P/N的比值最大且P值在1.0左右时的抗原包被浓度和血清稀释度为最佳工作浓度[9]。按照上述确定的ELISA操作方法检测30份阴性血清(经中和实验检测确认)。根据各阴性血清OD450值的平均值() 和标准方差(s)计算阴阳性样品的临界值Cut-off:+3s。
1.9 特异性试验用建立的间接ELISA方法分别检测血清1型和3型DHAV阳性血清、鸭瘟病毒(Duck enteritis virus,DEV)阳性血清、禽流感(Avian influenza virus,AIV)阳性血清、番鸭细小病毒(Muscovy duck parovirus,MDPV)阳性血清、鸭呼肠孤病毒(Duck reovirus,DRV)阳性血清和DHAV-1阴性血清。每份血清样品设置3个重复,判定间接ELISA方法的特异性。
1.10 敏感性试验3份阳性血清经1∶40、1∶160、1∶320、1∶640、1∶1280、1∶2560、1∶5120、1∶10 240倍比稀释后,用建立的间接ELISA方法分别进行检测,确定血清检出的极限。
1.11 重复性试验 批内重复性试验:选取5份DHAV-1抗体水平不同的血清,在相同的试验条件下每份血清样本做5次,根据变异系数(CV)来评价批内可重复性。批间重复性试验:选取5份DHAV-1抗体水平不同的血清,在相同的试验条件下的5个不同批次ELISA板中试验,根据变异系数(CV)来评价批间可重复性。
1.12 临床样品的检测利用建立的间接ELISA方法和经典的血清中和试验对临床收集的72份疑似鸭甲肝病毒血清进行检测,计算两种方法检测的阳性率和符合率。
2 结果
2.1 VP1主要抗原域的确定DNAStar Protean软件模块预测二级结构和抗原域的结果如图1所示。在综合分析VP1蛋白二级结构、柔韧性、亲水性和表面可能性4种参数以及抗原指数基础上,确定了DHAV-1 VP1蛋白主要抗原域在C端的aa130~238,对应的VP1M编码基因长度为327 bp。

图1 DHAV-1 A66毒株VP1蛋白的二级结构、柔韧性、亲水性、表面可能性和抗原指数Fig.1 Secondary structure, fl exible regions, hydrophilicity plot, surface probability plot and antigenic index of DHAV-1 strain A66 VP1 protein
2.2VP1M基因的RT-PCR和重组表达质粒的鉴定 利用特异性引物对DHAV-1 A66毒株的VP1M基因进行RT-PCR,PCR产物经1%琼脂糖凝胶电泳显示,获得了大小约为327 bp的条带,与预期的大小一致(图2)。重组表达质粒pGEX-4T-VP1M经EcoR I 和Xho I双酶切鉴定,结果得到约4900 bp和327 bp的2个片段,与预期的结果相符(图2),进一步的测序结果也表明插入目的片段的大小和阅读框正确。
2.3 重组蛋白的表达、纯化和活性鉴定经SDSPAGE电泳确定重组蛋白所表达的最佳诱导温度为37℃,IPTG最佳诱导浓度为1.0 mmol/L,最佳诱导时间为4 h,所表达的分子量约为38 kDa,与预期的大小相符。以最佳条件表达的重组蛋白是以包涵体的形式表达,对重组蛋白使用包涵体的分离纯化方法进行纯化,对纯化前后的重组蛋白进行SDSPAGE检测,结果显示目的蛋白得到了纯化(图3A)。BCA法测定的重组蛋白的浓度为0.802 mg/ mL。Western blot检测的结果显示,纯化的目的蛋白在38 kDa大小附近出现特异性条带,诱导的空载体未出现目的条带,表明目的蛋白可以被兔抗DHAV-1多克隆血清所识别,具备良好的抗原性(图3B)。
2.4 DHAV间接ELISA方法的初步建立经过方阵滴定试验确定的重组蛋白包被浓度为2.0 μg/mL,4℃过夜包被,血清稀释度为1∶100,37℃作用1 h,酶标二抗的稀释度为1∶2000,37℃温育1 h。其余按照间接ELISA方法进行操作。通过测定30份阴性血清样品确定了平均值()为0.1974,标准差(s)为0.0177。本检测方法的阴阳性临界值Cut-off为0.251。
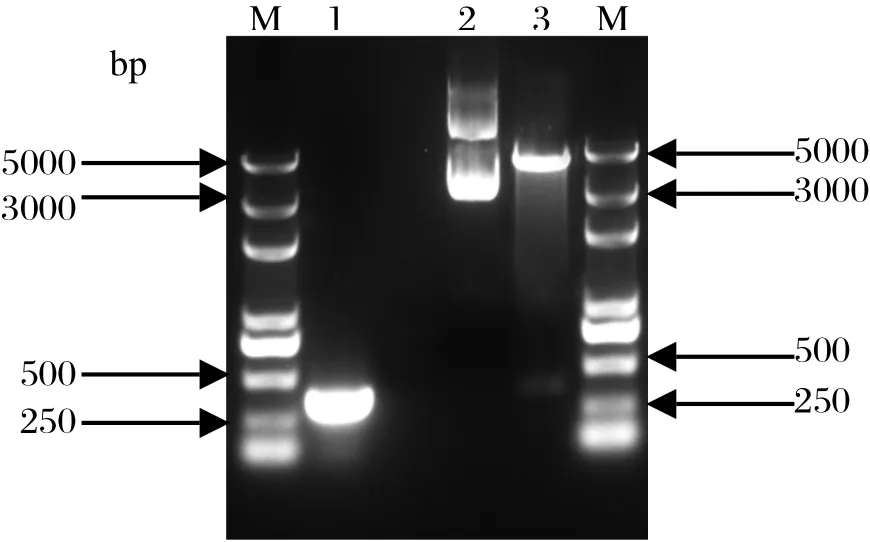
图2 VP1M基因的RT-PCR和重组表达质粒pGEX-4TVP1M的酶切鉴定结果Fig.2 RT-PCR result of the VP1M gene and identifi cation of recombinant expression plasmid pGEX-4T-VP1M by restriction enzymes digestion
2.5 DHAV间接ELISA方法的评估本研究建立的间接ELISA方法的特异性试验显示,只有DHAV-1的阳性血清的OD值超过0.251,表明重组蛋白与其他血清不发生交叉反应,显示了良好的特异性。敏感性试验显示,当血清稀释至1280倍时检测结果仍为阳性,证明该方法具有较好的敏感性。分别用同批次和不同批次的抗原包被酶标板以及本研究建立的ELISA方法检测了5份DHAV-1抗体水平不同的血清,结果显示,批内重复试验变异系数(CV)在1.82%~4.11% (表1),批间重复试验变异系数(CV)在6.58%~8.46%(表2),均小于10%,表明该方法具有较好的稳定性。
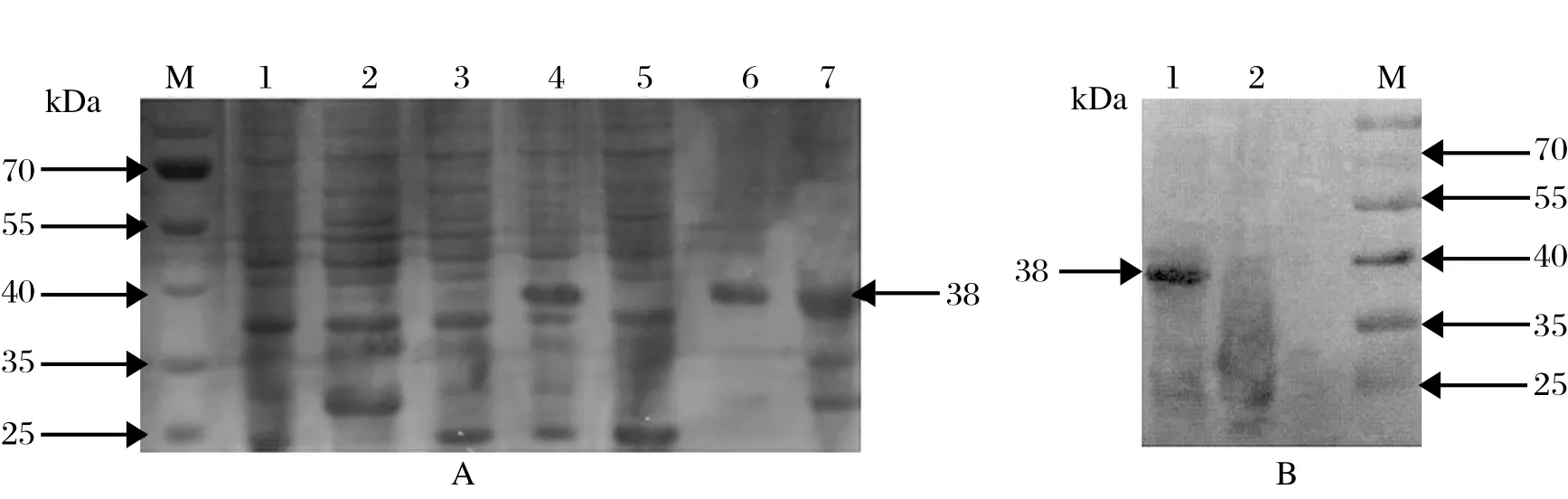
图3 重组蛋白的SDS-PAGE(A) 和Western blot 分析(B)Fig.3 SDS-PAGE (A) and Western blot (B) analysis of recombinant protein

表1 批内重复试验Table1 The reproducibility test in the same plates
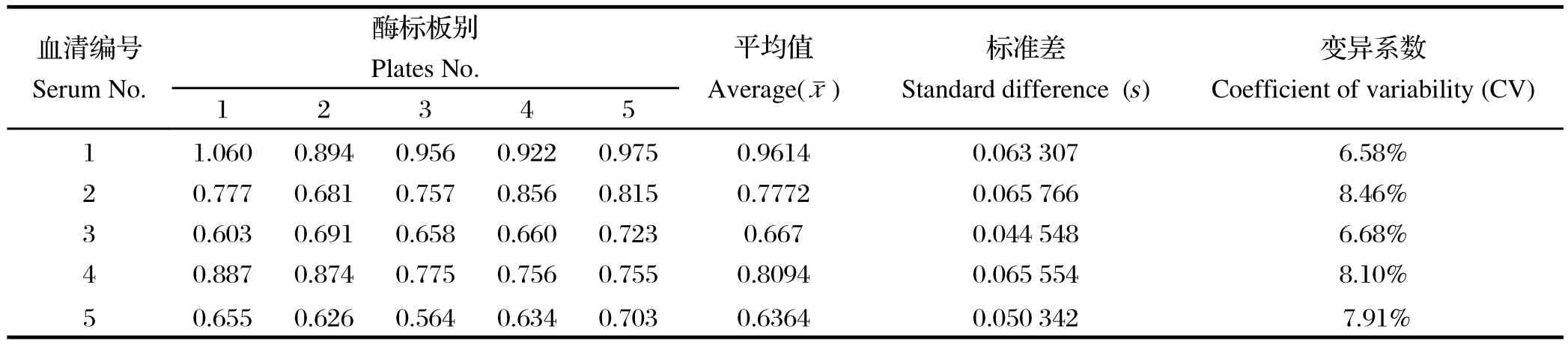
表2 批间重复试验Table2 The reproducibility test in the different plates
2.6 DHAV间接ELISA方法的应用和比较将临床收集的72份疑似鸭甲肝病毒血清用建立的间接ELISA方法和经典血清中和试验(serum-neutralization, SN)进行检测和比较,检测结果显示,与SN相比,建立的ELISA检测方法的诊断敏感性为91.2%,诊断的特异性为80%,符合率约为88.9%(表3)。
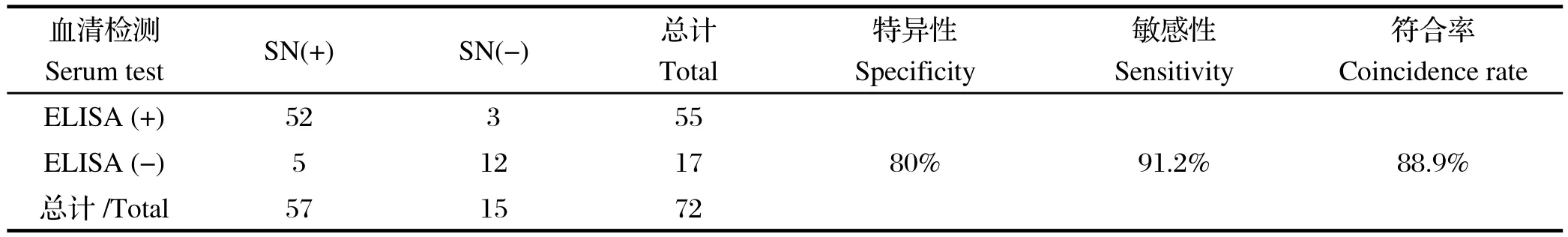
表3 DHAV间接ELISA方法与血清中和试验的比较Table3 Comparison of the indirect ELISA with SN test for detecting antibody against DHAV
3 讨论
随着现代养鸭业的规模化和集约化生产以及国内外贸易的日益频繁,DVH的危害日益严重。尽管DHAV灭活苗和弱毒苗的研制和应用在控制DVH的爆发和流行上起到了重要的作用,但是近年来DVH发病率和死亡率还是呈逐年递增的趋势。目前,DHAV-1作为DVH的主要病原之一,仍为中国大陆DVH流行主要的致病病原。DVH也是中国进出口检验检疫中必检的一种重要水禽疾病。因此,迫切需要建立一种快速、特异、敏感且可大批量处理样品的检测方法,以便能及时正确了解鸭群的免疫抗体水平和疾病感染状况。
传统的病毒分离和琼脂扩散试验特异性和敏感性较低,而血清中和试验准确但费时、费力且不适于大批量样品的检测。基于分子生物学建立起来的检测技术主要包括RT-PCR[10, 11]、Real-time RTPCR[12]和环介导等温扩增技术(reverse transcription loop-mediated isothermal amplification assay,RT-LAMP)[13,14]等方法,这些方法是针对病原的检测,具有较高的特异性和敏感性,但检测成本和技术要求较高,也不适宜于活体或大批量样本的检测。ELISA方法由于具有快速、特异、敏感和易于标准化等优点,结合半自动化的检测设备,非常适合于大批量样品的筛查,可满足基层单位或检验检疫部门的需要。Zhao等[15]将DHAV-1全病毒作为包被抗原建立了检测抗体的间接ELISA方法。但是DHAV-1的增殖和纯化技术难度大、成本高且易造成散毒。Liu等[16]利用原核表达系统表达重组VP1蛋白也建立了测抗体的间接ELISA方法。该方法与之前ELISA方法相比有较大改进,然而DHAV-1 VP1蛋白的表达量偏低,虽然密码子优化的方法可以提高目的基因的表达产量[4],但是密码子的优化需要人工合成碱基序列,这些都增加了抗原制备的成本,不利于试剂盒的研制和推广应用。本研究用DNAStar 生物学软件对DHAV-1 VP1基因的二级结构和抗原指数等特性进行分析,选择主要的抗原域进行原核表达,Western blot检测表明重组蛋白具有良好的抗原性。以纯化后的重组蛋白作为包被抗原而建立的间接ELISA方法具有良好的特异性、敏感性和可重复性,与中华人民共和国出入境检查检疫行业标准的血清中和试验(SN/T 1418-2004)方法符合率达到88.9%。本研究利用原核表达的VP1主要抗原域建立的ELISA方法为进一步开发商品化的ELISA检测试剂盒奠定了基础。
此外,大肠杆菌抗体在鸭群中普遍存在,而本研究建立的ELISA方法包被抗原为大肠杆菌表达的重组蛋白,纯化后的抗原也或多或少存在大肠杆菌的菌体,这无疑增加了非特异性反应,通过将待检鸭血清预先吸附大肠杆菌裂解液可明显降低非特异性反应。关于ELISA检测结果的判定标准,一般有两种评定标准。一种是计算样本的原始OD平均值和标准差来确定临界值。另一种是计算待测样品相对于阳性对照的的比值,通过测定大量样本效价的频次分布来确定临界值和可疑区间。本研究采用了前者作为阴阳性样品判临界值,其依据的基本原理是当样品的OD值≥阴性样本OD平均值+3倍标准差(+3s)时,在统计学上可以在99.9%水平上判为阳性。
[1] Fu Y, Pan M, Wang X, et al.Molecular detection and typing of duck hepatitis A virus directly from clinical specimens [J].Vet Microbiol,2008,131(3-4)∶ 247-257.
[2] Wang L, Pan M, Fu Y, et al.Classification of duck hepatitis virus into three genotypes based on molecular evolutionary analysis [J].Virus Genes, 2008, 37(1)∶ 52-59.
[3] Balamurugan V, Renji R, Saha S N, et al.Protective immune response of the capsid precursor polypeptide (P1) of foot and mouth disease virus type 'O' produced in Pichia pastoris [J].Virus Res, 2003, 92(2)∶ 141-149.
[4] Li C, Chen Z, Meng C, et al.High yield expression of duck hepatitis A virus VP1 protein in Escherichia coli, and production and characterization of polyclonal antibody [J].J Virol Methods, 2013, 191(1)∶ 69-75.
[5] Zhang S, Xiang J, Cheng A et al.Production, purification and characterization of polyclonal antibody against the truncated gK of the duck enteritis virus [J].Virol J, 2010, 7∶ 241.
[6] Liu F, Wu X, Li L, et al.Expression, purification and characterization of two truncated peste des petits ruminants virus matrix proteins in Escherichia coli, and production of polyclonal antibodies against this protein [J].Protein Expr Purif, 2013, 91(1)∶ 1-9.
[7] Li M, Cui W, Mo C, et al.Cloning, expression, purification, antiserum preparation and its characteristics of the truncated UL6 protein of herpes simplex virus 1 [J].Mol Biol Rep, 2014, 41(9)∶ 5997-6002.
[8] Sambrook J, Russell D W.分子克隆实验指南[M].3版.北京∶ 科学出版社, 2002∶ 1256-1265.
[9] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J].Anal Biochem, 1976, 72(7)∶ 248-254.
[10] Kim M C,Kwon Y K,Joh S J, et al.Development of one-step reverse transcriptase-polymerase chain reaction to detect duck hepatitis virus type 1 [J].Avian Dis, 2007, 51(2)∶ 540-545.
[11] Anchun C, Mingshu W, Hongyi X, et al.Development and application of a reverse transcriptase polymerase chain reaction to detect Chinese isolates of duck hepatitis virus type 1 [J].J Microbiol Methods, 2009, 76(1)∶ 1-5.
[12] Yang M, Cheng, A, Wang, M, et al.Development and application of a one-step real-time Taqman RT-PCR assay for detection of Duck hepatitis virus type1[J].J Virol Methods, 2008, 153(1)∶ 55-60.
[13] Song C, Wan H, Yu S, et al.Rapid detection of duck hepatitis virus type-1 by reverse transcription loopmediated isothermal amplification[J].J Virol Methods, 2012, 182 (1-2)∶ 76-81.
[14] Yang L, Li J, Bi Y, et al.Development and application of a reverse transcription loop-mediated isothermal amplification method for rapid detection of Duck hepatitis A virus type 1[J].Virus Genes, 2012, 45(3)∶ 585-589.
[15] Zhao X L, Phillips R M, Li G D, et al.Studies on the detection of antibody to duck hepatitis virus by enzymelinked immunosorbent assay [J].Avian Dis, 1991, 35(4)∶778-782.
[16] Liu M,Zhang T, Zhang Y, et al.Development and evaluation of a VP1-ELISA for detection of antibodies to duck hepatitis type 1 virus [J].J Virol Methods, 2010, 169(1)∶ 66-69.
PROKARYOTIC EXPRESSION OF MAJOR ANTIGEN DOMAIN OF VP1 PROTEIN OF DUCK HEPATITIS A VIRUS AND ITS APPLICATION FOR THE DEVELOPMENT OF INDIRECT ELISA
SUN Tao1, LI Chuan-feng2, XU Biao1, DENG Ming-jun1, YUE Zhi-qin1
(1.Shandong Entry-Exit Inspection and Quarantine Bureau, Qingdao 266002, China; 2.Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
The published complete genome sequence of VP1 of Duck hepatitis A virus (DHAV) strain A66 was used to predict its secondary structure and antigen domain and to determine its major antigen domain of VP1 (VP1M) using molecular biological software DNAStar.Accordingly, a pair of specifi c primers were designed and synthesized, which were used for amplifi cation of the VP1M gene fragment with 327 bp in length.The VP1M gene fragment was directly cloned into the expression vector pGEX-4T-1.The resulting pGEX-4T-VP1M plasmid was transformed into BL21 (DE3) and expression of VP1M was induced with IPTG.The recombinant VP1M was harvested in inclusion body form and visualized in Western blot analysis.In addition, an indirect ELISA was developed for detecting antibodies against DHAV-1 using the recombinant VP1M protein.The results showed that the assay was specifi c, sensitive and reproducible, which could be used as a serological method for rapid diagnosis, epidemiology and surveillance of DHAV-1.
Duck hepatitis A virus; VP1; antigen domain; indirect ELISA
S852.659.6
A
1674-6422(2015)02-0007-08
2014-10-20
山东出入境检验检疫局基金项目(SK201301);青岛市公共领域支撑计划(12-1-3-80-jh);国家自然科学基金项目(31101848)
孙涛, 男, 硕士, 兽医师, 主要从事动物传染病病原与生物制品学研究
徐彪,E-mail∶ xuwenlu@hotmail.com
