稳定表达兔岩藻糖基转移酶RK13细胞系的建立
2015-12-31缪秋红郭慧敏谭永贵李传峰孟春春陈宗艳刘光清
朱 杰,缪秋红,郭慧敏,谭永贵,李传峰,孟春春,陈宗艳,刘光清
(中国农业科学院上海兽医研究所,上海200241)
·研究论文·
稳定表达兔岩藻糖基转移酶RK13细胞系的建立
朱 杰,缪秋红,郭慧敏,谭永贵,李传峰,孟春春,陈宗艳,刘光清
(中国农业科学院上海兽医研究所,上海200241)
为了构建稳定表达兔岩藻糖基转移酶(fucosyltransferase, FUT2)的RK13细胞系,本研究将FUT2基因编码序列插入到慢病毒载体 pLOV-GFP-3Flag中,构建了pLOV-3Flag-FUT2重组质粒。将pLOV-3Flag-FUT2与包装质粒psPAX2和外膜质粒pMD2.G共转染293T 细胞,获得重组病毒样颗粒。用含病毒样颗粒的细胞培养上清液感染RK13细胞,并通过嘌呤霉素筛选、纯化,获得稳定表达FUT2的细胞系,命名为RK-FUT2细胞。连续培养10代后,利用PCR、RT-PCR和Western blot方法鉴定,结果表明,RK-FUT2细胞系能够稳定表达兔岩藻糖基转移酶。该细胞系为研究FUT2在兔病毒性出血症病毒(Rabbit hemorrhagic disease virus,RHDV)感染过程和致病机制中的作用提供了有力工具。
兔岩藻糖基转移酶;RK13细胞;兔病毒性出血症病毒
兔病毒性出血症病毒(Rabbit hemorrhagic disease virus,RHDV)为单股正链RNA病毒,属于杯状病毒科(Caliciviridae)、兔病毒属(Lagovirus)[1-3]。该病毒可使兔发生急性、败血性传染病,发病率达100%,病死率可达90%以上,是兔的一种毁灭性传染病,俗称“兔瘟”。1984年,兔瘟第一次在中国江苏省大规模爆发,病兔呈现肝脏坏死,实质脏器水肿,呼吸系统弥慢性出血等典型病变[4]。随后,该病迅速传播扩散至全球,给世界各国兔养殖业造成了严重的损失[3,5,6]。目前,关于RHDV的研究虽然也取得了一些进展,但是由于缺少稳定的细胞增殖模型,对于RHDV的感染和致病机理的研究还未取得突破性结果。据报道,RHDV能够与H2型组织血型抗原(histo-blood group antigen, HBGA)家族的一种三糖(Fucα2Galβ4GlcNAcβ-R)结合,该三糖广泛存在于各哺乳动物中,且在组织分布上具有明显的种属差异[7]。由兔源功能基因SEC1、FUT1和FUT2编码的α-1,2岩藻糖基转移酶(fucosyltransferase, FUT),催化岩藻糖基与H2型HBGA前体相结合,然后发挥岩藻糖的功能[8-10]。在诺瓦克病毒研究中发现,FUT2和FUT3表达障碍的人对诺瓦克病毒具有抵抗力,可见岩藻糖基转移酶在诺瓦克病毒感染过程中发挥重要作用[11-13]。在RHDV研究中也发现,该病毒主要引发成年兔发病,幼兔很少感染发病,猜测可能是由于RHDV主要吸附因子H2 HBGA型受体在幼兔肝脏中不表达,因此FUT2基因表达受到抑制,从而使幼兔能够抵抗兔RHDV感染[14]。可见,岩藻糖基转移酶与RHDV的感染过程密切相关。本研究将兔源FUT2基因在兔肾上皮细胞RK13中稳定表达,建立RK-FUT2细胞系,为探讨FUT2在RHDV感染过程中的作用提供很好的平台,进而期望以此获得对RHDV敏感的细胞模型。
1 材料和方法
1.1 菌种和质粒E.coli DH5α感受态细胞购自北京全式金生物技术有限公司;重组质粒pET30a-FUT2(含有FUT2全基因序列,DQ:X91269)、pLOVGFP-3Flag、psPAX2、pMD2.G等慢病毒包装载体由中国农业科学院上海兽医研究所禽病实验室(简称禽病实验室)保存。
1.2 细胞系293T细胞系由禽病实验室保存;RK13细胞购自武汉大学细胞保存中心。
1.3 主要试剂与材料T4 DNA连接酶、Not I、Nhe I限制性内切酶购自 NEB公司;ECL显色液购自赛默飞公司;Pfu DNA聚合酶购自北京天根生化技术有限公司;抗Flag标签小鼠单克隆抗体、HRP 标记的山羊抗鼠 IgG二抗购自Santa Cruz公司;AxyPrep 96DNA凝胶回收试剂盒购自爱思进生物技术有限公司(杭州);DMEM培养基、MEM培养基、1×PBS购自Hyclone公司;胎牛血清(FBS)购于Gibco生物公司;钙转染试剂自配(CaCl2和Heps试剂购自Sigma公司);Puromycin 购自 Amresco 公司;去内毒素质粒提取试剂盒购自 QIAGEN 公司;抽提细胞总基因组、mRNA试剂盒分别为OMEGA Tissue DNAkit、BioTeke无氯仿RNA提取试剂盒(离心柱型)。
1.4 慢病毒包装质粒pLOV-3Flag-FUT2的构建根据GenBank中兔源FUT2 基因组序列(DQ:X91269)设计扩增FUT2基因的引物。以FUT2-NheI-F (5′-CTAGCTAGCTGAGCCACCATGAGCACCGC CCAGGTC-3′)和FUT2-Not I-R(5′-ATTTGCGGC CGCTCAGTGCTTGAGCAATGG-3′)为引物,从前期实验室构建的FUT2原核表达质粒pET30a-FUT2[15]扩增FUT2 基因的完整开放阅读框。PCR 产物经割胶纯化后用Nhe I 和Not I 酶切,并利用T4 DNA连接酶连接于同样酶切的pLOV-GFP-3Flag载体中,构建pLOV-3Flag-FUT2重组质粒,构建的重组质粒经酶切鉴定无误后测序。
1.5 含FUT2基因重组慢病毒样颗粒的制备按照QIAGEN Maxiprep Endo-free Plasmid Kit I说明书操作提取高纯度无内毒素的pLOV-3Flag-FUT2、psPAX2、pMD2.G三个质粒,利用分光光度计测定质粒浓度后,利用钙转染试剂将3种质粒共转染293T细胞,转染48 h后收集含重组慢病毒样颗粒的细胞培养上清液。
1.6 表达FUT2基因RK-13细胞系的制备与阳性细胞株的筛选待转染293T细胞48 h后,将含FUT2基因的重组慢病毒样颗粒的293T细胞培养上清液转移至RK13细胞中,感染 24 h 后用含嘌呤霉素 (2 μg/mL)培养基进行抗性筛选,每隔2 d 弃去细胞培养上清液,换含嘌呤霉素的新培养液。4 d 后将阳性细胞株在含嘌呤霉素的条件下连续传代,待传代至第5代与第10代细胞时进行鉴定。
1.7 FUT2基因组插入水平检测以及mRNA表达水平检测提取第5代和10代细胞的基因组总DNA和总mRNA,mRNA用随机引物进行反转录获得cDNA,以cDNA和细胞的基因组DNA为模板,用引物FUT2-Nhe I-F 和FUT2-Not I-R 进行 PCR扩增。PCR反应程序:95℃预变性5 min;94℃变性45 s,56℃退火45 min,72℃延伸 1min,共30个循环;最后72℃延伸5 min。以兔源β-actin基因为内参基因,利用引物β-actin-F (5′-ATCGAGCACGGCATCGTCACC-3′)和β-actin-R(5′- CACGTCACACTTCATGATGGA-3′)进行PCR扩增。最后PCR 产物用1%的琼脂糖凝胶电泳检测。
1.8 FUT2 蛋白表达水平Western blot检测将第5代和第10代细胞加入适量细胞裂解液,裂解后离心取上清,然后加入4×Protein lading buffer,加热煮沸10 min,再经12% SDS-PAGE电泳后,转印至NC膜。NC膜用4%BSA在37℃封闭2 h,加入小鼠Flag单克隆抗体(按1∶2000用BSA进行稀释),4℃孵育过夜;TBST清洗3次,10 min/次,然后加入以1∶2000稀释的HRP标记的羊抗鼠二抗,室温孵育1 h;TBST清洗3次,10 min/次;最后用Thermo scientific公司的ECL发光显色试剂盒,曝光显影。
2 结果
2.1 pLOV-3Flag-FUT2重组质粒构建与鉴定以pET30a-FUT2质粒为模板,用引物pFUT2-Nhe I-F 和pFUT2-Not I-R 扩增获得FUT2基因片段,然后通过酶切连接获得pLOV-3Flag-FUT2重组质粒。利用Nhe I和Not I双酶切鉴定正确后,经上海杰李公司测序,确认该质粒构建成功(图1)。
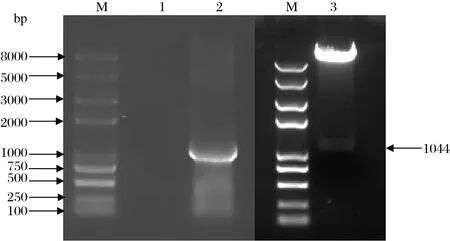
图1 pLOV-3Flag-FUT2质粒的构建与鉴定Fig.1 Construction and identifi cation of the plasmid pLOV-3Flag-FUT2
2.2 稳定表达FUT2的RK13细胞筛选前期利用RK-13细胞筛选出杀死该细胞最低的嘌呤霉素浓度为2 μg/mL。将pLOV-3Flag-FUT2与包装质粒psPAX2和外膜质粒pMD2.G共转染于293T细胞中,48 h后,收集含FUT2和eGFP的重组慢病毒样颗粒的细胞培养液。然后将其转接至RK-13细胞中进行感染,24 h后加入嘌呤霉素至终浓度为2 μg/mL,每隔2 d更换新培养基,待细胞不出现死亡,将细胞进行传代,如图2所示,eGFP基因成功在RK-FUT2细胞中表达。
选取第5代和第10代RK-FUT2细胞,进行细胞DNA提取和总RNA的提取,细胞总RNA经过反转录合成cDNA。然后用FUT2-Nhe I-F 和FUT2-Not I-R 特异引物分别以细胞DNA和cDNA为模板扩增FUT2基因。以β-actin为内参基因,所得片段为408 bp。如图3A所示,第5代和第10代均能在该细胞基因组中检出FUT2基因,RK13细胞中未检测出。如图3B所示,第5代和第10代RK-FUT2细胞也能检测出FUT2基因,RK13细胞中未检测出。从而表明,FUT2基因成功插入到细胞基因组中,并且能够转录成mRNA。
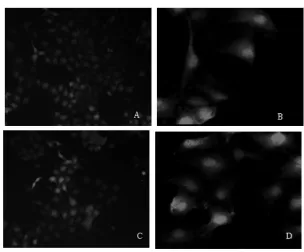
图2 嘌呤霉素筛选的阳性RK-FUT2细胞Fig.2 The positive RK-FUT2 cells screened by puromycin
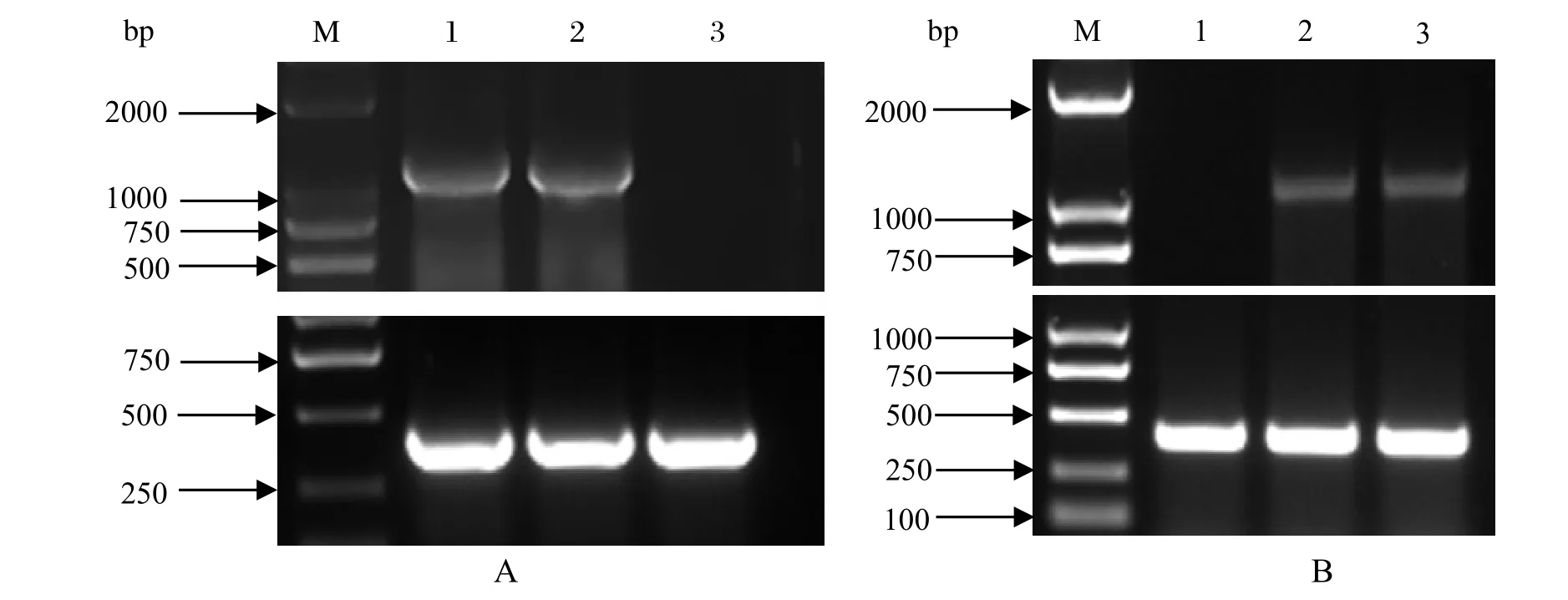
图3 RK-FUT2细胞FUT2基因检测Fig.3 Examination results of FUT2 gene in RK-FUT2 cells
2.3 Western blot检测FUT2 蛋白表达选取第5代和第10代RK-FUT2细胞,进行Western blot检测。以Flag标签单抗为一抗,β-actin为内参蛋白,ECL显影曝光结果如图4所示,第5代和第10代RK-FUT2细胞均能检测出FUT2蛋白高效表达,表明RK-FUT2细胞能够稳定表达FUT2蛋白。
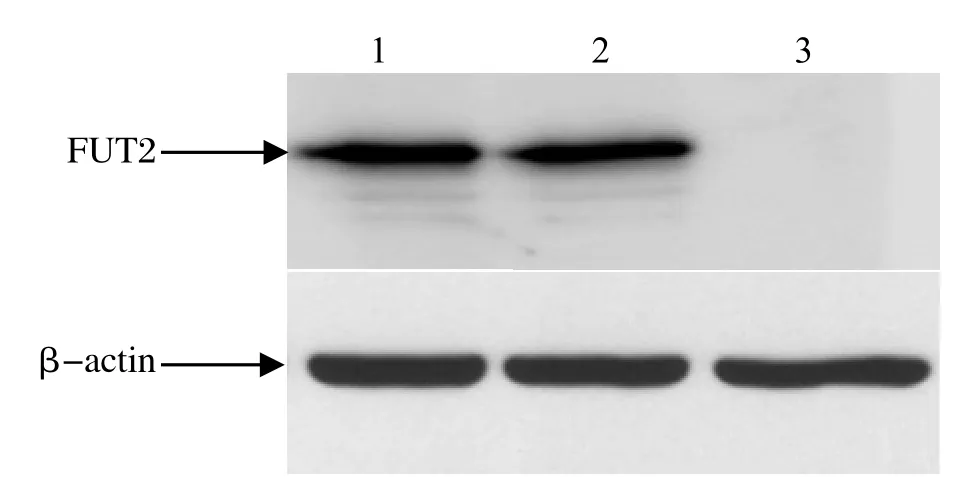
图4 FUT2 蛋白表达水平检测Fig.4 Detection of FUT2 protein in RK-FUT2 cells by Western blot
3 讨论
筛选与建立细胞系有多种方法,如利用脂质体转染直接将表达质粒转染靶细胞筛选获得,或利用逆转录病毒系统将目的基因导入靶细胞内。由于直接转染的方法效率较低,目前慢病毒载体成为基因整合的良好工具,并已被广泛应用[16,17]。因为逆转录病毒在感染细胞上具有特异性,使得其在细胞系建立上逐渐被慢病毒系统所取代,然而逆转录病毒中所特有的水泡性口炎病毒(Vesicular stomatitis virus,VSV)的G蛋白(lentiviral VSV-G protein),由于具有高效性,也被广泛应用于慢病毒包装构建细胞系[18-20]。通过分子克隆技术将目的基因插入到该慢病毒载体中,包装细胞293T能提供慢病毒载体包装所需的其他蛋白,形成具有靶基因的能够感染其他宿主细胞的重组慢病毒样颗粒。该病毒颗粒感染目的细胞后,目的基因进入细胞并整合到细胞染色体中,从而使得目的基因在靶细胞中得到稳定表达。RK13细胞是RHDV的天然宿主细胞,本研究利用慢病毒包装系统构建FUT2稳定表达细胞系,所使用的包装载体为pLOV-GFP-3Flag,该载体是将GFP蛋白与目的蛋白融合表达,然后通过中间2A蛋白酶将FUT2蛋白与GFP蛋白分开,从而形成独立的FUT2蛋白。同时,由于目前我们缺少有效的兔源FUT2抗体,所以我们利用FUT2 N端添加3Flag小标签进行FUT2蛋白水平检测。
RHDV属于杯状病毒科、兔病毒属,是单股正链RNA病毒。由于该病毒不能在体外培养或稳定增殖,限制了“兔瘟”细胞毒疫苗的研制,同时严重阻碍了RHDV研究进程。至今为止,研究人员仍未找到能稳定增殖该病毒的细胞系,并且关于RHDV的感染和致病机理等都知之甚少。有学者研究发现,RHDV能够与人类组织血型抗原ABH/O和Lewis (HBGA)发生抗原抗体反应[7]。HBGA为复杂的多聚糖,通过细胞内单糖在α-1,2岩藻糖基转移酶(FUT2)的作用下发生糖基化聚合形成[21]。同时Nyström等[22]研究发现,RHDV与HBGA的A2型、B2型和H2型结合。前期研究发现,兔瘟仅发生于成年兔,幼兔很少感染发病,猜测是由于幼兔体内FUT2水平过低导致H2型HBGA糖基化水平低下,不能形成与RHDV有效结合的受体[14]。在杯状病毒科的其他病毒研究中,同样发现FUT2表达缺陷能够抵抗该病毒的感染,如诺瓦克病毒[11-13]。可见FUT2在RHDV的感染和致病过程中发挥重要作用。因此,研究兔FUT2的功能,建立稳定表达FUT2基因的兔源细胞系,对研究RHDV感染和致病机理具有重要意义,同时可以为寻找RHDV稳定增殖的细胞系提供新的方向和重要基础。
本研究通过慢病毒包装的方法成功构建了稳定表达兔源FUT2蛋白的RK-FUT2细胞系。通过蛋白水平检测,该细胞系能够稳定高效表达兔源FUT2蛋白,为研究FUT2在RHDV感染和致病过程中的作用及其作用机制提供了重要的平台。
[1] Moussa A, Chasey D, Lavazza A, et al.Haemorrhagic disease of lagomorphs∶ evidence for a calicivirus [J].Vet Microbiol, 1992, 33(1-4)∶ 375-381.
[2] Meyers G, Wirblich C, Thiel H J.Genomic and subgenomic RNAs of rabbit hemorrhagic disease virusare both protein-linked and packaged into particles [J].Virology, 1991, 184(2)∶ 677-686.
[3] Gregg D A, House C, Meyer R, et al.Viral haemorrhagic disease of rabbits in Mexico∶ epidemiology and viral characterization [J].Rev Sci Tech, 1991, 10(2)∶ 435-451.
[4] 刘胜江, 薛华平, 浦伯清, 等.兔的一种新病毒病——兔病毒性出血症[J].畜牧与兽医, 1984, (6)∶253-255.
[5] Lee C S, Park C K.Aetiological studies on an acute fatal disease of Angora rabbits∶ co-called rabbit viral sudden death [J].Korean J Vet Res, 1987, 27∶ 277-290.
[6] Pu Q B, Qian N H, Cui S J.Micro HA and HI tests for the detection of antibody titres to so-called "haemnorrhagic pneumonia" in rabbits [J].Chin J Vet Med, 1985, 11∶ 16-17.
[7] Ruvoen-clouet N, Ganiere J P, Andre-fontaine G, et al.Binding of rabbit hemorrhagic disease virus to antigens of the ABH histo-blood group family [J].J Virol, 2000, 74(24)∶ 11950-11954.
[8] Marionneau S, Cailleau-thomas A, Rocher J, et al.ABH and Lewis histo-blood group antigens, a model for the meaning of oligosaccharide diversity in the face of a changing world [J].Biochimie, 2001, 83(7)∶ 565-573.
[9] Hitoshi S,Kusunoki S,Kanazawa I, et al.Molecular cloning and expression of a third type of rabbit GDP-L-fucose∶beta-D-galactoside 2-alpha-L-fucosyltransferase [J].J Biol Chem, 1996, 271(28)∶ 16975-16981.
[10] Hitoshi S, Kusunoki S, Kanazawa I, et al.Molecular cloning and expression of two types of rabbit betagalactoside alpha 1,2-fucosyltransferase [J].J Biol Chem, 1995, 270(15)∶ 8844-88450.
[11] Tan M, Jiang X.Norovirus and its histo-blood group antigen receptors∶ an answer to a historical puzzle [J].Trends Microbiol, 2005, 13(6)∶ 285-293.
[12] Hutson A M, Airaud F, Lependu J, et al.Norwalk virus infection associates with secretor status genotyped from sera [J].J Med Virol, 2005, 77(1)∶ 116-120.
[13] Lindesmith L, Moe C, Marionneau S, et al.Human susceptibility and resistance to Norwalk virus infection [J].Nat Med, 2003, 9(5)∶ 548-553.
[14] Guillon P, Ruvoen-Clouet N, Le moullac-Vaidye B, et al.Association between expression of the H histo-blood group antigen, alpha1,2fucosyltransferases polymorphism of wild rabbits, and sensitivity to rabbit hemorrhagic disease virus [J].Glycobiology, 2009, 19(1)∶ 21-28.
[15] 哲名家, 张淼涛, 云涛, 等.兔岩藻糖基转移酶基因的克隆与原核表达 [J].西北农林科技大学学报(自然科学版), 2012, 40 (4)∶ 21-24.
[16] 褚波, 黄雪峰, 唐云明.慢病毒载体及其应用进展 [J].生物医学工程学杂志, 2008, 25 (1)∶ 224-226.
[17] 王淑艳, 张愚.慢病毒载体的设计及应用进展 [J].中国生物工程杂志, 2006, 26 (11)∶ 70-75.
[18] 李振宇, 徐开林, 潘秀英, 等.HIV-1慢病毒载体的构建及结构改造 [J].中华血液学杂志, 2004, 25 (9)∶ 62-63.
[19] Naldini L, Verma I M.Lentiviral vectors [M] //Advances in Virus Research.New York∶ Academic Press, 2000∶599-609.
[20] Naldini L.Lentiviruses as gene transfer agents for delivery to non-dividing cells [J].Curr Opin Biotechnol, 1998, 9(5)∶ 457-463.
[21] Rademacher C, Krishna N R, Palcic M, et al.NMR experiments reveal the molecular basis of receptor recognition by a calicivirus [J].J Am Chem Soc, 2008, 130(11)∶ 3669-3675.
[22] Nystrom K, Le Gall-recule G, Grassi P, et al.Histoblood group antigens act as attachment factors of rabbit hemorrhagic disease virus infection in a virus straindependent manner [J].PLoS Pathog, 2011, 7(8)∶e1002188.
ESTABLISHMENT OF A STABLE RK13 CELL LINE EXPRESSING RABBIT FUCOSYLTRANSFERASE
ZHU Jie, MIAO Qiu-hong, GUO Hui-min, TAN Yong-gui, LI Chuan-feng, MENG Chun-chun, CHEN Zong-yan, LIU Guang-qing
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
To establish a stable RK13 cell line that expresses rabbit fucosyltransferase (FUT2), a recombinant plasmid pLOV-3Flag-FUT2 was constructed by inserting FUT2 gene into lentivirus expression vector pLOV-GFP-3Flag.Then, pLOV-3Flag-FUT2 plasmid together with psPAX2 and pMD2.G plasmids were co-transfected into 293T cells.The lentivirus-like particles were harvested from 293T cells and inoculated into RK13 cells.The RK13 clones expressing FUT2 were screened using the selection medium containing puromycin.The transcription and expression of FUT2 in the selected RK13 cells were detected in PCR, RT-PCR and Western blot.After ten passages, FUT2 was found to be effi ciently expressed in the RK13 cells designated as RK-FUT2.These results indicated that a stable cell line RKFUT2 was established successfully.The availability of RK-FUT2 cell line will be benefi t to further explore the FUT2 function in the pathogenesis of Rabbit hemorrhagic disease virus.
Rabbit fucosyltransferase; RK13 cell; Rabbit hemorrhagic disease virus
S852.659.6
A
1674-6422(2015)02-0001-06
2014-12-18
国家自然科学基金(31270194)
朱杰,男,硕士研究生,预防兽医学专业;缪秋红,女,硕士,主要从事兔出血症病毒分子生物学研究
刘光清, E-mail∶ liugq@shvri.ac.cn
