CKS1 siRNA对人舌癌Tca8113细胞中CKS1蛋白的抑制作用
2015-12-30徐亚娟,孙旭,李烁烯等
CKS1 siRNA对人舌癌Tca8113细胞中CKS1蛋白的抑制作用
徐亚娟孙旭1李烁烯2段秀梅2李树蕾1刘文书2
(吉林省肿瘤医院,吉林长春130012)
摘要〔〕目的探讨CKS1 siRNA对人舌鳞状细胞癌Tca8113细胞中CKS1蛋白的干扰作用。方法设计特异性CKS1插入序列,转入Tca8113细胞,应用免疫组化、RT-PCR、Western印迹检测Tca8113细胞中CKS1蛋白的表达。结果CKS1 siRNA成功导入并抑制了Tca8113细胞中CKS1蛋白的表达(P<0.05)。结论CKS1 siRNA能抑制Tca8113细胞中CKS1蛋白的表达,应用CKS1 siRNA治疗舌癌具有可行性。
关键词〔〕CKS1 siRNA;Tca8113细胞;免疫组化;反义RNA ;CKS1蛋白
中图分类号〔〕R739〔
基金项目:吉林省发展和改革委员会资助项目(JF2012C006-8)
通讯作者:刘文书(1966-),男,副教授,硕士生导师,主要从事颌面部肿瘤基础和临床研究。
1吉林大学临床医学院2吉林大学第一医院
第一作者:徐亚娟(1965-),女,主任医师,主要从事颌面部肿瘤的临床研究。
CKS1蛋白在恶性肿瘤中的表达增高,可通过对泛素化蛋白的降解,促进肿瘤的发生和发展〔1〕。siRNA可与核糖核酸酶复合物结合形成由RNA诱导的基因沉默复合体,引起转录后基因沉默〔2〕。本实验前期已经发现舌癌中的CKS1蛋白在舌癌中高表达,本研究旨在进一步探讨其应用于舌癌基因治疗的可能性。
1材料与方法
1.1材料人舌癌细胞Tca8113购自北京博枫科生物科技有限公司。小鼠抗人CKS1抗体、RNA提取试剂盒购自美国Invitrogen公司;SP试剂盒、DAB试剂盒购自福建迈新生物技术开发公司;DMEM培养基(美国,Gibco)、胎牛血清(以色列)购自沃特司公司;siRNA-MateTM转染试剂盒购自上海GenePharma公司;RAPI裂解液、BCA试剂盒购自上海碧云天生物技术有限公司;RT-PCR试剂盒购自北京鼎国生物技术有限公司。所用引物由上海生工生物公司合成。
1.2CKS1 siRNA转染根据GenBank中CKS1 mRNA全序列,在Reyn-okls设计原则基础上,选取针对编码区的两端序列作为RNA干扰靶序列,使用Ambion在线设计软件设计并选取基因特异性插入片段序列。设计引物:5′-UGGAGGAAUCUUGGCGUUCUUTT-3′ (有意义链),5′-UUCUUCGAACGUGUCACGUTT-3 (对照链),将siRNA序列进行2′Ome修饰和5′FAM修饰。体外培养细胞至2.5×104个/ml,并提前1 d将细胞接种在24孔板中,待细胞的汇合度在30%~50%采用siRNA-MateTM转染试剂盒将CKS1 siRNA导入Tca8113细胞(严格按转染试剂盒说明书进行)。37℃,CO2培养箱孵育48 h后倒置显微镜下,采用同一个视野相同放大倍数进行普通光源和荧光观察并拍照,共检测三张不同爬片,检测3个不同的视野。在合成图像中计数绿色荧光细胞,计算转染效率。转染效率=(绿色荧光细胞/总细胞数)×100%。
1.3CKS1干扰效率检测
1.3.1转染前后的免疫细胞组织化学染色检测将转染前后的Tca8113分别接种于盖玻片表面,待细胞达到70%汇合时,用4%多聚甲醛固定,然后采用免疫组织化学方法对CKS1蛋白标记(按抗体说明书进行),以PBS液代替一抗作为阴性对照。最后用DAB显色,苏木精复染,显微镜下观察。每张图片测量3个不同的视野,每组检测3张不同的细胞爬片,用软件IPP6.0分析平均光密度。
1.3.2转染前后的RT-PCR检测用Trizol提取转染前后Tca8113细胞中的总RNA,根据NCBI-GenBank中公布的CKS1基因全序列确定扩增目的基因片段。根据引物设计原则,应用Primer 5.0软件设计引物:CKS1-正义:5′-CCCACTACCCAAGAAACCAA-3′,CKS1-反义:5′-CCGCAAGTCACCACACATAC-3′; 利用RT-PCR试剂盒进行扩增,扩增产物经1.0%琼脂糖凝胶电泳检测,CKS1的PCR产物为406 bp。图像经Image J软件分析灰度值,进行半定量分析,各组之间的比较以相差2倍上认定为有显著性差异。
1.3.3转染前后Western印迹检测用含1 mmol/L苯甲基磺酰氟(PMSF)的RAPI裂解液提取Tca8113细胞总蛋白,采用二喹啉甲酸(BCA)试剂盒检测蛋白浓度(按试剂盒说明书操作),调整蛋白浓度使之一致,等量的蛋白质经变性后进行十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳,最后采用Western印迹和二氨基联苯胺(DAB)法检测蛋白。图像经Image J软件分析灰度值,进行半定量分析,各组之间的比较以相差2倍以上认定为有显著性差异。
1.4统计学方法采用SPSS11.0进行t检验。
2结果
2.1CKS1 siRNA转染前后的Tca8113细胞表达 转染前Tca8113细胞呈上皮样,有突起,胞质清亮,可见居中的细胞核及明显的核仁,细胞生长状态良好(图1A)。在荧光显微镜下,CKS1 siRNA转染后的Tca8113细胞胞体较大,突起明显减少(图1B);同一个视野相同放大倍数条件下的荧光观察发现,转染后的Tca8113细胞的荧光强度明显增强(图1C)。CKS1 siRNA的转染率通过合成图像中绿色荧光细胞的数量来计算(图1D),转染效率=绿色荧光细胞/总细胞数×100%=95%符合实验要求。
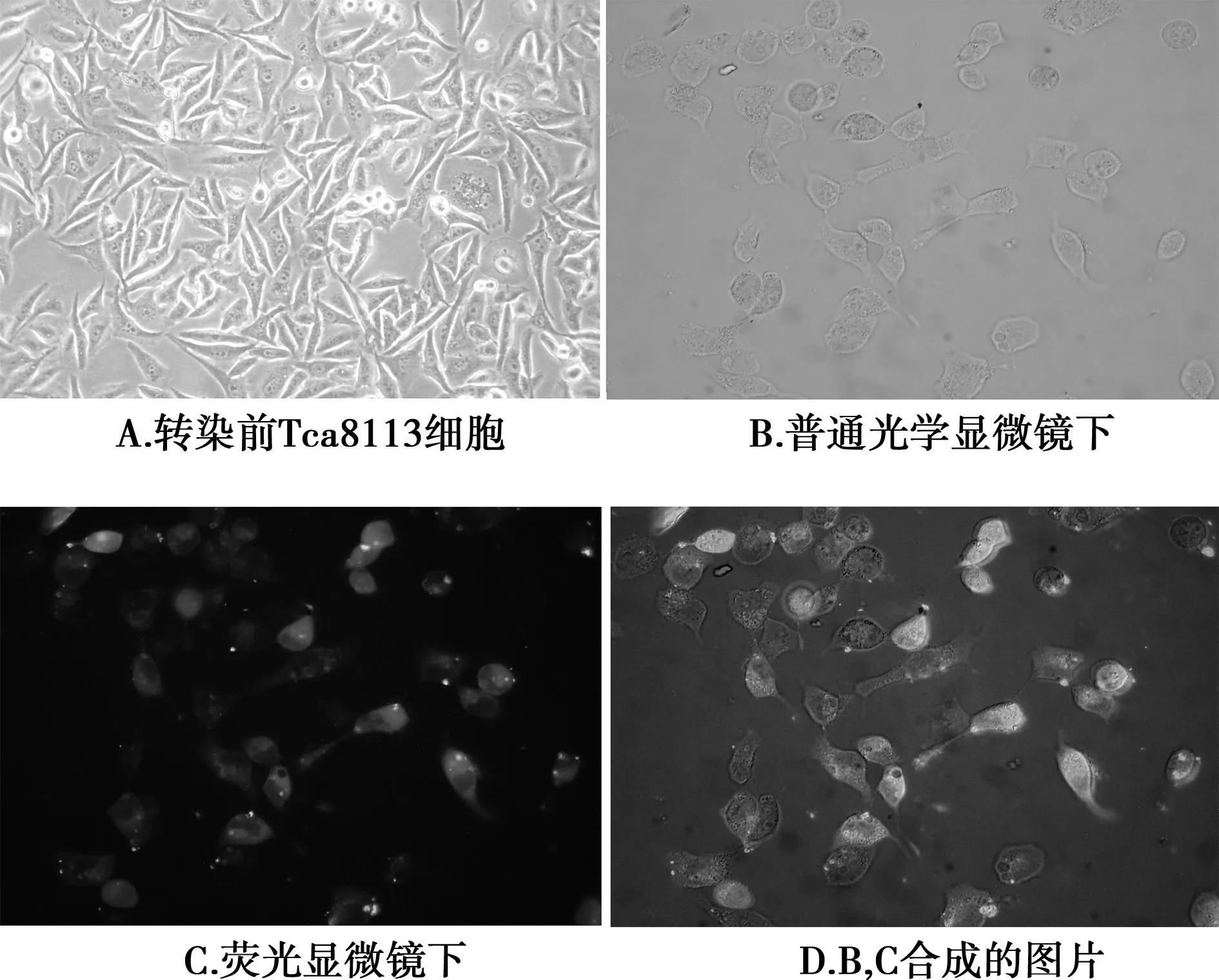
图1 CKS1 siRNA转染前后Tca8113细胞的表达
2.2转染前后的细胞免疫组织化学染色转染前Tca8113细胞质内CKS1蛋白表达丰富,灰度值为52 521 700±7 163.689 5。转染后细胞质内CKS1表达明显减少,灰度值35 201 480±9 052.124,转染前后比较差异有统计学意义(P<0.05)。见图2。
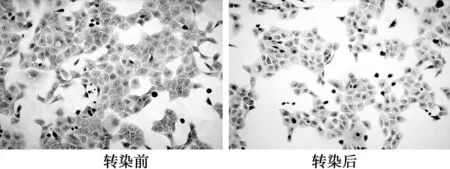
图2 转染前后CKS1在 Tca8113细胞中的表达
2.3转染前后的RT-PCR检测转染CKS1 siRNA组的CKS1 mRNA表达明显低于空白对照组和阴性对照组(P<0.05)。见表1,图3。
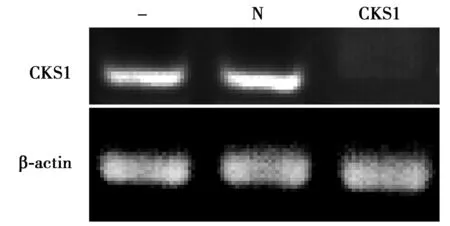
-:空白对照组;N:阴性对照组; CKS1:转染siRNA组;下图同 图3 RT-PCR检测CKS1 mRNA表达

组别β-actinCKS1CKS1/β-actin空白对照组56.491±4.89241.176±2.151)4.271)阴性对照组45.918±5.22291.068±1.721)6.331)转染siRNA组41.78±3.965.661±0.390.14
与转染siRNA组比较:1)P<0.05,下表同
2.4转染前后Western印迹检测转染48 h后细胞中CKS1蛋白明显减少,与空白对照组和阴性对照组相比差异显著(P<0.05),提示CKS1蛋白质的合成受阻,但尚有部分CKS1存在。见表2,图4。

图4 Western印迹检测CKS1蛋白表达

组别GAPDHCKS1空白对照组15869.985±14.115299.45±25.031)阴性对照组15170.902±10.344492.23±15.581)转染siRNA组16211.425±18.952246.32±14.52
3讨论
CKS1基因位于人染色体8q21,其相对分子量为9×103,全长有717 bp序列,其中240 bp碱基有编码作用,可编码79个氨基酸〔3〕;是高度保守的Sucl/CKS的家族成员,可通过结合其他周期蛋白依赖性激酶或磷酸化的蛋白调控细胞周期,在细胞有丝分裂过程中,特别是G1期和M期尤为重要〔4〕。 CKS1在很多癌组织中异常表达,陈绍发〔5〕在研究肝癌中发现,CKS1在肝组织中表达增高,明显高于癌旁组织,且随着临床病理分级的升高,其表达出现明显的增高。赵勇等〔6〕检测了直肠癌组织中的CKS1蛋白的表达,结果其在癌组织中获得了高表达且与肿瘤的分化程度相关。Slotky等〔7〕在乳腺癌研究中发现,CKS1的表达水平随着肿瘤的恶性程度和年龄的增长而增高,且与术后复发有关。本研究表明转染CKS1 siRNA能有效降解细胞内的CKS1 mRNA,进而降低CKS1蛋白在舌癌中的表达。因此,将CKS1 siRNA用于舌癌的靶向治疗,可为临床治疗舌癌提供新的思路和方法。
4参考文献
1Lan Y,Zhang Y,Wang F,etal.Aberrant expression of cks1 and cks2 contributes to prostate tumorigenesis by promoting proliferation and inhibiting programmed cell death〔J〕.Int J Cancer,2008;123(4):543-51.
2房宝英.siRNA及其导入体内外方法的研究进展〔J〕.国际病理科学与临床杂志,2006;27(1):44-7.
3陈紫萱,黄如欣,张忠英.Cks1蛋白在恶性肿瘤中的研究进展〔J〕.检验医学与临床,2009;6(9):705-6.
4Tsai YS,Chang HC,Chuang LY,etal.RNA silencing of Cks1 induced G2/M arret and apoptosis in human lung cancer cells〔J〕.IUBMB Life,2005;57(8):583-9.
5陈绍发.Cks1和CyclinD1在老年肝细胞癌中的表达〔J〕.中国老年学杂志,2013;9(33):4556-7.
6赵勇,高建飞,章必成,等.结直肠癌中Cks1、p27kip1和 Skp2蛋白的表达〔J〕.第四军医大学学报,2006;27(2):168-9.
7Slotky M,Shapira M,Izhak OB,etal.The expression of the ubiquitin ligase subunit Cks1 in human breast cancer〔J〕.Breast Cancer Res,2005;7(5):737-44.
〔2013-11-03修回〕
(编辑徐杰)
