苦参碱对胃癌SGC7901/DDP细胞耐药相关miRNA表达的影响和靶点分析
2015-12-30李海龙,陈兆峰,刘敏等
苦参碱对胃癌SGC7901/DDP细胞耐药相关miRNA表达的影响和靶点分析
李海龙1陈兆峰2刘敏2杨雅丽1王晶1吴红彦1
(甘肃中医药大学,甘肃兰州730000)
摘要〔〕目的探讨苦参碱对化疗药物的增敏作用和机制。方法以非毒性剂量的苦参碱联合长春新碱、阿霉素、5-氟尿嘧啶干预胃癌SGC7901/DDP细胞,观察苦参碱对胃癌SGC7901/DDP细胞耐药性的增敏作用;采用实时荧光定量PCR观察苦参碱干预后耐药相关miRNA的表达,并应用生物信息学方法预测和分析相关miRNA的靶基因和信号通路,应用GO分析方法进行了靶基因的功能注释。结果苦参碱可以增强胃癌SGC-7901/DDP细胞对化疗药物的敏感性,逆转耐药;苦参碱可以剂量依赖性上调耐药相关mir-7、mir-125b、mir-200a、mir-200b、mir-200c、mir-146a的表达,生物信息学方法预测和分析了其靶基因和相关信号通路,并筛选出耐药相关miRNA靶向调控的耐药基因和DNA修复基因,为苦参碱克服胃癌化疗多药耐药提供了靶点。结论苦参碱可以增强胃癌SGC-7901/DDP细胞对化疗药物的敏感性;其作用可能与苦参碱可以上调耐药相关mir-7、mir-125b、mir-200a、mir-200b、mir-200c、mir-146a的表达,并通过miRNA靶向调控的耐药基因和DNA修复基因有关。
关键词〔〕苦参碱;SGC7901/DDP;肿瘤多药耐药;miRNA
中图分类号〔〕R73-36+1〔文献标识码〕A〔
基金项目:甘肃省中药药理与毒理实验室开放课题(No.ZDSYS-KJ-2012-003);中医学院中青年项目(BH2010-071)
1甘肃省中药药理与毒理学重点实验室甘肃省中药新产品创制工程实验室甘肃省中医方药挖掘与创新转化重点实验室
2兰州大学第一医院消化内科
第一作者:李海龙(1975-),男,副教授,主要从事中药抗肿瘤药理研究。
多药耐药性(MDR)是指肿瘤细胞对一种抗肿瘤药物产生抗药性的同时,对结构和作用机制不同的多种抗肿瘤药物亦产生交叉耐药现象,从而大大降低了抗肿瘤药物的疗效。苦参碱是豆科槐属植物苦参和广豆根中分离出来的一种生物碱,具有抑制肿瘤细胞增殖、促进肿瘤细胞凋亡以及诱导肿瘤细胞分化的作用等多方面的药理作用和功效,其中有研究表明氧化苦参碱或苦参碱可以逆转多种肿瘤细胞的耐药性〔1~4〕。近来发现有microRNA通过调节一些相关的基因参与了肿瘤细胞耐药现象的发生〔5〕。本研究分析苦参碱调节胃癌SGC-7901/DDP对化疗药物敏感作用及其对胃癌SGC7901/DDP细胞耐药相关miRNA表达的影响和生物信息学。
1材料与方法
1.1材料RPMI1640 (GIBCO公司),小牛血清(兰州荣晔生物公司)、四唑盐(MTT,Sigma公司)、二甲基亚砜(DMSO,Sigma公司)、苦参碱(陕西宝鸡方晟生物公司)、顺铂(DDP)、阿霉素(ADM,深圳万乐药业有限公司,批号:1104E1)、长春新碱(VCR,浙江海正药业股份有限公司,批号:110101)、5-氟尿嘧啶(5-FU,旭东海普,批号:110305)、SGC7901/DDP购自上海博谷生物公司。
1.2细胞培养及实验分组SGC7901/DDP细胞接种于含10% 小牛血清的RPMI-1640培养液,在培养体系中加入终浓度为1 mg/L的DDP以维持耐药性,置37℃,5%CO2,饱和湿度培养箱中培养,每3 d换液传代培养。实验前无药培养2 w。以SGC7901/DDP为实验模型加不同浓度苦参碱为实验组,每组各设3个平行实验。
1.3MTT法检测细胞药敏性及对化疗药物的增敏作用取对数生长期的两种细胞,用0.25%胰酶消化,用RPMI-1640培养液制备成单细胞悬液,计数后接种于96孔培养板中,每孔细胞数为1×104个,体积为200 μl。细胞培养过夜,使细胞处于对数生长期。在96孔板中加入非细胞毒性药物剂量的苦参碱,参照VCR、ADM及5-FU的血浆高峰浓度(VCR 0.5 μg/ml,ADM 0.4 μg/ml,5-FU 10 μg/ml)加入不同浓度(0.01,0.1,1,10,100×PPC)的各化疗药物。于37℃,5%CO2下培养48 h,每孔加入新配置的MTT 20 μl,37℃下再培养4 h,终止培养,弃去上清液;每孔加入DMSO150 μl,振荡10 min,使结晶物充分溶解。选择570 nm波长在酶标仪上检测,取每3个平行孔A570 nm值的平均数,采用常规MTT法,计算抑制率,确定抑制率≤10%的药物浓度为该药的非细胞毒性浓度。
1.4实时荧光定量PCR法检测胃癌SGC7901/DDP细胞耐药相关miRNA的表达采用TRIzol试剂从细胞中提取总RNA,检测RNA的含量和纯度(A260 nm/A280 nm=1.8~2.0)。以1%琼脂糖凝胶电泳鉴定其完整性(28 S和18 S RNA条带比值≥2.0)。用1 μg细胞总RNA进行miRNA逆转录,以U6 snRNA 作为内参,通过2-ΔΔCT法计算各浓度苦参碱SGC7901/DDP 细胞与SGC7901/DDP细胞之间目标miRNA表达水平的差异(以比值表示,SGC7901/DDP细胞的目标 miRNA 表达水平设为1)。其中ΔΔCt=ΔCt干预后SGC7901/DDP-ΔCt SGC7901/DDP;ΔCt=Ct miRNA-Ct U6。Ct 为反应的实时荧光强度达到设定的阈值时所经过的扩增循环数,此时扩增是呈对数期增长。实验重复三次,U6、mir-7、mir-125b、mir-200a、mir-200b、mir-200c、mir-146a特异性引物由基因复能生物公司设计合。
1.5miRNA靶基因的生物信息学分析对mir-7、mir-125b、mir-200a、mir-200b、mir-200c、mir-146a的靶基因使用mirfocus网站的生物信息学软件进行预测分析,信号通路分析采用KEGG Pathway、Biocarta Pathway软件富集分析,并对靶基因进行了基因功能注释即GO分析,检验水准为P<0.05。
1.6miRNA靶向调控的耐药基因的生物信息学分析应用以mirWALK网站的生物信息学分析软件miRanda、miRDB、miRWalk、RNA22、TargetScan检索筛选靶向调控耐药基因:ABCB1 (MDR1),ABCC1 (MRP1),ABCC2 (MRP2),ABCC3 (MRP3),ABCC5 (MRP5),ABCG2 (BCRP),BAX,BCL2,BCL2L1 (BCL-X),MVP (LRP),RB1,TOP1,TOP2A,TOP2B,TP53,和DNA修复基因APC,ATM,BRCA1,BRCA2,ERCC3,MSH2,XPA,XPC的miRNA,其中包含生物信息学预测的miRNA靶基因,也包括已经生物学验证的miRNA靶基因,以检索出的结果至少需要三个软件分析支持才列为筛选结果。
1.7统计学处理采用SPSS17.00软件行方差分析和t检验。
2结果
2.1苦参碱对胃癌SGC7901/DDP耐药细胞增殖的影响苦参碱体外处理SGC7901/DDP耐药细胞后,SGC7901/DDP细胞增殖被明显抑制。随着苦参碱剂量的增加抑制作用逐渐增强。当0.5,1.0,1.5和2.0 mg/L的苦参碱作用SGC7901/DDP细胞24 h时,SGC7901/DDP细胞增殖抑制率分别达到(8.78±1.15)%、(27.65±3.68)%、(48.98±5.24)%和(74.35±6.50) %。
2.2苦参碱对UCR、ADM和5-FU干预SGC7901/DDP耐药细胞的增敏作用0.5 mg/L的苦参碱联合不同浓度(0.01,0.1,1,10,100倍PPC)的VCR、ADM和5-FU干预后,对SGC7901/DDP耐药细胞的抑制率明显高于单纯以同浓度的VCR、ADM和5-FU干预。见表1。
2.3苦参碱对SGC7901/DDP细胞耐药相关miRNA表达的影响不同浓度的氧化苦参碱干预SGC7901/DDP细胞后,mir-7、mir-125b、mir-200a、mir-200b、mir-200c、mir-146a的表达均出现了明显的剂量依赖性上调表达(P<0.01)。见表2。
2.4miRNA靶向调控的耐药基因的生物信息学分析分析结果见表3、图1。
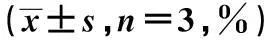
表1 苦参碱联合VCR、ADM和5-FU干预SGC7901/DDP耐药细胞的增殖抑制率
与单纯同浓度VCR、ADM、5-FU比较:1)P<0.01
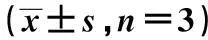
表2 苦参碱对SGC7901/DDP细胞耐药相关miRNA
与对照组比较:1)P<0.01,2)P<0.001

表3 SGC7901/DDP细胞耐药相关miRNA的靶向调控耐药
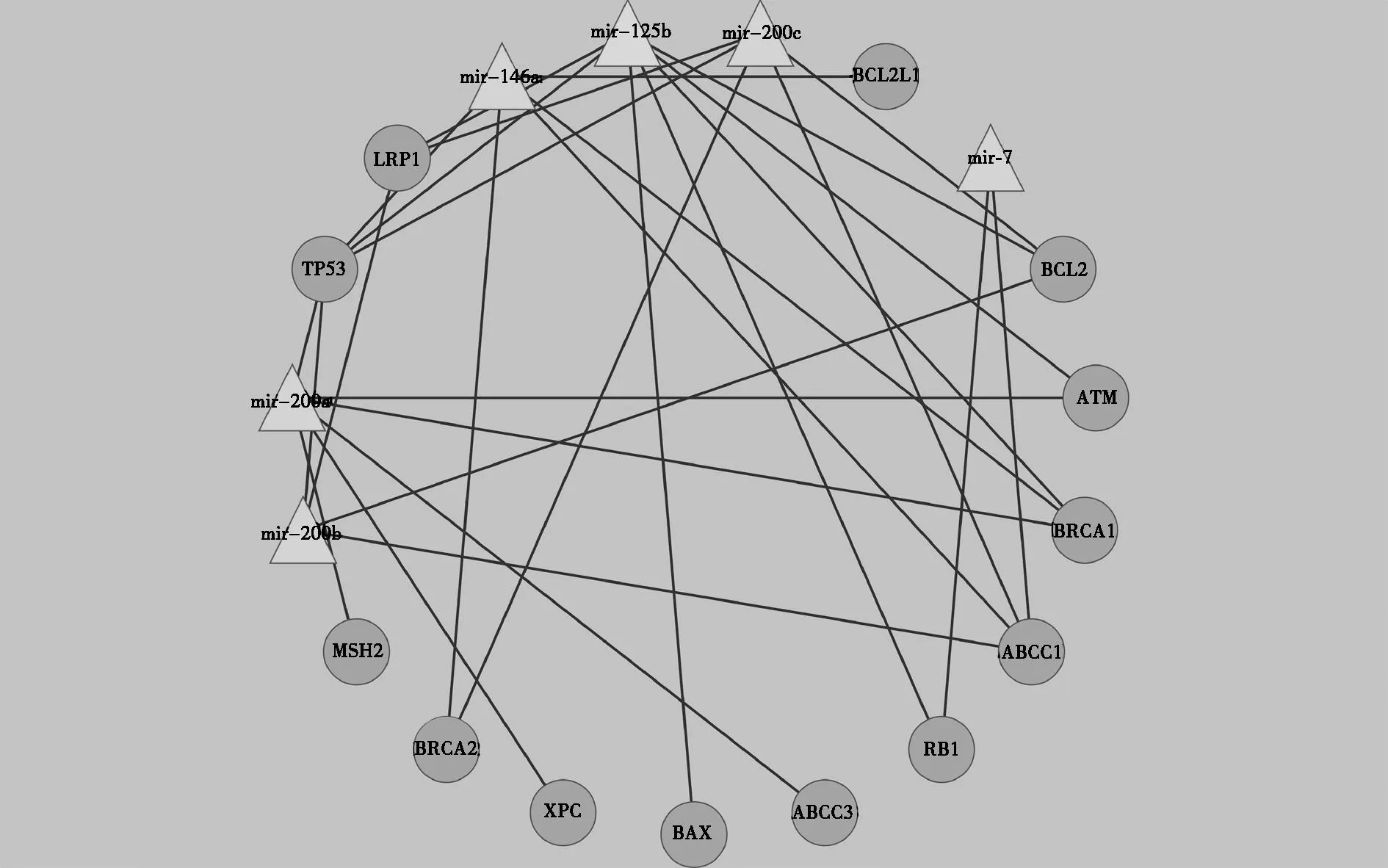
图1 miRNA与靶向调控的耐药基因的network
3讨论
肿瘤多药耐药是临床化疗失败的主要原因之一,但其耐药性机制至今尚未完全阐明。MicroRNA(miRNA)是一类长度为18~25个核糖核苷酸的非编码内源性单链小分子RNA,由基因组DNA编码,与靶标基因 3′非翻译区(3′UTR)不完全互补结合,进而抑制翻译;或与靶标基因 3′UTR 完全互补结合,最后导致靶 mRNA 的降解,从而对基因进行转录后表达的调控〔6〕。microRNA在多种生理和病理过程中发挥作用,大约50%的microRNA位于肿瘤相关的基因组区〔7〕。miRNA对多基因表达的调控具有高效性和特异性,对靶基因的异常调控可能构成肿瘤耐药机制,是肿瘤耐药复杂性调控的重要构成部分。例如,在胃癌中均发现一些 microRNA 参与了肿瘤耐药〔8~10〕。
因此,探讨增强DDP、5-FU等化疗药物的敏感性,降低耐药性对肿瘤化疗意义重大,而逆转DDP、5-FU的miRNA耐药标志物,是逆转肿瘤耐药,增强化疗敏感性的重要手段,本研究显示,苦参碱干预SGC7901/DDP细胞24h后,mir-7、mir-125b、mir-200a、mir-200b、mir-200c、mir-146a出现剂量依赖性的升高,生物信息学分析这些miRNA上调之后,所靶向调控的基因有数百个之多,信号通路涉及数十个,基因功能分类涉及肿瘤代谢、增殖、耐药等多各方面,经mirwalk网站的生物信息学软件检索并筛选,其靶向调控的耐药基因有ABCB1 (MDR1),ABCC1 (MRP1),ABCC2 (MRP2),ABCC3 (MRP3),ABCC5 (MRP5),ABCG2 (BCRP),BAX,BCL2,BCL2L1 (BCL-X),MVP (LRP),RB1,TOP1,TOP2A,TOP2B,TP53;DNA修复基因有APC,ATM,BRCA1,BRCA2,ERCC3,MSH2,XPA,XPC。
陈勇等〔11,12〕使用microRNA 芯片检测出胃癌DDP耐药 SGC7901/DDP 细胞及其亲本SGC7901之间 microRNA的表达差异,其中microRNA-200c下调超过了两倍,智慧〔13〕应用microRNA 芯片与对照的SGC-790细胞相比,SGC7901/VCR 细胞中miR-125b表达下调倍数为2.12倍;Wu等〔14〕用SRB方法分析6个羟喜树碱(HCPT)耐药性胃癌细胞株(BGC-823,SGC-7901,MGC-803,HGC-27,NCI-N87和AGS)对羟喜树碱的敏感性,在耐药性细胞株中有25种miRNA产生异常,其中miR-200家族和miR-7出现下调表达,转染 miR-125b模拟物可显著上调耐药细胞中miR-125b表达水平,并显著增加耐药细胞对化疗药物的敏感性,荧光素酶实验证实BCL2,MCL1是miR-125b的靶基因;上调microRNA-200c 的表达能显著增加 SGC7901/DDP细胞在体外对DDP、ADM、5-FU及紫杉醇四种抗肿瘤药物的敏感性,发挥化疗增敏作用。因此,针对耐药相关的microRNA,进行过表达或抑制手段,是克服肿瘤耐药的重要方法,但其缺憾是只能针对单个靶点干预;而运用中药干预的优势明显,其针对microRNA多靶点的干预可调控若干耐药基因表达实现化疗增敏和克服耐药。另外,苦参碱干预 SGC7901/CDDP细胞后,可通过miRNA引起的差异表达的非耐药靶基因则数量庞大,所实现的功能调节也涉及若干方面,尤其对mir-200a、mir-200b的表达影响尤其显著。
4参考文献
1彭向前,张文会,李军.氧化苦参碱逆转多药耐药细胞系K562/A02耐药性的研究〔J〕.中国肿瘤临床,2008;35(19):1127-30.
2吕建裕.氧化苦参碱逆转人乳腺癌多药耐药细胞株MCF-7/ADM耐药的研究〔D〕.山西医科大学,2010.
3张裴.生物碱类胃癌多药耐药逆转剂的筛选及机制研究〔D〕.新疆医科大学,2012.
4孙亭立,廖传文,曹虹,等.苦参碱逆转人胃癌细胞株SGC7901/VCR耐药性实验研究〔J〕.南昌大学学报(医学版),2010;50(7):15-7,27.
5陈建,王朝霞.微小RNA:肿瘤耐药治疗新靶点〔J〕.现代肿瘤医学,2012;20(12):191-6.
6Zeng Y,Cullen BR.Sequence requirements for microRNA processing and function in human cells〔J〕.RNA,2003;9(1):112-23.
7Calin GA,Sevignani C,Dumitru CD,etal.Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers〔J〕.Proc Natl Acad Sci USA.2004;101(9):2999-3004.
8Zhu W,Xu H,Zhu D,etal.miR-200bc/429 cluster modulates multidrug resistance of human cancer cell lines by targeting BCL2 and XIAP〔J〕.Cancer Chemother Pharmacol,2012;69(3):723-31.
9Chen Y,Zuo J,Liu Y,etal.Inhibitory effects of miRNA-200c on chemotherapy resistance and cell proliferation of gastric cancer SGC7901/DDP cells〔J〕.Chin J Cancer,2010;29(12):1006-11.
10Xia L,Zhang D,Du R,etal.miR-15b and miR-16 modulate multidrug resistance by targeting BCL2 in human gastric cancer cells〔J〕.Int J Cancer,2008;123(2):372-9.
11陈勇,左静,张西志,等.miRNA-200c通过抑制Akt通路提高胃癌SGC7901/DDP细胞对顺铂的敏感性〔J〕.中国肿瘤生物治疗杂志,2012;(6):582-7.
12刘庆伟.ZNF139、MRP1、MMP7在人胃癌细胞SGC7901及SGC7901/ADR中的表达及与化疗药物敏感性的关系〔D〕.河北医科大学,2012.
13智慧.miR-125b在胃癌细胞耐药中的作用及分子机制〔D〕.南京医科大学,2012.
14Wu XM,Shao XQ,Meng XX,etal.Genome-wide analysis of microRNA and mRNA expression signatures in hydroxycamptothecin-resistant gastric cancer cells〔J〕.Acta Pharmacol Sin,2011;32(2):259-69.
〔2014-04-17修回〕
(编辑安冉冉/曹梦园)
