单环刺螠体壁多糖的分离纯化、理化性质及抗脂质过氧化活性
2015-12-29朱佳利陈依莎牛庆凤
朱佳利,陈依莎,牛庆凤,李 涛,陈 荫*
单环刺螠体壁多糖的分离纯化、理化性质及抗脂质过氧化活性
朱佳利,陈依莎,牛庆凤,李 涛,陈 荫*
(浙江海洋学院食品与医药学院,浙江 舟山 316022)
为研究和开发单环刺螠中活性多糖成分,采用酶法提取和色谱分离技术,从单环刺螠的体壁中提取分离 多糖组分,采用化学和仪器分析方法对其单糖组成、分子质量等理化性质进行研究,并通过体外清除脂质过氧化物实验对其进行初步的活性评价。结果表明:采用木瓜蛋白酶和胰蛋白酶两步酶解后,单环刺螠多糖(unicinctus polysaccharide,UP)得率为5.3%。通过离子交换柱层析分离纯化后主要得到两个组分UP-1和UP-2。UP-1是主要由葡萄糖(Glc)组成的高聚葡聚糖,分子质量340 kD,而UP-2为组成复杂的类糖胺聚糖,分子质量约为7.9 kD,主要含有葡萄糖(Glc)、半乳糖(Gal)、氨基葡萄糖(GlcN)和岩藻糖(Fuc),还含有少量的甘露糖(Man)和氨基半乳糖(GalN)。其单糖组成Man、GlcN、GalN、Glc、Gal、Fuc物质的量比例为1.0∶1.47∶0.64∶6.49∶2.5∶3.0。和其他海洋动物来源类糖胺聚糖类似,UP-2还含有少量的硫酸基,含量为7.4%。对UP-1和UP-2进行初步体外抗氧化活性研究表明,类糖胺聚糖UP-2具有显著的脂质过氧化物清除活性,半数清除质量浓度为5.0 mg/mL。
单环刺螠;多糖;分离纯化;理化性质;抗氧化
单环刺螠(U rechis unicinctus)为螠虫动物门螠纲无管螠目刺螠科动物,是无管螠目在我国沿海分布的唯一种类,俗称“海肠子”。单环刺螠个体肥大,肉味鲜美,体壁肌富含蛋白质和多种人体必需氨基酸,经常食用海肠能够起到温补肝肾、壮阳固精的作用。自古以来,我国、日本和朝鲜沿海地区的居民均将单环刺螠作为名贵的海鲜食品,有较高的经济价值。胶东地区是我国单环刺螠的最大产地,是一种极有养殖开发前景的海洋动物资源[1]。
研究[2-4]表明:单环刺螠体内含有多种生物活性肽,如纤溶酶、速激肽和其他的一些多肽类,具有一定的抗肿瘤及提高小鼠免疫功能及抗血栓的活性。因此作为一种研究海洋生物活性物质的良好材料,开展针对单环刺螠活性物质的研究,对开发海洋药用生物资源,促进其养殖产业的发展和提高经济产值起到积极的推动作用。单环刺螠由于其丰富的营养价值又被人们称为“裸体海参”,而海参多糖是海参中重要的活性成分,多糖也是很多海洋动物中的主要的活性物质,具有多种生物活性。本实验对单环刺螠体壁中的多糖进行提取分离纯化和理化性质研究,为其多糖类活性物质的开发提供重要参考。
1 材料与方法
1.1 材料与试剂
单环刺螠购于青岛齐东路水产市场,由浙江海洋学院赵盛龙教授鉴定确认。
单糖标准品、牛血清蛋白标准品 美国Sigma公司;不同分子质量葡聚糖标准品 美国Fluka公司;Folin-酚乙液、重蒸酚 北京鼎国生物工程公司;95%乙醇、丙酮、浓硫酸、咔唑、四硼酸钠、对二甲氨基苯甲醛、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)、酒石酸钾钠、碳酸钠、硫酸铜、硫酸钾、硫酸钠、三氟乙酸、溴化钾、硫代巴比妥酸、乙酰丙酮等均为分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
TD5K低速大容量离心机 长沙东旺实验仪器有限公司;HH-1型恒温水浴锅 国华电器有限公司;UV-1100型紫外-可见分光光度计 上海美谱达仪器有限公司;AKTA FPLC快速蛋白质液相色谱仪 瑞典Pharmacia Biotech公司;1260高效液相色谱仪 美国Agilent公司;Nicolet 5700傅里叶红外光谱仪 美国Thermo Nicolet公司;FD-1000真空冷冻干燥机、旋转蒸发仪 上海爱朗仪器有限公司;Model 818数字pH计上海奥立龙公司;FD-1C-50冷冻干燥机 北京博医康实验仪器有限公司。
1.3 方法
1.3.1 单环刺螠体壁多糖的提取[5]
单环刺螠从一端剪开后弃掉体腔液和内脏并用清水洗净,剪碎后匀浆。丙酮搅拌脱脂过夜,离心弃去上清液,沉淀40 ℃烘干过夜后粉碎。取单环刺螠体壁粉按1∶20(g/mL)加入蒸馏水,并调节pH 8~9于80 ℃碱化12 h,然后调节pH 6.8,加入质量分数1%木瓜蛋白酶在60 ℃水浴中消化4 h,接着采用胰蛋白酶水解3 h、提取温度60 ℃、pH 10、加酶量0.5%(质量分数)。提取完成后调pH值至中性后100 ℃水浴加热15 min灭酶。两步酶解以保证多糖分子充分的释放和溶解。在离心机中4 500 r/min离心20 min后取上清液,减压浓缩至原体积的1/20后,使用95%乙醇沉淀多糖,使乙醇终体积分数约为80%,于4 ℃冰箱中放置过夜。离心后获得的多糖重新溶解后采用截留相对分子质量为3 500的透析袋于纯水中连续透析2 d后浓缩后冷冻干燥。采用Seveg法除蛋白后得到单环刺螠多糖(unicinctus polysaccharide,UP)。
1.3.2 单环刺螠体壁多糖的分离纯化
将粗多糖溶于少量蒸馏水中,配制成50 mg/mL多糖溶液,在AKTA FPLC快速蛋白纯化系统上,采用阴离子交换柱Q Sepharose Fast Flow柱(2.6 cm×50.0 cm)以0~2 mol/L的NaCl溶液线性洗脱,根据线性洗脱结果确定梯度洗脱的条件,自动部分收集(每管收集7 mL)后以苯酚-硫酸法检测各梯度中多糖组分的位置,分别收集相应梯度的多糖组分,透析脱盐后浓缩冻干得纯化后多糖样品。
1.3.3 单环刺螠体壁多糖的单糖组成分析
海洋动物多糖中一般单糖组成比较复杂,本实验采用完全酸水解后PMP柱前衍生高效液相色谱法分析其单糖组成。采用PMP衍生化方法[6],对等浓度配制的单糖标准品和各多糖全水解后产物进行PMP衍生,然后进行液相色谱分析。色谱条件为:Agilent XDB-C18色谱柱;柱温:35 ℃;流动相:磷酸盐缓冲液(pH6.7)-CH3CN(83∶17,V/V);流速:1.0 mL/min;检测器:二极管阵列检测器(diode array detector,DAD)(245 nm)。
1.3.4 单环刺螠体壁多糖的分子质量分布
采用高效凝胶渗透色谱法[7]分析单环刺螠多糖的纯度及分子质量范围,色谱条件:色谱柱:Shodex Ohpak SB-804HQ凝胶色谱柱(300 mm×7.8 mm);柱温:35℃;流动相:0.1 mol/L的Na2SO4溶液;流速:0.5 mL/min;检测器:示差检测器(refractive index detector,RID)。
1.3.5 单环刺螠体壁多糖的理化性质研究
以葡萄糖为标准品,采用硫酸-苯酚法测定总糖含量[8]。以牛血清蛋白为标准品,采用Folin-酚法测定蛋白含量[9]。以葡萄糖醛酸作为标准品,采用咔唑-硫酸法测定糖醛酸含量[10]。以硫酸钾为标准品,采用氯化钡-明胶比浊法测定硫酸根含量[11]。采用Elson-Morgan法,以氨基葡萄糖为标准测定氨基糖含量[12]。
1.3.6 单环刺螠体壁多糖的红外光谱分析
采用KBr压片法,将约为0.1 mg多糖样品与适量干燥溴化钾粉末研磨混合均匀后,研制成透明薄片在Nicolet Nexus 470型红外光谱进行测定。红外光谱仪测定参数:背景扫描次数32次;扫描范围400~4 000 cm-1;分辨率4.0 cm-1;检测器:氘化三甘氨酸硫酸酯检测器(deuterated triglycine sulfate detector detector,DTGS)[13]。
1.3.7 抗脂质过氧化活性分析
用0.1 mol/L pH 7.45的磷酸盐缓冲液(phosphate buffered saline,PBS)配制卵黄悬液(V(卵黄)∶V(PBS) = 1∶25),吸取卵黄悬液0.4 mL,在试管中分别加入不同质量浓度(0、2、4、6、8、10 mg/mL)的被测溶液1.0 mL,再加入0.4 mL 25 mmol/L的硫酸亚铁,用0.1 mol/L pH 7.45的PBS补充至4 mL,37 ℃水浴恒温振荡器中振荡15 min,取出后加入1.0 mL 20%的三氯乙酸静置10 min,3 500 r/min离心10 min,吸取4 mL上清液加入2 mL 0.8%的硫代巴比妥酸,加塞,放入沸水浴中15 min,冷却后,以空白管(6 mL PBS代替)调零,532 nm波长处比色测定吸光度;不加样品管的吸光度A0,样品管的吸光度A,以2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)作为阳性对照,样品抗氧化活性用对卵黄脂蛋白脂质过氧化的抑制率表示[14],即:
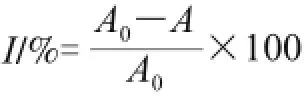
式中:I为抑制率/%;A0为对照管的吸光度;A为样品的吸光度。
2 结果与分析
2.1 单环刺螠体壁多糖的提取与分离纯化
动物中含有丰富的蛋白质,很多动物多糖和蛋白质通过共价键相连接,蛋白酶水解法和碱水解是目前动物多糖提取过程中使蛋白质和聚糖分离广泛应用的两种方法。碱提多糖是基于蛋白多糖中的糖肽键对碱的不稳定性,但也存在部分糖苷键降解的问题,浓度不易过大。为保证多糖成分充分的释放本实验采用稀碱水解后木瓜蛋白酶和胰蛋白酶进一步酶解,以除掉其结合蛋白,并进一步使用Seveg法去除游离的蛋白,最终多糖的得率为5.3%(基于烘干后原料)。
根据多糖的电荷分布不同,采用阴离子交换柱层析对单环刺螠体壁粗多糖进行分离纯化。根据线性洗脱选择梯度洗脱条件,最终确定以纯水和0.25 mol/L NaCl溶液进行梯度洗脱(图1),苯酚-硫酸检测后分别按峰收集,浓缩透析除盐,冻干得到水洗、0.25 mol/L洗脱组分,水洗组分为白色粉末状,盐洗组分为淡黄色粉末,分别命名为UP-1和UP-2,二者得率分别为45%和30%(基于粗多糖)。
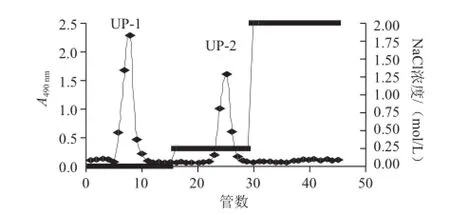
图 1 单环刺螠粗多糖在Q Sepharose Fast Flow柱上的梯度洗脱图Fig.1 Gradient elution profile of the crude polysaccharides on Q sepharose fast flow column
2.2 单环刺螠体壁多糖的单糖组成分析
对单环刺螠体壁多糖水洗组分UP-1和盐洗组分UP-2进行单糖组成分析表明,二者的单糖组成存在很大差异(图2)。UP-1单糖组成为葡萄糖(Glc),表明UP-1为一种葡聚糖。而UP-2单糖组成较为复杂,主要含有葡萄糖(Glc),以及半乳糖(Gal)、氨基葡萄糖(GlcN)、岩藻糖(Fuc)和少量的甘露糖(Man)、氨基半乳糖(GalN)。从单糖组成可以看出UP-2为组成复杂的类糖胺聚糖,其单糖组成Man、GlcN、GalN、Glc、Gal、Fuc物质的量比例为1∶1.47∶0.64∶6.49∶2.5∶3.0。
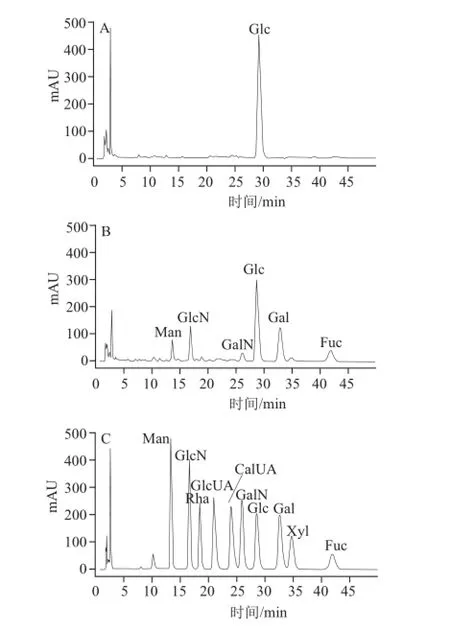
图 2 PMP柱前衍生UP-1(A)、UP-2(B)和10 种单糖标准品(C)高效液相色谱图Fig.2 HPLC chromatograms of UP-1 (A), UP-2 (B) and mixture of ten monosaccharide standards (C) using pre-column derivatization with 1-phenyl-3-methyl-5-pyrazolone (PMP)
2.3 体壁多糖的分子质量分析
对离子交换柱层析纯化组分UP-1和UP-2进行纯度和分子质量分析。如图3所示,经过纯化后UP-1和UP-2纯度较高,特别是UP-2呈现单一对称峰。二者在相对分子质量上也存在很大差异,UP-1分子质量约为340 kD,而UP-2分子质量约为7.9 kD。
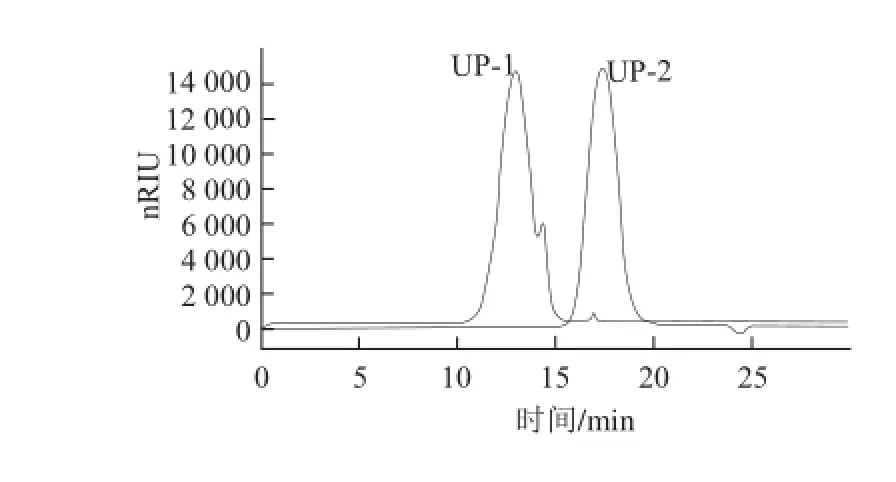
图 3 UP-1和UP-2的高效凝胶渗透色谱图Fig.3 HPGPC chromatograms of UP-1 and UP-2
2.4 单环刺螠体壁多糖的理化性质分析
多糖的理化性质为多糖进一步的结构鉴定和活性筛选提供重要的参考价值。通过紫外分光光度法对UP-1和UP-2的理化性质进行比较分析。UP-1总糖含量较高94.7%,不含有蛋白和硫酸基。UP-2总糖含量为67%,可能是由于氨基糖在硫酸-苯酚反应中不显色及其他单糖对显色反应的干扰造成了误差[15]。UP-2含有3%左右的蛋白,16%的氨基糖,另外,和很多其他来源的海洋类糖胺聚糖一样,UP-2含有少量的硫酸基取代,含量为7.4%。
2.5 单环刺螠体壁多糖的红外光谱分析
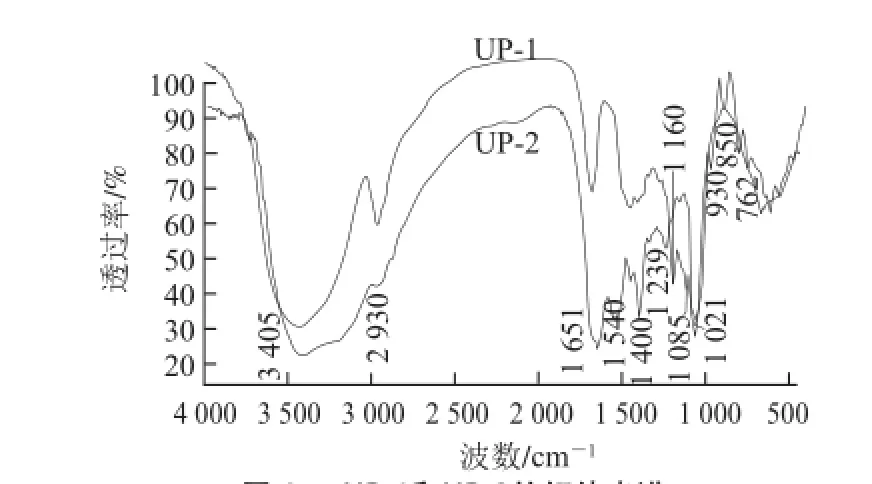
图 4 UP-1和UP-2的红外光谱Fig.4 IR spectra of UP-1 and UP-2
对UP-1和UP-2的红外光谱进行比较分析(图4)可知,二者的结构存在很大差异。UP-1的红外光谱是典型的多糖红外光谱。3 405 cm-1处的信号为多糖OH的伸缩振动吸收峰;在2 930 cm-1附近处的信号为糖环上的次甲基和亚甲基中的C—H伸缩振动的吸收峰;1 021、1 085 cm-1和1 160 cm-1处的吸收信号为C—O和C—O—C的伸缩振动,三者的同时存在表征了吡喃糖环的伸缩振动峰;850 cm-1处的吸收表明糖基中存在α构型;932 cm-1处的吸收表明UP-1的葡聚糖为D-构型;1 640 cm-1处的吸收为多糖类物质常见的微量水分缔合羟基造成。由此可以初步推测UP-1主要由α-D-吡喃葡萄糖构成。而UP-2在3 400 cm-1附近有更强的吸收,示意除了O—H的伸缩振动外还有氨基N—H的伸缩振动;1 651 cm-1和1 400 cm-1的强和中强吸收,分别是C=O的对称伸缩振动和非对称伸缩振动,表明UP-2中羰基的存在,最有可能为乙酰基的羰基,推测UP-2中存在乙酰基取代。1 540 cm-1为N—H的弯曲振动;在1 239 cm-1处有弱的吸收,示意O—SO3—的S=O 键伸缩振动,进一步表明UP-2中存在硫酸基的取代。综合以上分析可知,UP-2为部分硫酸取代的富含氨基的杂多糖,可能存在乙酰基取代[13,16]。
2.6 单环刺螠体壁多糖的抗脂质过氧化作用
糖胺聚糖是很多海洋生物如海参、扇贝的重要活性成分,具有广泛的生物活性,而调节血脂是其重要的活性之一。研究表明海洋糖胺聚糖能够有效地降低脂质过氧化物的产生,通过自由基的清除达到调节心血管并延缓衰老的作用[17]。为快速表征单环刺螠体壁多糖对脂质过氧化物的清除作用,采用体外抗脂质过氧化模型对其清除自由基活性进行评价。如图5所示,通过对比分析,体壁多糖中的类糖胺聚糖成分UP-2和UP-1相比,体现出良好的体外抗脂质过氧化活性,在10 mg/mL时对自由基的清除率超过80%,其半数清除质量浓度为5.0 mg/mL。表明单环刺螠体壁多糖存在较好的脂质过氧化物清除作用,而类糖胺聚糖的活性要优于葡聚糖,推测类糖胺聚糖是单环刺螠体壁多糖的主要活性成分,其生物活性有待进一步深入开发。
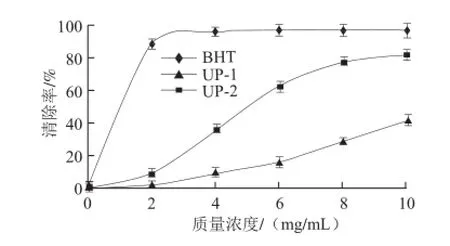
图 5 UP-1和UP-2的脂质过氧化物清除曲线Fig.5 Inhibition curves of lipid peroxidation by UP-1 and UP-2
3 讨 论
单环刺螠以其对硫化物的耐受力及富含活性多肽而受到关注,对其多糖类活性成分的研究较少。本实验对单环刺螠体壁多糖进行系统分析。很多海洋动物中含有硫酸化类糖胺聚糖。不同来源的类糖胺聚糖在硫酸基含量、单糖组成和分子质量上均有很大的区别。海参中的糖胺聚糖由乙酰氨基半乳糖、葡萄糖醛酸和岩藻糖组成,鲍鱼中的硫酸化糖胺聚糖主要含有半乳糖、葡萄糖、木糖、岩藻糖和葡萄糖醛酸。海湾扇贝中主要含有硫酸化的氨基己糖、己糖醛酸,还含少量的鼠李糖、岩藻糖、木糖、半乳糖和葡萄糖,鱿鱼墨中含有的类糖胺聚糖由乙酰氨基半乳糖、葡萄糖醛酸和岩藻糖组成,由此可见海洋动物是糖胺聚糖的重要来源[14,18-21]。单环刺螠来源糖胺聚糖分子质量分布与大部分海洋糖胺聚糖类似,为8 kD,低于20 kD,也存在一定的硫酸基取代,但单糖组成上存在很大的区别。单环刺螠主要含有葡萄糖、半乳糖和氨基己糖,还含有少量的甘露糖和岩藻糖,不含有糖醛酸,表明单环刺螠来源的类糖胺聚糖为结构较为新颖的海洋类糖胺聚糖。
海洋糖胺聚糖具有丰富的生物活性,在免疫调节、抗肿瘤、抗凝血和调节血脂等方面都具有显著的生物活性。扇贝裙边糖胺聚糖可显著抑制荷瘤小鼠肿瘤生长,与环磷酰胺联用有减毒增效的作用,且有增强小鼠的免疫功能[22]。刺参酸性黏多糖能显著地抑制小鼠S180肿瘤和乳癌细胞DNA的合成。王静凤等[23]研究表明日本刺参能增强B细胞、T细胞、NK细胞和巨噬细胞等的功能,从而促进荷瘤小鼠细胞免疫、体液免疫和非特异性免疫效应细胞杀伤体内的肿瘤细胞。刘宗保等[24]发现刺参糖胺聚糖在200~250 mg/L质量浓度范围表现出抗风疹病毒活性,呈一定的量效关系,并无明显细胞毒性作用。张佩文等[25]研究发现玉足海参酸性黏多糖抗凝血作用显著,可延长血浆凝血酶时间、活化部分凝血活酶时间、血浆凝血酶原时间,目前已开发为具有抗凝和降低血脂的功效的药品。闵诗刚等[26]研究表明:乌贼墨多糖能极其显著地降低白细胞、血小板、红细胞数量和过氧化氢酶的活力,代偿性升高丙二醛含量,对环磷酰胺引起的免疫系统和抗氧化能力损伤,有显著的拮抗作用及促进其快速恢复的功效。而对单环刺螠体壁糖胺聚糖初步体外活性研究表明,其也呈现良好的体外脂质过氧化物的清除活性,提示其可能存在调节血脂、预防动脉粥样硬化相关的活性,具有进一步深入研究的价值[27]。
本实验以单环刺螠的体壁为原料提取其中的多糖成分,采用多种化学分析方法和现代仪器分析技术对其理化性质、单糖组成及分子质量等进行研究,结果表明单环刺螠体壁含有5%左右的多糖类物质,且多糖分为两大类型:一类为高分子质量的中性葡聚糖,另一类为组成较为新颖的硫酸化类糖胺聚糖,分子质量为7.9 kD,主要由葡萄糖、氨基葡萄糖和氨基半乳糖组成,还含有甘露糖、半乳糖和岩藻糖,硫酸基含量为7%。初步活性研究显示单环刺螠体壁糖胺聚糖为主要的活性多糖成分,极具开发价值。为开发单环刺螠这一经济海产,促进高值化利用,其糖胺聚糖深入的生物活性有待进一步研究。
[1] 王雷, 刘海梅, 彭鸽, 等. 单环刺螠营养成分及体内活性物质的研究进展[J]. 鲁东大学学报: 自然科学版, 2011, 27(4): 342-345.
[2] 蒋仲青, 刘万顺, 韩宝芹, 等. 单环刺螠纤溶酶的分离纯化及溶栓活性的初步研究[J]. 中国海洋大学学报: 自然科学版, 2009, 39(增刊1): 138-142.
[3] 赵欢, 韩宝芹, 刘万顺, 等. 单环刺螠多肽抗肿瘤及对小鼠免疫功能的调节作用[J]. 中国天然药物, 2008, 6(4): 302-306.
[4] 刁勇, 居海亮, 许瑞安. 单环刺螠抗血栓组分的分离纯化和药效学研究[J]. 中国生化药物杂志, 2007, 28(3): 199-200.
[5] 殷秀红, 赵峡, 张紫恒, 等. 紫贻贝多糖的提取、分离和基本理化性质分析[J]. 中国海洋药物, 2011, 30(2): 12-18.
[6] CHEN Yin, MAO Wenjun, TAO Hongwen, et al. Structural characterization and antioxidant properties of an exopolysaccharide produced by the mangrove endophytic fungus Aspergillus sp. Y16[J]. Bioresource Technology, 2011, 102(11): 8179-8184.
[7] 李佩佩, 陈雪昌, 张玉荣, 等. 海洋红细菌Lentibacter algarum胞外多糖的分离纯化及结构解析[J]. 生物工程学报, 2014, 30(3): 455-463.
[8] DUBOIS M, GILLES K A, HAMILTON J K. Colorimetric method for determination of sugars and related substances[J]. Analytical Biochemistry, 1956, 28(3): 350-356.
[9] BENSADOUN A, WEINSTEIN D. Assay of proteins in the presence of interfering materials[J]. Analytical Biochemistry, 1976, 70(1): 241-250.
[10] BITTER T, MUIR H M. A modified uronic acid carbazole reaction[J]. Analytical Biochemistry, 1962, 4(4): 330-334.
[11] TERHO T, HARTIALA K. Method for determination of the sulfate content of glycosamino glycans[J]. Analytical Biochemistry, 1971, 41(2): 471-477.
[12] 张维杰. 糖复合物生化研究技术[M]. 2版. 杭州: 浙江大学出版社, 1999: 18.
[13] 王长云, 管华诗, 李八方. 扇贝氨基多糖的红外光谱分析[J]. 海洋湖沼通报, 1994(3): 32-39.
[14] LIU Xin, SUN Zhengliang, ZHANG Miansong, et al. Antioxidant and antihyperlipidemic activities of polysaccharides from sea cucumber Apostichopus japonicus[J]. Carbohydrate Polymers, 2012, 90(4): 1664-1670.
[15] 苏畅, 夏文水, 姚惠源. 氨基葡萄糖和乙酰氨基葡萄糖的测定方法[J].食品工业科技, 2003, 24(6): 74-77.
[16] SHINGEL K I. Determination of structural peculiarities of dextran, pullulan and γ-irradiated pullulan by Fourier-transform IR spectroscopy[J]. Carbohydrate Research, 2002, 337(16): 1445-1451.
[17] 董晓静. 波纹巴非蛤糖胺聚糖抗氧化与降血脂活性研究[D]. 湛江:广东海洋大学, 2010.
[18] 文松松, 赵峡, 于广利, 等. 海洋动物多糖研究进展[J]. 中国海洋药物杂志, 2008, 28(4): 46-51.
[19] CHEN Shiguo, XU Jie, XUE Changhu, et al. Sequence determination of a non-sulfated glycosaminoglycan-like polysaccharide from melanin-free ink of the squid Ommastrephes bartrami by negativeion electrospray tandem mass spectrometry and NMR spectroscopy[J]. Glycoconjugate Journal, 2008, 25(5): 481-492.
[20] 王玲, 陈健, 姜建国, 等. 沙海参多糖的分离和特性研究[J]. 现代食品科技, 2008, 24(7): 655-658.
[21] 李冬梅, 谭凤芝, 杨静峰, 等. 皱纹盘鲍脏器多糖的分离纯化及鉴定[J].水产科学, 2007, 26(9): 485-488.
[22] 邢军, 刘赛, 王海桃, 等. 扇贝裙边糖胺聚糖抗肿瘤作用和对荷瘤小鼠免疫功能的影响[J]. 中国医院药学杂志, 2008, 28(2): 90-93.
[23] 王静凤, 王奕, 赵林, 等. 日本刺参的抗肿瘤及免疫调节作用研究[J].中国海洋大学学报, 2007, 37(1): 93-96.
[24] 刘宗保, 王笑峰, 马忠兵, 等. 刺参糖胺聚糖抗风疹病毒的初步研究[J].齐鲁医学杂志, 2008, 23(5): 507-511.
[25] 张佩文, 骆苏芳, 钟春宁, 等. 玉足海参酸性粘多糖的抗凝血作用[J].中国药理学与毒理学杂志, 1998, 2(2): 98-101.
[26] 闵诗刚, 王光, 钟杰平, 等. 乌贼墨多糖对大鼠外周血及血液中抗氧化能力影响[J]. 食品研究与开发, 2011, 32(2): 123-125.
[27] 焦绪栋, 安传锋, 王福亮, 等. 单环刺螠废弃内脏中粗多糖的提取工艺优化[J]. 食品科学, 2013, 34(2): 27-30.
Purification, Physicochemical Properties and Anti-Lipid Peroxidation Activity of Polysaccharides from Body of Urechis unicinctus
ZHU Jiali, CHEN Yisha, NIU Qingfeng, LI Tao, CHEN Yin*
(School of Food and Pharmacy, Zhejiang Ocean University, Zhoushan 316022, China)
This study aimed to extract polysaccharides from the body wall of Urechis unicinctus by sequential enzymatic digestion with papain and trypsin and to purify the crude extract by anion exchange column chromatography. The physical and chemical properties such as monosaccharide composition and molecular weight of the purified polysaccharides were investigated on the basis of chemical and modern spectroscopic analysis. Then the antioxidant activity in vitro of the polysaccharides was evaluated. The results showed that the yield of polysaccharides extracted from the body wall of Urechis unicinctus was 5.3%. Two polysaccharides, namely UP-1 and UP-2, were purified from the crude polysaccharides by anionexchange chromatography. UP-1 was a neutral polysaccharide composed of mainly glucose with a molecular weight of 340 kD. UP-2 was a heteropolysaccharide with a molecular weight of about 7.9 kD. UP-2 consisted of mannose, glucosamine, galactosamine, glucose, galactose and fucose at a molar ratio of 1.0:1.47:0.64:6.49:2.5:3.0. The monosaccharide composition revealed that UP-2 was a glycosaminoglycan-like polysaccharide. Like most of glycosaminoglycan-like polysaccharides from marine animals, UP-2 contained 7.4% sulfate ester. The glycosaminoglycan-like polysaccharide had a wide range of bioactivities and better anti-lipid peroxidation activity than UP-1 as evidenced by its EC50value at 5.0 mg/mL.
Urechis unicinctus; polysaccharide; purifi cation; physicochemical property; antioxidant activity
R151.2
A
1002-6630(2015)08-0162-05
10.7506/spkx1002-6630-201508029
2014-07-16
浙江自然科学基金项目(LQ14H300001);中国海洋大学海洋药物教育部重点实验室开放基金项目(KLMD(OUC)201402)
朱佳利(1992—),女,本科生,主要从事海洋药物研究。E-mail:342457383@qq.com
*通信作者:陈荫(1984—),男,副教授,博士,主要从事海洋药用生物资源开发研究。E-mail:mojojo1984@163.com
