富硒大豆中蛋白提取工艺优化及HPLC-MS联用测定硒代蛋氨酸
2015-12-29李宝瑞邢志强张安宁庄晓虹
铁 梅,李宝瑞,邢志强,韩 杰,高 俣,张安宁,庄晓虹,*
富硒大豆中蛋白提取工艺优化及HPLC-MS联用测定硒代蛋氨酸
铁 梅1,李宝瑞1,邢志强2,韩 杰1,高 俣1,张安宁1,庄晓虹1,*
(1.辽宁大学环境学院,辽宁 沈阳 110036;2.辽宁大学化学院,辽宁 沈阳 110036)
根据Box-Behnken试验设计原理和响应面分析法确定了富硒大豆中硒蛋白提取的最佳工艺;在此条件下,获取可溶性硒蛋白中的硒代氨基酸,并 采用高效液相色谱-质谱联用技术对富硒大豆可溶性蛋白中的硒代蛋氨酸进行定性定量分析。结果表明,液料比11∶1(mL/g)、提取温度 44 ℃、提取时间96 min时,可溶性硒蛋白的提取率可达到76.03%。对4 种自行种植的富硒大豆中可溶性蛋白分析可知:硒-L-蛋氨酸中硒含量与可溶性蛋白中硒含量、富硒大豆中总硒量呈正相关;实验范围内硒代蛋氨酸相对于可溶性蛋白中硒含量最高可达28.46%;说明富硒大豆中不仅含有硒代蛋氨酸,还存在其他形态的硒代氨基酸,有待于进一步研究探索。对大豆进行富硒种植,不仅能提高大豆中含硒总量,而且能通过大豆的生物代谢将其转化成安全无毒营养的有机硒。
富硒大豆;高效液相色谱-质谱联用;硒代蛋氨酸
硒(Se)是人和动物的必需微量营养元素,具有重要的生理功能,大量资料证实或提示,硒具有广泛的生物学作用,在预防克山病、某些癌症和延缓衰老中发挥着重要作用[1-3]。我国2/3的地区缺硒,大量研究表明,有机硒尤其是蛋白硒及氨基酸硒毒性小、生物利用率高,因此如何获取具有生物活性的硒蛋白和硒代氨基酸,已成为人们研究的热点[4-9]。我国是世界大豆主产国,大豆具有很高的营养价值,蛋白含量在豆类中居前列,大豆也成为了富硒效果较好的农产品[10]。
目前,国内外分离提取大豆蛋白的方法主要有碱提酸沉、NaCl溶液浸提、Tris-HCl缓冲液浸提等方法,但强碱容易引起赖氨酸损失,产生一些有害物质,如赖氨酰胺丙氨酸,还可能造成蛋白的变性和水解,从而影响其生物活性、营养价值和商业价值[11-13]。考虑到本研究采用高效液相色谱串联质谱(high performance liquid chromatography with mass spectrometry,HPLC-MS)法对蛋白酶解液进行分析,应尽量减少无机盐的干扰,因此选取Tris-HCl缓冲液为浸提剂,探究各因素对富硒大豆中可溶性硒蛋白提取效果的影响。
硒代蛋氨酸是蛋氨酸中的硫被硒取代而形成的一种硒代氨基酸,是生物利用度较高的有机硒化物[14]。近年来,国外测定富硒食品中硒代氨基酸的方法有高效液相色谱串联电感耦合等离子质谱(high performance liq uid chromatography with inductively coupled plasma mass spectrometry,HPLC-ICP-MS)、HPLC-MS、毛细管电泳-电化学发光法等[15-18],虽然对富硒产品中硒形态的定量、定性分析采用最多的是HPLC-ICP-MS,然而对于质谱联用技术,由于多反应监测(multiple reaction monitoring,MRM)技术在质谱检测中的应用,使得在检测过程中有针对性地选择数据进行质谱信号采集,对符合规则的离子进行信号记录,去除不符合规则离子信号的干扰,相比较HPLC-ICP-MS,HPLC-MS技术具有灵敏度高、检出限低、分析速度快等优点[19-20],目前国内使用HPLC-MS测定大豆中硒代氨基酸的报道相对较少。本实验采用HPLC-MS联用仪对富硒大豆中的硒代蛋氨酸进行了定性定量分析,对于进一步研究其他硒代化合物有着重要意义。
1 材料与方法
1.1 材料与试剂
富硒大豆采用大田试验,实验共设4 个施硒处理,硒肥含硒量分别为0、10、20、40 mg/kg,于辽宁省沈阳市于洪区光辉现代农业示范区种植。
硒标准液(1000mg/L) 国家环保总局标准样品研究所;硒代蛋氨酸 美国Sigma公司;胰蛋白酶、蛋白酶K、三羟甲基甲烷、硫酸铵、乙腈、甲酸(均为色谱纯)、硝酸、过氧化氢、硝酸镍(均为优级纯) 国药集团化学试剂有限公司;实验用水均为超纯水。
1.2 仪器与设备
1100高效液相色谱系统、6410三重串联四极杆质谱美国安捷伦公司;SpectrAA220型原子吸收光谱仪、GTA110型石墨炉、cary50紫外-可见分光光度计 美国Varian公司;MDS-2002A型压力自控密闭微波消解系统上海新仪微波化学科技有限公司;LGJ-15D型真空冷冻干燥机 北京四环科学仪器厂有限公司;KJELTEC2100型半自动凯式定氮仪 瑞典富斯-特卡托公司;XZ-21K高速冷冻离心机 长沙湘智离心机仪器有限公司;MDFU50V超低温冰箱 北京博医康实验仪器有限公司。
1.3 方法
1.3.1 样品处理
成熟大豆样品采收后,先用大量自来水冲洗,再以超纯水洗涤3 次,沥干,装入塑料袋中,置于-85 ℃冷冻冰柜冷冻24 h后,再移至真空冷冻干燥系统中,在真空度3.5 Pa、温度为-55 ℃条件下进行连续72 h冷冻干燥。粉碎干燥好的样品,装入塑料自封袋中,置干燥器中保存备用。
1.3.2 大豆样品中总硒量的测定
称取0.5 g大豆粉末于聚四氟乙烯消化罐中,加入5 mL 65%的HNO3溶液和1 mL 30%的H2O2溶液,拧紧外盖放入微波消化仪,微波消解程序为:0.5 MPa、1 min;1.0 MPa、2 min;1.5 MPa、3 min;使用石墨炉原子吸收测定富硒大豆中的总硒量[21]。硒的吸收峰面积(A)与硒质量浓度(ρ)在0~50 μg/L范围内呈线性关系,线性方程为A=0.003 1ρ+0.014 6(r=0.994 2),检出限为1.20 μg/L。石墨炉原子吸收光谱仪工作条件:狭缝1.0 nm,灯电流7.0 mA,灰化温度与原子化温度分别为800 ℃与2 300 ℃。
1.3.3 大豆中可溶性蛋白的提取
取3 g富硒大豆样品,按一定的液料比加入浸提液,在一定温度和时间条件下振荡,25 ℃条件下4 000 r/min离心30 min,取上清液在冰浴条件下缓慢加入4 倍溶液体积丙酮,于-20 ℃冰箱放置4 h后,4 ℃条件下10 000 r/min离心20 min,弃上清液并在通风橱吹干丙酮,得可溶性蛋白。
1.3.4 大豆中蛋白含量的确定
大豆中总蛋白和可溶性蛋白的测定采用微量凯氏定氮法,参照GB 5009.5—2010《食品中蛋白的测定》[22]。
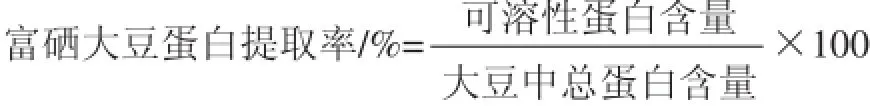
1.3.5 大豆蛋白提取单因素试验
采用30 mol/L pH 7.5的Tris-HCl缓冲液为浸提剂,选择液料比5∶1、10∶1、15∶1、20∶1、25∶1(mL/g),提取温度20、30、40、50、60 ℃,提取时间30、60、90、120、150 min分别做单因素试验,考察各因素对蛋白提取率的影响,得到提取可溶性蛋白的适宜条件范围。
1.3.6 大豆蛋白提取的响应面试验
采用Box-Behnken试验设计原理,在单因素试验的基础上,以液料比、提取温度、提取时间为影响因素,以蛋白的提取率为试验指标,采用软件Design-Expert V8.0.6建立三因素三水平试验,进一步优化可溶性蛋白的提取条件,试验因素及水平见表1。

表 1 Box-Behnken试验因素水平表Table 1 Factors and levels used in response surface design
1.3.7 大豆中蛋白硒含量的测定
在最佳浸提条件下提取富硒大豆蛋白,取20 mL浸提液于聚四氟乙烯消化罐中,加5 mL 65%的HNO3溶液和1 mL 30%的H2O2溶液置于微波消解仪中消化。微波消解程序及蛋白硒含量测定方法见1.3.2节。
1.3.8 大豆蛋白中硒代蛋氨酸分析测定
用5 mL 30 mol/L pH 7.5的Tris-HCl缓冲液将1.3.3节所得可溶性蛋白溶解,按底物质量分数4%、酶质量分数6%加入胰蛋白酶,于50 ℃水浴振荡4 h,在相同条件下加入同等量蛋白酶K振荡4 h,反应完成后100 ℃煮沸10 min灭酶,5 000 r/min 离心20 min,取上清液待测。
色谱工作条件:ZORBAX 300A SB-C18色谱柱(100 mm×2.1 mm,3.5 μm);柱温20 ℃;流动相为20% A(水)+80% B(乙腈),A、B流动相中各含0.1%甲酸;流速为200 μL/min;进样量为10 μL。
质谱工作条件:电喷雾离子电离源,正离子电离方式,电离电压3 845 V;雾化器为高纯氮气;离子源温度300 ℃;雾化器压力为300 psi;采用MRM。
串联四极杆质谱能够进行MRM,最大程度上减少基质的干扰,为目标化合物的分析提供高选择性和高灵敏度。本研究对硒代蛋氨酸的标准溶液进行质谱条件摸索,其中包括优化毛细管电压和碰撞能。优化毛细管电压是为了保证母离子的传输效率最高,碎片离子产生最少,随着毛细管电压由小变大,母离子响应强度会逐渐变强,但到达最适值达到最大后再增大毛细管电压,母离子响应就会逐渐减弱,碎片离子反而增多。优化好毛细管电压后,给予母离子不同碰撞能,将其打碎,得到其特征性的子离子,根据子离子响应、稳定性选择最佳碰撞能。
1.4 统计分析
使用SPSS 1 9.0进行数据分析处理,对各处理间的差异性进行多重比较和最小显著差数法分析(α=0.05)。
2 结果与分析
2.1 富硒大豆中总硒量和总蛋白量
采用微波消解与石墨炉原子吸收光谱法对富硒大豆中的总硒量进行测定(表2),对照组含硒量为58.67 μg/kg,而施硒量为10、20、40 mg/kg的大豆中含硒量呈现上升趋势,表明随着施硒量的增加,能促进大豆对无机硒的吸收、迁移及转化。
采用凯氏定氮法对大豆中蛋白进行3 次测定,如表2所示,随着施硒量的增加,大豆中蛋白含量的变化并不大。

表 2 富硒大豆中总硒量和总蛋白量Table 2 Total Se content and total protein content in Se-enriched soybean
2.2 大豆蛋白提取的单因素试验结果
考察单因素对蛋白提取率的影响,结果表明,提取大豆可溶性蛋白的合适浸提条件范围为:液料比10∶1、提取时间90 min、提取温度40 ℃左右。
2.3 大豆蛋白提取工艺的优化
2.3.1 回归模型的建立

表 3 响应面分析方案及试验结果Table 3 Response surface design and results for soybean protein extraction
对表3试验结果进行多元回归模拟,得到各试验因素对响应值的影响回归方程为:蛋白提取率/%=74.74+6.19A+4.92B+1.73C+1.15AB-0.23AC-0.045BC-7.64A2-3.42B2-1.38C2。
由表4可知,回归方程中因变量和自变量之间的线性关系显著(R2=0.968 9),P=0.000 2<0.01,说明此方程极显著,表明此模型可分析和预测富硒蛋白提取工艺参数。模型中的A、B、A2、B2达到极显著水平,C影响显著,AB、AC、BC、C2影响不显著。由F值可知,影响蛋白提取率主要因素依次是A>B>C,即液料比>提取温度>提取时间。
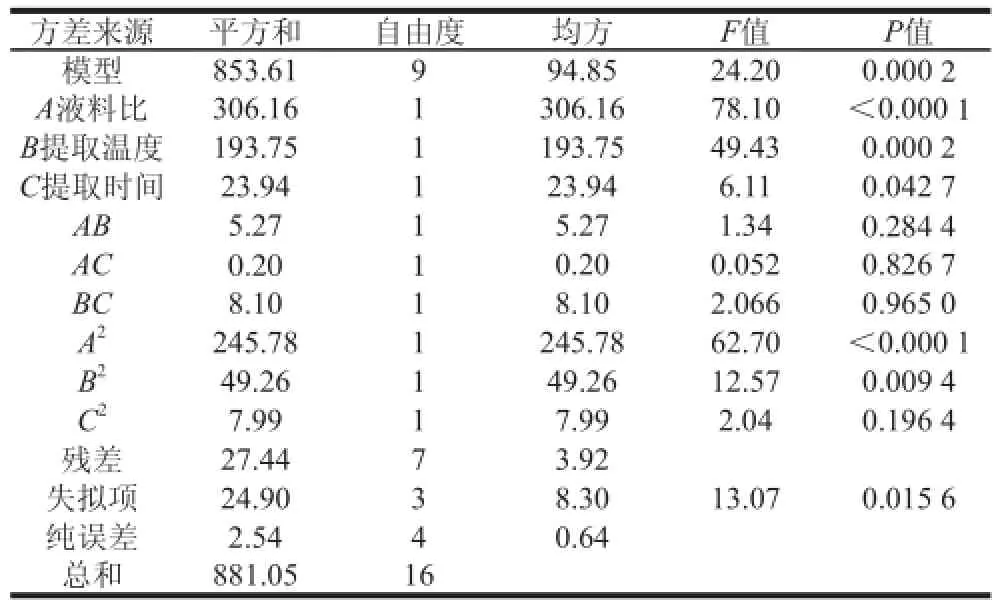
表 4 模型的ANOVA分析结果Table 4 Analysis of variance(ANOVA)for the fitted quadratic regression model
2.3.2 响应面分析
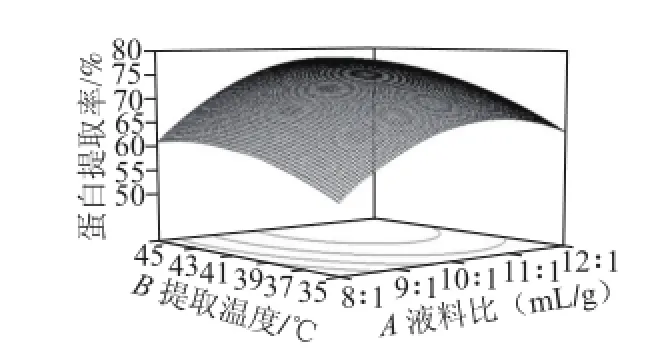
图 1 液料比和提取温度对蛋白提取率影响的响应面Fig.1 Response surface plot for the effect of liquid/material ratio and temperature on protein yield

图 2 提取温度和提取时间对蛋白提取率影响的响应面Fig.2 Response surface plot for the effect of extraction temperature and time on protein yield
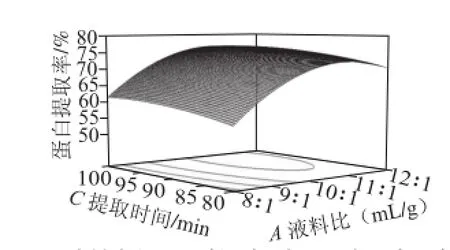
图 3 液料比和提取时间对蛋白提取率影响的响应面Fig.3 Response surface plot for the effect of liquid/material ratio and extraction time on protein yield
图1 ~3反映各因素对大豆蛋白提取率的影响。比较3 组图可知:液料比对蛋白提取率的影响较大,曲线变化较陡;提取温度次之;提取时间对蛋白提取率的影响最小,曲面变化比较平缓。
2.3.3 最佳提取条件及验证
由Design-Expert V8.0.6分析软件得到的最佳浸提条件为液料比10.91∶1、提取温度43.96 ℃、提取时间95.77 min,理论上蛋白提取率为78.59%。考虑到实验的可行性,将最佳条件调整为料液比11∶1(mL/g)、提取温度44 ℃、提取时间96 min。在此条件下,对大豆蛋白进行浸提,通过3 次平行实验,测得蛋白提取率为76.03%,相对误差为3.26%,没有显著差异。
2.4 富硒大豆中蛋白硒含量
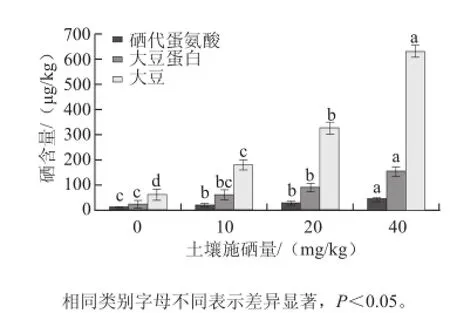
图 4 大豆中的总硒量、可溶性蛋白含硒量以及硒代蛋氨酸含硒量Fig.4 The concentrations of total-Se, protein-Se and methionine-Se in soybeans applied with different levels of selenium
在最优浸提条件下分别提取施硒量为0、10、20、40 mg/kg成熟大豆中的可溶性蛋白,对其硒含量进行测定,由图4可知,随着土壤施硒量的增加,蛋白硒的含量有所增加,对照组蛋白硒含量为20.3 μg/kg,土壤施硒40 mg/kg的大豆中蛋白硒含量达到151.04 μg/kg。但是,随着施硒量的增加,蛋白硒占总硒的比例呈下降趋势,对照组为34.60%,而土壤施硒40 mg/kg的大豆蛋白硒占总硒比例为23.84%。方建华等[23]对富硒大米中硒形态研究发现,富硒大米中有机硒的主要赋存形态为蛋白硒,占总硒量53.40%,其次是多糖硒和RNA硒。而李华为等[24]对富硒金针菇中硒的分布研究发现,蛋白硒的含量仅占总硒量的5.03%,其原因可能是物种间富硒特性的差异及蛋白提取方法不同造成的。
2.5 富硒大豆中硒代蛋氨酸的定性定量分析
在最优提取条件下获得的可溶性蛋白,经蛋白酶酶解后,采用HPLC-MS联用仪对酶解产物进行分析测定。硒代蛋氨酸分子式为C5H11NO2Se,经甲酸对其进一步离子化形成分子离子 [(COOHNH3)CHCH2SeCH3]+,m/z为198。本实验经优化选择毛细管电压为70 V,碰撞能20 V,对质量浓度为5 μg/L的硒代蛋氨酸标液进行二级质谱扫描,观察碎片离子的种类和质荷比。如图5所示,确定硒代蛋氨酸的保留时间为2.41 min,选择m/z为198.0和181.0[COOHCH+CH2SeCH3]+离子通道,对硒代蛋氨酸进行定量分析(图6)。分别配制0、1.0、2.0、3.0、4.0、5.0 μg/L的硒代蛋氨酸标样绘制标准曲线,得回归方程:y=7 720.779 7x-7 167.072 0(r2=0.999 3)。采用信噪比(RSN)为3,计算方法最低检出限为0.5 μg/L。

图 5 硒代蛋氨酸标准样品的MRM质量色谱图Fig.5 Multiple reaction monitoring (MRM) liquid chromatogram of selenomethionine standard solution
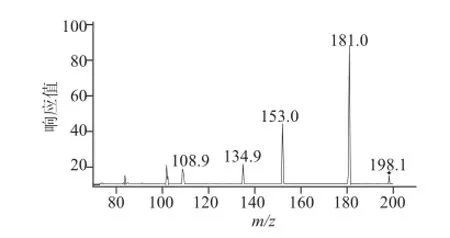
图 6 硒代蛋氨酸标准样品的二级质谱图Fig.6 MS2spectrum of selenomethionine of selenomethionine standard solution
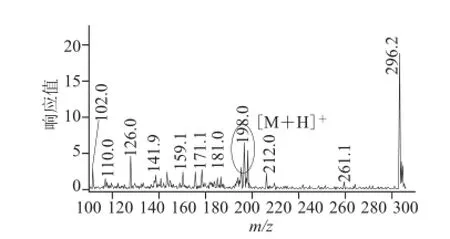
图 7 富硒大豆蛋白酶解液总离子流图Fig.7 Total ion chromatogram of selenium-enriched soybean
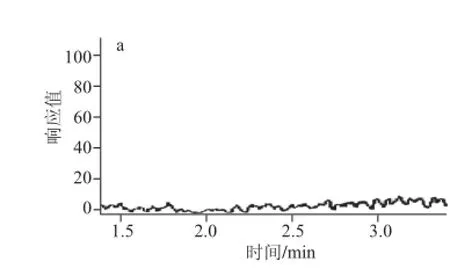
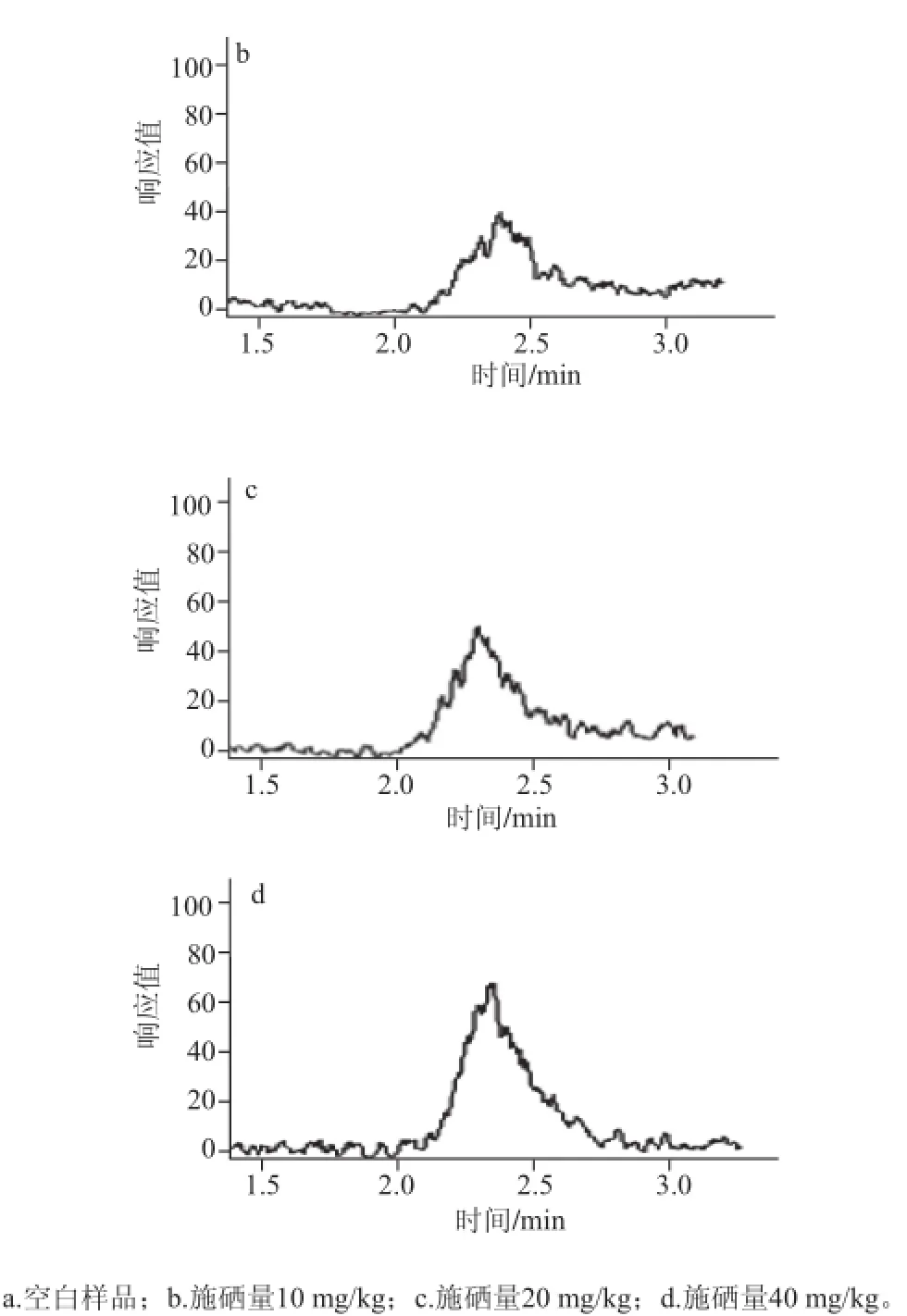
图 8 富硒大豆蛋白中硒代蛋氨酸的MRM质量色谱图Fig.8 MRM Liquid chromatograms of selenomethionine for selenium-enriched soybeans
对土壤施硒量为10 mg/kg的富硒大豆蛋白酶解液进行质谱全扫(图7),由保留时间2.41 min时得到的总离子流程图可以发现m/z为198的分子离子峰,并对4 种不同施硒量的富硒样品进行二级质谱扫描,除了空白样品外,其他梯度的富硒大豆样品均出现硒代蛋氨酸MRM质量色谱峰(图8)。经测定并计算,图8a~d中硒代蛋氨酸中硒的含量分别为3.67、15.33、24.81、40.66 μg/kg,表明随着施硒量的增加,在一定程度上促进了大豆中硒代蛋氨酸的合成。相对于可溶性蛋白中的硒含量,硒代蛋氨酸中硒的含量所占最高比例可达28.46%(图4)。Vetter[25]、Turto[26]等发现,植物中的有机硒形态不仅仅为硒代蛋氨酸,还包括硒代半胱氨酸、硒甲基硒代半胱氨酸等,对于富硒大豆中其他形态的硒代氨基酸有待于进一步研究。
3 结 论
选择Tris-HCl缓冲液为浸提剂,利用Design-Expert V8.0.6分析软件进行优化分析得到提取大豆可溶性蛋白的最佳工艺参数为液料比11∶1(mL/g)、提取温度44 ℃、提取时间96 min,在此条件下蛋白提取率达到76.03%。表明响应面法对于大豆可溶性蛋白提取条件的优化是可行的。确定了蛋白最优浸提条件后,对4 种大豆中的蛋白硒含量进行测定,并与大豆中的总硒量对比。结果表明,随着土壤中施硒量的增加,不仅大豆中总硒量在增加,蛋白硒的含量也在增加。
采用HPLC-MS联用技术对富硒大豆可溶性蛋白中的硒代蛋氨酸进行了定性定量分析,表明随着施硒量的增加,在一定程度上促进了大豆中硒代蛋氨酸的合成,同时表明硒蛋白中不仅含有一定量的硒代蛋氨酸,还大量存在其他形态的硒代氨基酸,本课题组还将继续对未知形态的硒代氨基酸作进一步研究探索。
[1] HATFIELD D L, TSUJI P A, CARLSON B A. Selenium and selenocysteine: roles in cancer, health, and development[J]. Trends in Biochemical Sciences, 2014, 39(3): 112-120.
[2] PATRICK L. Selenium biochemistry and cancer: a review of the literature[J]. Alternative Medicine Review, 2004, 9(3): 239-258.
[3] AMOAKO P O, UDEN P C, TYSON J F. Speciation of selenium dietary supplements[J]. Analytical Chemistry Acta, 2009, 652(3): 315-323.
[4] CANN S A, van NETTEN J P, van NETTEN C. Hypothesis: iodine, selenium and the development of breast cancer[J]. Cancer Causes and Control, 2000, 11(2): 121-127.
[5] PANIGATI M, FALCIOLA L, MUSSINI P. Determination of selenium in Italian rices by differential pulse cathodic stripping voltammetry[J]. Food Chemistry, 2007, 105(3): 1091-1098.
[6] MOON J K, SHIBAMOTO T. Antioxidant assays for plant and food components[J]. Journal of Agricultural and Food Chemistry, 2009, 57(5): 1655-1666.
[7] 张俊杰. 硒的生理功能及富硒强化食品的研究进展[J]. 微量元素与健康研究, 2006, 23(3): 58-60.
[8] 况冲, 郭晓玲, 张永忠, 等. 富硒大豆蛋白的研制[J]. 食品工业科技, 2008, 29(3): 192-194.
[9] 王庆华, 黄伟, 李前勇, 等. 中国富硒食品的生产现状及趋势[J]. 广东微量元素学, 2008, 15(3): 7-10.
[10] 吴永尧, 唐巧玉, 周大寨, 等. 大豆对硒的富集及耐受能力[J]. 湖北农业科学, 2005, 11(3): 424-426.
[11] 矫丽媛, 吕敬军, 陆丰升. 花生分离蛋白提取工艺优化研究[J]. 食品科学, 2010, 31(20): 196-201.
[12] 李燕杰, 甄成, 陈洪涛. 南瓜籽饼粕中蛋白的综合利用[J]. 食品研究与开发, 2009, 30(8): 173-174.
[13] 孙灯艳, 王晓岚, 张连富. 富硒灵芝中可溶性硒蛋白的提取工艺研究[J]. 食品工业科技, 2008, 29(3): 219-221.
[14] WANG Yudong, WANG Xu. Generation of selenium-enriched rice with enhanced grain yield, selenium content and bioavailability through fertilisation with selenite[J]. Food Chemistry, 2013, 18(5): 2385-2393.
[15] 铁梅, 臧树良, 方禹之, 等. SE-HPLC-ICP-MS联用技术在富硒蛹虫草硒蛋白形态分析中的应用研究[J]. 高等学校化学学报, 2006(7): 1232-1236.
[16] KÁPOLNA E, SHAH M, CARUSO J A, et al. Selenium speciation studies in Se-enriched chives (Allium schoenoprasum) by HPLC-ICPMS[J]. Food Chemistry, 2007, 101(4): 1398-1406.
[17] REEVES M A, HOFFMANN P R. The human selenoproteome: recent insights into functions and regulation[J]. Cellular and Molecular Life Sciences, 2009, 66(15): 2457-2478.
[18] MASEKO T, CALLAHAN D L, DUNSHEA F R, et al. Chemical characterization and speciation of organic selenium in cultivated selenium-enriched Agaricus bisporus[J]. Food Chemistry, 2013, 141(4): 3681-3687.
[19] ZEMBRZUSKA J, MATUSIEWICZ H, POLKOWSKA-MOTRENKO H, et al. Simultaneous quantitation and identification of organic and inorganic selenium in diet supplements by liquid chromatography with tandem mass spectrometry[J]. Food Chemistry, 2014, 142: 178-187.
[20] LINDEMANN T, HINTELMANN H. Selenium speciation by HPLC with tandem mass spectrometric detection[J]. Analytical and Bioanalytical Chemistry, 2002, 372(3): 486-490.
[21] 铁梅, 张莹, 张朝红, 等. 石墨炉原子吸收法测定萝卜中的硒[J]. 安徽农业科学, 2013, 41(11): 5045-5047.
[22] 卫生部. GB 5009.5—2010 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2010.
[23] 方建军, 祝华明, 方芳, 等. 富硒大米中硒形态研究[J]. 食品研究与开发, 2012, 33(9): 146-149.
[24] 李华为, 铁梅, 张崴, 等. 金针菇子实体富硒栽培特性及HPLC-ICPMS法对硒的分布研究[J]. 菌种学报, 2012, 31(1): 86-91.
[25] VETTER J, LELLEY J. Selenium level of the cultivated mushroom Agricus bisporus[J]. Acta Alimentaria, 2004, 33(3): 297-301.
[26] TURTO J, GUTKOWSKA B, MALINOWSKA E. Relationship between the selenium, selenomethionine, and selenocysteine content of submerged cultivated mycelium of Lentinula edodes[J]. Acta Chromatographica, 2007, 18: 36-48.
Optimization of Protein Extraction from Selenium-Enriched Soybean and Determination of Selenomethionine by Liquid Chromatography Coupled with Mass Spectrometry
TIE Mei1, LI Baorui1, XING Zhiqiang2, HAN Jie1, GAO Yu1, ZHANG Anning1, ZHUANG Xiaohong1,*
(1. College of Environmental Sciences, Liaoning University, Shenyang 110036, China;2. College of Chemistry, Liaoning University, Shenyang 110036, China)
Based on single factor experi ments, the extraction process for selenium-enriched soybean protein was optimized through Box-Behnken central composite design and response surface methodology. Selenoamino acids were obtained from soluble protein under the optimized extraction conditions. Selenomethionine was qualitatively and quantitatively analyzed by liquid chromatography coupled with mass spectrometry. The optimal conditions for extraction were determined as the follows: liquid/ material ratio, 11:1; extraction temperature, 44 ℃; and extraction time, 96 min. The yield of soluble selenium-containing protein under these conditions was 76.03%. Analysis of soluble proteins from four soybeans enriched with four different levels of selenium indicated that the content of selenium in selenomethionine accounted for 28.46% of the total selenium. Thus, other selenoamino acids also existed besides selenomethionine. Soybeans were able to not only absorb and accumulate selenium, but also to transform inorganic selenium into organic selenium compounds with higher bioavailability and less toxicity. This study provides a scientifi c approach for developing selenium-enriched functional organic food based on soybeans.
selenium-enriched soybean; liquid chromatography coupled with mass spectrometry; selenomethionine
TS201.2
A
1002-6630(2015)08-0006-06
10.7506/spkx1002-6630-201508002
2014-09-27
国家自然科学基金面上项目(31371085); 辽宁省科技厅计划项目(2011205001)
铁梅(1964—),女,教授,博士,研究方向为土壤、农作物、食品中微量元素的检测方法、形态分析、迁移转化规律等。E-mail:1154061312@qq.com
*通信作者:庄晓虹(1971—),女,副教授,博士,研究方向为土壤、农作物、食品中微量元素的检测方法、形态分析、迁移转化规律等。E-mail:syhoujun@126.com
