苦瓜果实及叶片中总皂苷和总黄酮含量对土壤水分的响应及其相关性分析
2015-12-29李文平梁银丽包天莉高德凯
李文平,梁银丽,,*,包天莉,穆 兰,高德凯
苦瓜果实及叶片中总皂苷和总黄酮含量对土壤水分的响应及其相关性分析
李文平1,梁银丽1,2,*,包天莉3,穆 兰2,高德凯1
(1.西北农林科技大学林学院,陕西 杨凌 712100;2.中国科学院水利部水土保持研究所,陕西 杨凌 712100;3.西北农林科技大学资源环境学院,陕西 杨凌 712100)
目的:研究苦瓜果实和叶片中总黄酮和总 皂苷成分对土壤水分以及环境因子的响应。方法:设置高、中、低3 个土壤水分处理(田间持水量(fi eld capacity,FC)的90%~100%、70%~80%、50%~60%),研究苦瓜果实和叶片中总黄酮和总皂苷含量对土壤水分的响应变化,并结合大气相对湿度、大气温度、 光照强度进行相关分析。结果:1)苦瓜总皂苷含量果实高于叶片,总黄酮含量叶片高于果实。2)就总皂苷含量而言,盛果期90%~100% FC处理,初果期和末果期70%~80% FC处理均有利于果实总皂苷的积累,各个时期土壤水分对叶片总皂苷含量影响均不显著。就果实和叶片总黄酮而言,50%~60% FC处理利于其总黄酮含量积累。3)相关分析表明,土壤水分、大气相对湿度增加利于总皂苷积累,不利于总黄酮积累;光照强度、大气温度的增强利于总黄酮积累,不利于总皂苷积累。结论:以苦瓜皂苷类物质为栽培目的应当保持70%~80% FC,适度遮阴、降温和保湿,而以苦瓜黄酮类为目的栽培应该保持50%~60% FC,增加光照和温度以及维持低湿环境。
总皂苷;总黄酮;苦瓜;土壤水分
当前我国已步入老龄化社会,对待疾病已开始从注重治疗转向注重预防,食品的需求和选择也从注重营养转变为注重功能[1]。苦瓜(Momordica charantia L.),又名凉瓜、锦荔枝,属葫芦科苦瓜属一年生攀缘性草本植物,早在《本草纲目》就有“苦瓜苦寒、无毒、除邪热,益气壮阳”的记载[2]。苦瓜不仅营养十分丰富[3],而且因含有关键生物活性物质黄酮和皂苷类化合物,具有降血糖血脂、调节酶活性、抗病毒、抗肿瘤等功能而被称为“21世纪的主流食品”[4],已被广泛应用于工业、医药、化妆品和食品业[5]。现有研究认为苦瓜皂苷主要含有甾体类皂苷和三萜类皂苷,其自身的羟基结构可能是某种酶的作用位点,具有良好的降糖作用[5-7];苦瓜黄酮类化合物因具有生物抗氧化、抗菌作用及抗衰老、治疗脑血管病、降血脂等药用保健功能而格外引人注目[1,8]。
作为某些食品功能成分的植物次生代谢产物具有“道地性”[9]。Szakid等[10]研究认为内外因子的改变均能影响次生代谢产物含量水平和分布状况,Bharathi等[11]研究认为一些重要蔬菜含有的皂苷、黄酮类确实是天然抗氧化剂食品的一个潜在来源。国内学者分别就人参皂苷[12-13]、荞麦黄酮[14]、香椿叶提取物[15]等食品功能成分进行了众多研究,并证实环境确实影响次生代谢产物的形成和积累,但部分学者在各自特定条件下研究结果不同。近10a来,苦瓜价格是一般瓜类蔬菜的2 倍以上,在我国北方需求量和栽培面积逐年扩大[16],苦瓜作 为一种药食兼用新兴蔬菜,涉及其黄酮和皂苷的水分效应研究还鲜有报道。本实验旨在研究土壤水分和结果期对苦瓜果实和叶片中总皂苷和总黄酮含量的影响,探讨其含量与大气温湿度以及光照因子等的相关性,可为苦瓜作为一种功能性食品栽培管理提供服务依据,同时为苦瓜黄酮、皂苷类化合物的进一步开发利用提供参考。
1 材料与方法
1.1 试验地概况
试验于2013年5—9月在陕西杨凌西北农林科技大学试验遮雨棚(34.16° N,108.43° E)进行。小区长4 m,宽1.5 m,相邻小区间埋60 cm隔水板防止水分侧渗。供试土壤为黄绵土(采自陕西安塞县),土壤肥力:有机质9.6 g/kg,全氮0.52 g/kg,速效氮9.88 mg/kg,全磷0.64 g/kg,速效磷26.9 mg/kg,有效钾240.4 mg/kg,容重为1.09 g/cm3,田间持水量(field capacity,FC)为220 g/kg左右。
1.2 材料与试剂
供试苦瓜品种‘蓝山大白’,营养钵育苗。2013年5月8日定植(5片叶),株行距为50 cm×60 cm。完全随机区组设计,土壤水分(soil moisture,SM)以田间持水量的百分数计,分别记为高水(90%~100% FC)、中水(70%~80% FC)、低水(50%~60% FC),重复4 次,控水前各处理灌水量保持一致。定植前施尿素75 kg/hm2(纯氮46.4%),磷酸二铵150 kg/hm2(纯氮15.0%,五氧化二磷42.0%),硫酸钾150 kg/hm2(氧化钾50.0%)作为基肥翻入土中,开花结果期追施等量尿素、硫酸钾一次,整个生育期的其他管理一致。
芦丁标准品、人参皂苷Rg1标准品 上海融禾医药科技发展有限公司;高氯酸、冰醋酸、香草醛、亚硝酸钠、硝酸铝等均为国产分析纯,实验用去离子水。
1.3 仪器与设备
LI-6400便携式光合仪 美国LI-COR公司;Anke TDL80-2B台式离心机 上海安亭科学仪器厂;Jenway6305型紫外分光光度计 英国Bibby公司;BS400S-WEI分析天平 德国Sartorius集团;DHG-9070A型电热恒温鼓风干燥箱 上海一恒科技有限公司;HOBO-U23温湿度记录器(温度精度:±0.2 ℃;相对湿度精度:±2.5%) 广州骏凯电子科技有限公司;HH2(TDR)水分测定仪 英国Burwell Cambridge公司;1100D型超声波破碎机 联想生物科技有限公司。
1.4 方法
1.4.1 土壤含水量测定
从2013年6月1日开始控水,各小区埋设40 cm深的时域反射管(time domain reflectormeter,TDR)测定土壤含水量,用各处理土壤含水量上限减去实测含水量得出所需补水量。补水期间,每隔3 d用TDR探头测定,重复3 次,取平均值,每15 d用烘干法进行校对。补水量计算公式如下:
M=S×H×R×(Wa-Wb)
式中:M为灌溉量/m3;S为小区面积/m2;H为灌溉计划补水层深度(开花前深度20 cm,开花后40cm);R为土壤容重/(g/cm3);Wa为处理设定的土壤含水量/%;Wb为实测含水量/%。
1.4.2 环境因子测定
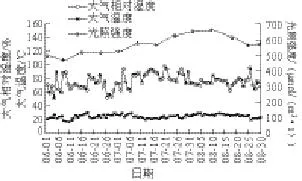
图 1 试验地环境因子变化动态Fig.1 Changes in environmental factors on the trial field
采用小型气象自动记录仪对1.5 m高度处大气温度和大气相对湿度进行动态监测。在不同生育期用LI-6400便携式光合仪测定光照强度,6月1日(水分处理)—9月1日(植株拉秧)测定数值以日均值表示(图1)。
1.4.3 苦瓜果实及叶片总皂苷和总黄酮含量测定
分别在初果期P1(6月28日—7月18日)、盛果期P2(7月19日—8月1日)、盛果期P3(8月2日—8月15日)、末果期P4(8月18日—9月1日),选取成熟度一致的商品果中部果肉和相应果期同一叶龄样叶,55 ℃条件下热风烘干,粉碎,过80 目筛。精量称取2.5 g干粉,加50 mL 80%乙醇溶液,在50 ℃超声浸提40 min,抽滤静置,取5 mL提取液,定容至25 mL作为待测样液。苦瓜总皂苷含量测定用香草醛-高氯酸-紫外分光光度法[17];总黄酮含量采用硝酸铝-亚硝酸钠-紫外分光光度法[18]。
1.5 数据分析
采用Microsoft Excel 2003软件对数据进行处理和绘图,采用SPSS 17.0统计分析软件对数据进行差异显著性检验,Pearson相关系数评价不同因子间相关关系。
2 结果与分析
2.1 土壤水分和结果期对苦瓜总皂苷和总黄酮的总体效应
对3 个土壤水分和4 个结果期的苦瓜总皂苷和总黄酮含量(每次测定重复3 次)进行双因素方差分析(表1),可以看出,除土壤水分对叶片总皂苷含量影响不显著外,结果期和土壤水分均其果实和叶片的总皂苷和总黄酮含量产生显著的影响,它们二者均构成了对含量变化的主效应因子,但结果期和土壤水分的交互作用并不显著。
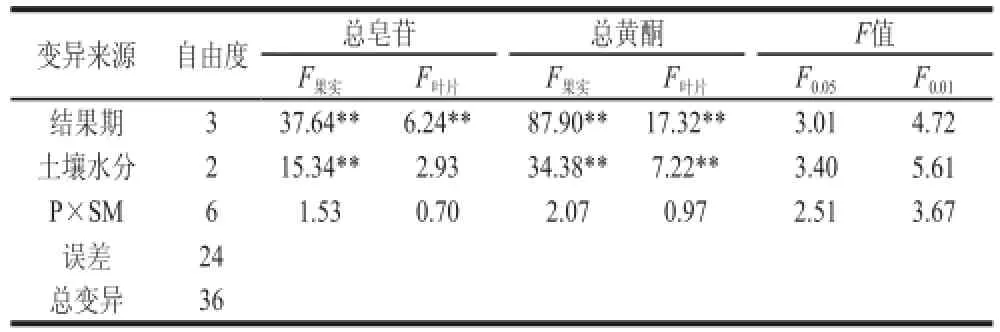
表 1 土壤水分和结果期二因素方差分析表Table 1 Analysis of variance of total flavonoids or total saponins as afunction of soil moisture and fruiting periods
2.2 土壤水分和结果期对苦瓜果实及叶片中总皂苷含量的影响
2.2.1 果实总皂苷
分别就果实及叶片中总皂苷含量在不同土壤水分和结果期进行多重比较,结果见表2。从果实总皂苷含量动态变化来看,3 个水分处理在整个结果期虽然变化幅度有所不同,但总体都呈现“先降后升”趋势,P1和P4时期含量显著高于P2、P3时期的含量。P1和P4中水处理的果实总皂苷含量最高,其次是高水处理,最后是低水处理,表明P1和P4时期果实皂苷含量对水分差异敏感性强。盛果期(P2和P3)高水和中水处理之间果实皂苷含量差异虽不显著,但均显著高于低水处理,说明对果实皂苷含量积累而言,高、中水处理优于低水处理。
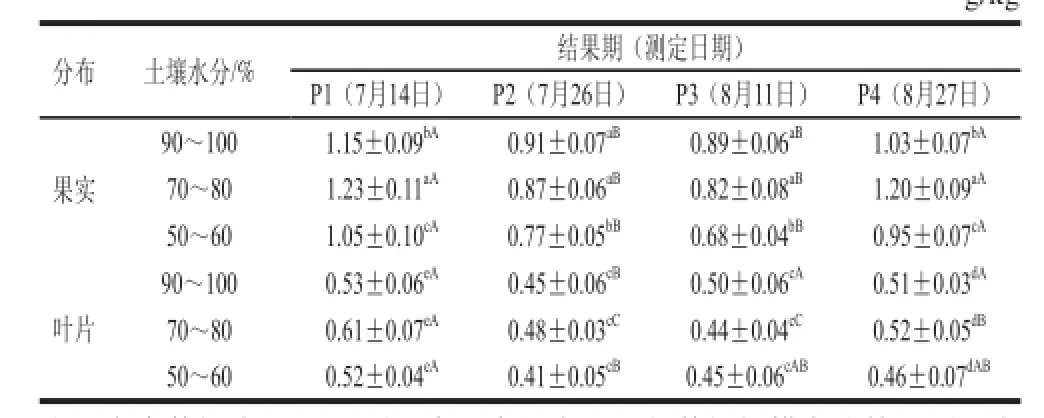
表 2 不同土壤水分处理条件下苦瓜果实和叶片中总皂苷含量变化Table 2 Contents of total saponins in fruits and leaves of balsam pearat different levels of soil moisture g/kg
2.2.2 叶片总皂苷
叶片总皂苷含量在各个结果时期均显著低于果实皂苷含量。叶片总皂苷含量高值出现在P1时期,P2、P3、P4时期含量有所降低,且变幅不大,之间含量差异不显著(表2),说明进入盛果期后叶片中总皂苷含量随着生长期变化差异不大。从叶片总皂苷的水分效应来看,表现出高水、中水和低水处理之间含量差异均不显著,表明叶片总皂苷积累在各个时期对土壤水分都不敏感。
综合表明,苦瓜总皂苷含量分布表现为果实大于叶片,且果实中总皂苷含量的变化幅度较大,叶片总皂苷变化幅度较小。综合果实和叶片总皂苷而言,盛果期高水处理最有利于总皂苷含量的积累,初果期和末果期中水处理有利于总皂苷含量积累,低水处理在任何时期都不利于果实和叶片总皂苷含量积累。
2.3 土壤水分和结果期对苦瓜果实及叶片中总黄酮含量的影响

表 3 不同土壤水分处理条件下苦瓜果实和叶片中总黄酮含量变化Table 3 Contents of total flavonoids of fruits and leaves of balsam pear at different levels of soil moisture
2.3.1 果实总黄酮
如表3所示,果实中总黄酮含量随结果期持续表现为“先升后降”的趋势,P2时期达到峰值,P4时期含量最低。P2和P3时期,高水和中水处理之间含量差异不显著,但含量显著低于低水处理,P1和P4时期水分处理间含量差异均显著,含量由高到低依次为:低水、中水、高水。综合分析认为盛果期的低水处理最有利于果实总黄酮含量的积累。
2.3.2 叶片总黄酮
表3显示,叶片总黄酮含量均显著高于果实总黄酮含量,且变化也呈“先升后降”趋势,只是含量的峰值出现较晚,在P3时期含量显著提高。除P1时期中低水之间含量不显著外,在P2、P3和P4时期水分处理间含量差异均显著,含量由高到低依次为:低水、中水、高水。说明中水和低水处理有利于前期叶片(P1)总黄酮含量提高,低水处理有利于中后期叶片(P2、P3、P4)总黄酮含量积累。
苦瓜总黄酮含量分布表现为叶片大于果实,但含量峰值出现时期不同:果实总黄酮含量在P2时期,叶片总黄酮含量在P3时期。从土壤水分引起的含量变化来看,低水处理有利于果实和叶片总黄酮含量的积累。
2.4 苦瓜果实和叶片总皂苷、总黄酮含量与环境因子相关性研究
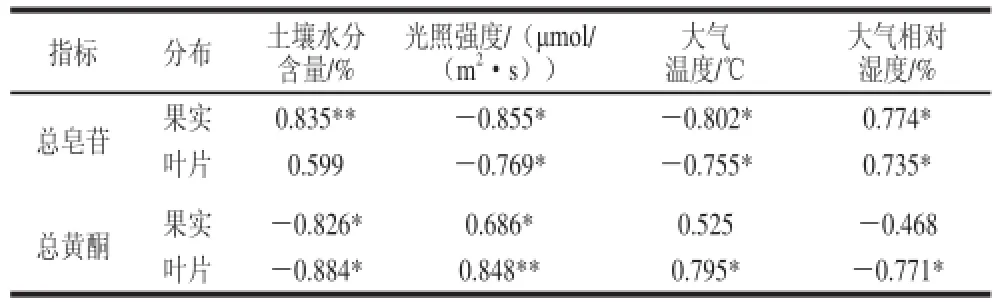
表 4 果实和叶片中黄酮与皂苷含量与主要环境因子的相关关系Table 4 Correlations of the contents of total saponinand toal flavonoids with the main factors for fruits and leaves of balsam pear
选取大气相对湿度、大气温度、光合有效辐射以及土壤水分与苦瓜总皂苷、总黄酮含量进行相关性分析(表4)。结果表明,果实总皂苷与土壤水分和大气相对湿度呈显著正相关,与大气温度和光强呈显著负相关,叶片总皂苷与土壤水分相关性不显著。就总黄酮而言,叶片中总黄酮与所选影响因子均有相关性,表现为与土壤水分和大气相对湿度呈显著负相关,与光强和大气温度呈显著正相关;而果实总黄酮与大气温度和大气相对湿度相关性不显著。综合表明,土壤水分、大气相对湿度适度增加有利于总皂苷积累,不利于总黄酮的积累。光强、大气温度的增强不利于总皂苷的积累,而有利于总黄酮的积累。
3 讨 论
苦瓜是一种新兴保健蔬菜食品,在兼顾产量的同时要更注重品质[2],总黄酮和总皂苷是衡量苦瓜品质的重要生物活性物质[4]。水分直接影响药用植物的次生代谢[9],从逆境生理角度看,不同水分条件下植物体内的生理生化过程会受到不同程度的影响,从而影响次生代谢过程以及次生代谢物的合成和积累[5]。本研究表明,土壤水分对苦瓜总皂苷和总黄酮的影响并不一致。一方面,研究认为低水胁迫对苦瓜总黄酮含量的积累具有促进作用,50%~60% FC处理显著提高了果实和叶片总黄酮含量。有研究[9]表明水分胁迫能刺激植物次生代谢产物的释放和积累,能进一步诱导植物体产生氧化胁迫,由于黄酮类物质本身具有较强的抗氧化活性,因此黄酮类物质的积累增加了植物对水分胁迫的耐受性[19]。另一方面,本研究中盛果期高水和中水都促进了果实总皂苷含量,但综合整个结果期果实和叶片来看,总皂苷含量更适宜在70%~80% FC的中度胁迫下积累,因为中度胁迫下,植物生长受到一定限制,体内积累了一定的光合产物,植物利用这些“过剩”光合产物合成含碳次生化合物[10],适度水分胁迫可以提高皂苷物质含量的研究在人参和西洋参[20]、麦冬[21]等植物上已经证实。
图1表明,苦瓜挂果后,光照强度呈现先增后降的趋势,大气温度小幅波动,总体呈现稳中有升态势,大气相对湿度与气温呈显著负相关的关系(R=-0.996)。表4显示,土壤水分与苦瓜果实和叶片总黄酮含量均显著负相关,与汪贵斌等[22]在银杏叶黄酮上的研究不同,除选择的研究对象不同之外,可能木本植物次生代谢物质积累周期长,易于转移和分配,造成对土壤水分的响应降低;而土壤水分与果实总皂苷含量有正相关关系,这与范海兰等[21]在麦冬上的研究结果基本一致。植物次生代谢过程和强度是植物与生境“交流”能力诱导作用的结果[9,19],谢彩香等[12]就人参皂苷研究后认为,环境因子中的温度、光照、水分单一或相互作用影响着人参品质,其中低温处理对人参皂苷积累具有决定作用,而本研究揭示出“阴、凉、湿”的栽培环境有利于苦瓜皂苷物质积累,而不利于苦瓜黄酮类物质积累(表4),其具体影响机制有待于进一步研究。
从科学、高效调控和开发利用苦瓜生物活性物质角度出发,本研究认为,90%~100% FC处理适宜于盛果期果实总皂苷含量积累,70%~80% FC处理适宜初果期和末果期果实总皂苷含量的积累,土壤水分在对叶片总皂苷含量影响均不显著,50%~60% FC处理在每个结果期均有利于果实及叶片中总黄酮含量积累。同时,注重苦瓜皂苷类物质的栽培应当适度遮阴、降温和保湿,而注重苦瓜黄酮类的栽培应该适度增加光照和温度。
参考文献:
[1] 赵余庆, 吴春福. 我国食品药学的建立与研究进展[J]. 中国中药杂志, 2011, 36(4): 391-395.
[2] ZHANG Zhongwei, XIE Mingyong, WANG Yuanxing, et al. Supercritical carbon dioxide fluid extraction of functional components from Momordica charantia L. fruits[J]. Food Science, 2010, 31(6): 137-140.
[3] 杜小凤, 吴传万, 王连臻, 等. 苦瓜营养成分分析及采收期对苦瓜营养品质的影响[J]. 中国农学通报, 2014, 30(1): 226-231.
[4] 唐传核. 植物功能性食品[M]. 北京: 北京工业出版社, 2005: 18.
[5] 田力东, 张名位, 郭祀远, 等. 不同苦瓜品种的皂苷含量及对α-葡萄糖苷酶活性抑制作用的比较[J]. 中国农业科学, 2008, 41(10): 3415-3421.
[6] GROVER J K, YADAV S P. Pharmacological actions and potential uses of Momordica charantia: a review[J]. Journal of Ethnopharmacology, 2004, 93: 123-132.
[7] 李月秋, 杜光玲, 刘兴中, 等. 苦瓜降糖活性皂苷研究进展[J]. 食品研究与开发, 2013, 34(15): 124-127.
[8] 谢明勇, 聂少平. 天然产物活性多糖结构与功能研究进展[J]. 中国食品学报, 2010, 10(2): 7-17.
[9] 董娟娥, 张康健, 梁宗锁. 植物次生代谢与调控[M]. 杨凌: 西北农林科技大学出版社, 2009: 78-79.
[10] SZAKID A, PACZKOWSKI C, HENRY M. Influence of environmental abiotic factors on the content of saponins in plants[J]. Phytochemistry Reviews, 2011, 10: 471-491.
[11] BHARATHI L K, SINGH H S, SHIVASHANKAR S, et al. Assay of nutritional composition and antioxidant activity of three dioecious momordica species of South East Asia[J]. Proceeding of the National Academy of Sciences, 2014, 84(1): 31-36.
[12] 谢彩香, 索风梅, 贾光林, 等. 人参皂苷与生态因子的相关性[J]. 生态学报, 2011, 31(24): 7551-7563.
[13] 贾光林, 黄林芳, 索风梅, 等. 人参药材中人参皂苷与生态因子的相关性及人参生态区划[J]. 植物生态学报, 2012, 36(4): 302-312.
[14] 蔡娜, 淡荣, 陈鹏. 水分胁迫对苦荞幼苗黄酮类物质含量的影响[J].西北农业学报, 2008, 17(4): 91-93.
[15] 张京芳, 王冬梅, 周丽, 等. 香椿叶提取物不同极性部位体外抗氧化活性研究[J]. 中国食品学报, 2007, 7(5): 18-23.
[16] 高安辉, 蔡永强, 张兴无, 等. 苦瓜品种的比较试验研究[J]. 安徽农业科学, 2008, 36(32): 14055-14057; 14101.
[17] 邱红. 苦瓜(Momordica charantia L.)总皂甙提取方法及高皂甙苦瓜品种筛选研究[D]. 泰安: 山东农业大学, 2008: 28-29; 42.
[18] 庞红, 文略, 王小萍, 等. 苦瓜总黄酮的超声波提取工艺研究[J]. 微量元素与健康研究, 2007, 24(6): 49-50.
[19] ZHU Z B, LIANG Z S, HAN R L. Saikosaponin accumulation and antioxida tive protection indrought-stressed Bupleurum chinense DC. plants[J]. Environal and Experimrntal Botany, 2009, 66(2): 326-333.
[20] 董梁. 人参、西洋参质量特征与生态因子相关性研究[D]. 郑州: 河南中医学院, 2011: 57-65.
[21] 范海兰, 洪伟, 吴承祯, 等. 水分胁迫对短葶山麦冬生长和总皂苷量的影响[J]. 应用与环境生物学报, 2011, 17(3): 345-349.
[22] 汪贵斌, 郭旭琴, 常丽, 等. 温度和土壤水分对银杏叶黄酮类化合物积累的影响[J]. 应用生态学报, 2013, 24(11): 3077-3083.
Responses of Total Flavonoids and Total Saponins Contents in Fruits and Leaves of Balsam Pear to Soil Moisture and Their Correlations
LI Wenping1, LIANG Yinli1,2,*, BAO Tianli3, MU Lan2, GAO Dekai1
(1. College of Forest, Northwest A&F University, Yangling 712100, China;2. Institute of Soil and Water Conservation, Chinese Academy of Sciences and Ministry of Water Resources, Yangling 712100, China;3. College of Resources and the Environment, Northwest A&F University, Yangling 712100, China)
This study aimed to identify the responses of total flavonoids and total saponins contents in fruits and leaves during the fruiting stages of balsam pear (Momordica charantia. L. var. lan shan da bai) to different levels of soil moisture and environmental factors. Balsam pear was grown at three levels of soil moisture, namely 90%–100%, 70%–80% and 50%–60% field capacity (FC), respectively. Meanwhile, the environment factors, including atmospheric temperature, relative humidity, and photosynthetically active radiation, were also analyzed. The results were obtained as follows: 1) as a whole, the contents of total flavonoids in leaves were higher than in fruits, whereas the opposite result was observed for total saponins.; 2) treatment with 90%–100% FC at the full fruit stage and with 70%–80% FC at both early and later fruiting stages was more suitable for the accumulation of saponins in fruits; however, soil moisture content had no significant effect on the accumulation of saponins in leaves during the entire fruiting period; in addition, 50%–60% FC treatment favored the accumulation of flavonoids in both fruits and leaves; 3) correlation analysis showed that soil moisture and atmospheric relative humidity were correlated positively with total saponins but negatively with total flavonoids, and higher atmospheric temperature and photosynthetically active radiation were beneficial to the accumulation of flavonoids but unfavorablefor the accumulation of saponins. In conclusion, treatment of 70%–80% FC in combination with moderate shade, cooling and moisture is more suitable for the accumulation of saponins while treatment of 50%–60% FC in combination with elevated light intensity, temperature and humidity can promote the accumulation of flavonoids.
total saponins; total flavonoids; balsam pear; soil moisture
S642. 5
A
1002-6630(2015)08-0134-05
10.7506/spkx1002-6630-201508024
2014-07-16
“十二五”国家科技支撑计划项目(2014BAD14B006;2011BAD31B05)
李文平(1990—),男,硕士,研究方向为植物水分生理与作物品质。E-mail:lwp416@163.com
*通信作者:梁银丽(1957—),女,教授,博士,研究方向为植物生理生态。E-mail:liangyl@ms.iswc.ac.cn
