正交试验优化豆皮水溶性多糖中果胶的分离技术
2015-12-29李群飞孙姿姿魏玉良迟玉森
李群飞,安 宁,于 丹,孙姿姿,魏玉良,迟玉森*
正交试验优化豆皮水溶性多糖中果胶的分离技术
李群飞,安 宁,于 丹,孙姿姿,魏玉良,迟玉森*
(青岛农业大学食品科学与工程学院,山东 青岛 266109)
目的:豆皮水溶性多糖中含有果胶组分,探究一种适合工业生产的高效分离果胶方法。方法:在单因素试验的基础上,通过正交试验探究可溶性固形物含量(A)、钙化pH值(B)、水洗次数(C)、酸化pH值(D)4 个因素对果胶和中性糖纯度的影响。结果:四因素对果胶纯度的影响均大于对中性糖纯度的影响;对果胶纯度影响主次顺序为C>A>B>D,而对中性糖纯度影响主次顺序为A>B>C>D,综合考虑确定最优分离条件为A1B2C3D2,即:可溶性固形物含量2.5%、钙化pH 8、水洗5 次、酸化pH 2。在最优条件下进行验证实验,实际得到的果胶纯度高达85.48%,得率为31.3%;中性糖纯度高达80.01%,得率为64.9%。结论:方法有效实用,操作简便,成本低,绿色无污染,适合工业化大生产。
豆皮水溶性多糖;分离;果胶;中性糖
果胶是由植物组织中提取的一种酸性多糖(富含羧酸基),其水溶液黏度较低,可与Ca2+、Mg2+、Cu2+等阳离子反应生成具有优良性质的凝胶体系或沉淀[1-2]。果胶具有分散性、抗氧化性、乳化性和黏着性等特点,已广泛应用于食品、医药、化工以及生物工程等领域[3-8]。
随社会对果胶的需求越来越大,国内果胶资源日趋紧张。尽管果胶普遍存在于植物的细胞壁和细胞内层,但可以用于提取果胶的部分却比较局限,现多以时令果蔬的皮或渣为主。因此,开发新的果胶资源成为一个亟待解决的问题。
刘贺等[9]研究发现,豆皮水溶性多糖主要含有果胶和中性多糖。若从中分离出两组分,既可依豆皮耐贮存的特点以克服季节因素限制为果胶连续生产提供保障,又将大大提高豆皮利用率,增加其附加值。另有研究发现,中性糖具有保护肝脏、降血糖、抗氧化、抗肿瘤、抗病菌以及提高免疫力等生物活性[10-12],豆皮中性糖的应用价值值得进一步研究。豆皮中可溶性多糖含量高达35%[13],因此,以豆皮为原料制得豆皮水溶性多糖后,分离出果胶和中性糖具有重大的意义。
目前,文献资料关于豆皮果胶提取的报道中,关注得率而未以提高果胶纯度为目的,将多糖混合物误认为是果胶[14];我国大豆多糖提取利用仅限于可溶性大豆多糖混合物的层次[15-17]。现有研究中采用柱层析法对多糖组分进行分离纯化,但因该法操作繁琐、条件要求高而不适用大规模生产。本研究拟以CaCl2处理法代替柱层析,分离制得高纯度果胶和中性糖组分,开发出一个适用于工业化大生产的新果胶资源。
1 材料与方法
1.1 材料与试剂
豆皮水溶性多糖 山东嘉冠油脂化工有限公司;盐酸、硝酸(均为分析纯) 烟台三和化学试剂有限公司;NaOH(分析纯) 天津市北方天医化学试剂厂;CaCl2、95%乙醇(均为分析纯) 莱阳市康德化工有限公司;硝酸银(分析纯) 天津市迈斯科化工有限公司。
1.2 仪器与设备
AR1140电子分析天平 奥豪斯国际贸易(上海)有限公司;WS101手持糖度计 上海测维光电技术有限公司;RE-52AA型旋转蒸发器 上海亚荣生化仪器厂;PHS-3C型数显酸度计 杭州雷磁分析仪器;TD5A-WS台式低速大容量离心机 金坛市金南仪器制造有限公司;ZJFD-3冷冻干燥机 上海肇基电气科技有限公司。1.3 方法
1.3.1 工艺流程
豆皮水溶性多糖(质量记为M1)→溶于蒸馏水→真空浓缩→调节pH值→钙化反应→离心

1.3.1.1 豆皮水溶性多糖溶于蒸馏水
称取豆皮水溶性多糖约10 g(精确至0.000 1 g),按料液比1∶100溶于蒸馏水,于50 ℃恒温搅拌溶解1.5 h,离心(4 000 r/min)15 min,收集上清液;将沉淀复溶于相同体积的水中,常温搅拌溶解15 h,离心(4 000 r/min)15 min,收集合并两次上清液。
1.3.1.2 真空浓缩粗提液
将1.3.1.1节所得上清液浓缩至可溶性固形物含量为一定值, 制得混合多糖浓缩液以备用。浓缩条件为:50 ℃,-0.1 MPa。
1.3.1.3 调节pH值
用2 mol/L NaOH溶液,调节上述浓缩液的pH值到合适值,备用。
1.3.1.4 钙化反应
向调pH值后的浓缩液中缓慢滴加5 mL CaCl2溶液(5 mol/L),边滴边搅;待均匀后,静置40 min,使果胶酸钙生成完全。
1.3.1.5 洗涤果胶酸钙沉淀
将上述处理液煮沸5 min,离心(3 500 r/min )10 min,收集上清液;将沉淀置于400 mL热蒸馏水(≥85 ℃)中,磁力搅拌洗涤10 min,离心(3 500 r/min)10 min,分别收集果胶酸钙沉淀和上清液。重复洗涤果胶酸钙一定次数,取出果胶酸钙沉淀,用于提取果胶,合并本步所有上清液用于后续提取中性糖组分。
1.3.1.6 保温酸化
将果胶酸钙沉淀转移至30 mL一定pH值的盐酸溶液中,60 ℃水浴保温20 min,使果胶酸钙完全转化为果胶酸,目视无明显颗粒得果胶多糖液。若转化不完全,残留的果胶酸钙会以杂质存在,影响果胶纯度和溶解度。
1.3.1.7 醇沉/醇洗
由上述处理得到的果胶多糖液,经计算后加入无水乙醇至乙醇体积分数为80%,搅拌均匀后静置10 min;离心(3 500 r/min)10 min,将所得果胶沉淀经75%乙醇重复离心洗涤至上清液中无氯离子残留。
氯离子检验方法:取上述离心上清液约20 mL于小烧杯中,滴加2 滴硝酸银指示剂溶液,目视无明显白色沉淀即认为上清液中无氯离子残留。
1.3.1.8 冷冻干燥
将洗涤处理后的果胶沉淀复溶后冷冻干燥,即得符合商品要求的豆皮果胶。
1.3.1.9 真空浓缩中性糖上清液
将第1.3.1.5节所得中性糖上清液浓缩至可溶性固形物含量为1%~1.5%,备用。浓缩条件为:75 ℃,-0.1 MPa。
1.3.1.10 保温酸化
用2 mol/L HCl溶液,调上述浓缩液pH值为一定值, 60 ℃条件下水浴保温20 min,原理同1.3.1.6节。
1.3.1.11 醇沉/醇洗
操作步骤同1.3.1.7节。
1.3.1.12 冷冻干燥
将洗涤处理后的中性糖沉淀复溶后冷冻干燥,即得到另一种产品——大豆中性糖。
1.3.2 单因素试验
选取可溶性固形物含量、钙化pH值、水洗次数和酸化pH值作为影响果胶和中性糖纯度的主要考察因素,通过单因素试验确定正交试验的因素和水平。每组试验均重复3 次。
1.3.2.1 可溶性固形物含量的确定
制备混合多糖浓缩液,控制其可溶性固形物含量分别为2.0%、2.5%、3.0%、3.5%、4.0%,其他条件设定为钙化pH 7、水洗4 次、酸化pH 2,考察不同可溶性固形物含量对果胶和中性糖纯度的影响。
1.3.2.2 钙化pH值的确定
制备混合多糖浓缩液,调钙化pH值分别为5、6、7、8、9,其他条件设定为可溶性固形物含量2.5%、水洗4 次、酸化pH 2,考察不同钙化pH值对果胶和中性糖纯度的影响。
1.3.2.3 水洗次数的确定
制备混合多糖浓缩液,钙化后水洗次数分别为2、3、4、5、6,其他条件设定为可溶性固形物含量2.5%、钙化pH 7、酸化pH 2,考察不同水洗次数对果胶和中性糖纯度的影响。
1.3.2.4 酸化pH值的确定
制备混合多糖浓缩液,调酸化pH值分别为0、1、2、3、4,其他条件设定为可溶性固形物含量2.5%、钙化pH 7、水洗4 次,考察不同酸化pH值对果胶和中性糖纯度的影响。
1.3.3 正交试验设计
在单因素试验基础上,采用L9(34)正交试验,对可溶性固形物含量、钙化pH值、水洗次数和酸化pH值四因素的条件进行优化,方案设计如表1所示。

表 1 正交试验分离条件因素水平表Table1 Factors and levels used in the orthogonal array design for optimizing separation conditions
1.3.4 纯度测定
果胶纯度以半乳糖醛酸含量计,参照GB 25533—2010《食品添加剂:果胶》[18]方法。
中性糖纯度以总糖含量计,参考许会生等[19]针对糖醛酸与中性糖共存情况下各组分的测定改良方法,采用苯酚-硫酸法进行测定。
1.3.5 得率计算
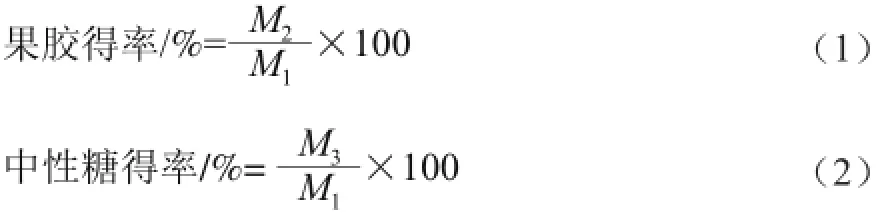
1.3.6 产品感官鉴别定性
参照GB 25533—2010[18]方法。
2 结果与分析
2.1 单因素试验结果
2.1.1 可溶性固形物含量对果胶和中性糖纯度的影响
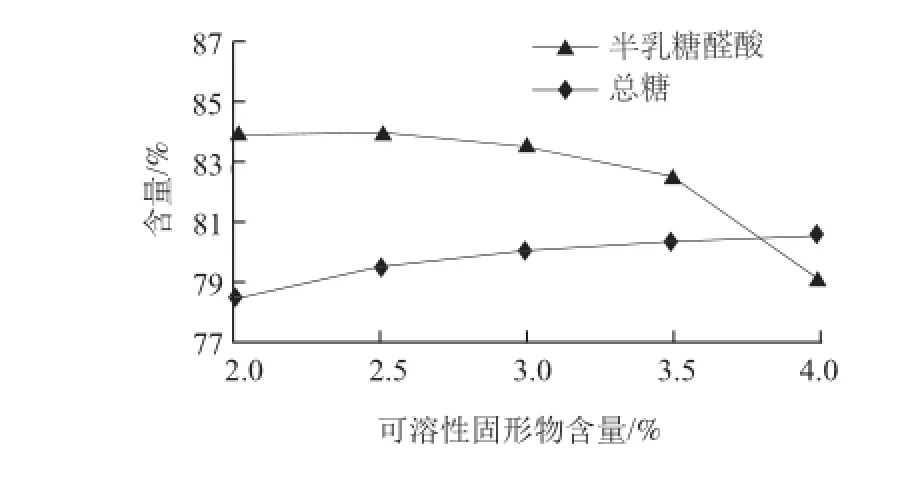
图 1 可溶性固形物含量对果胶和中性糖纯度的影响Fig.1 Effect of soluble solids content on the purities of pectin and neutral sugars
由图1可知,随混合多糖浓缩液中可溶性固形物含量的增大,果胶纯度逐渐降低,这是由于当混合多糖溶液质量分数较高时, Ca2+与果胶反应更快,对溶液中的中性糖组分包埋程度较大,致使果胶纯度降低[20];而中性糖组分的纯度逐渐上升后趋于平缓,原因是果胶酸钙复合物在体系中存在解离平衡,当混合多糖溶液质量分数较小时,不利于果胶酸钙的形成,导致离心后残留在上清液中的果胶多糖越多,混入中性糖组分中降低了其纯度。
2.1.2 钙化pH值对果胶和中性糖纯度的影响
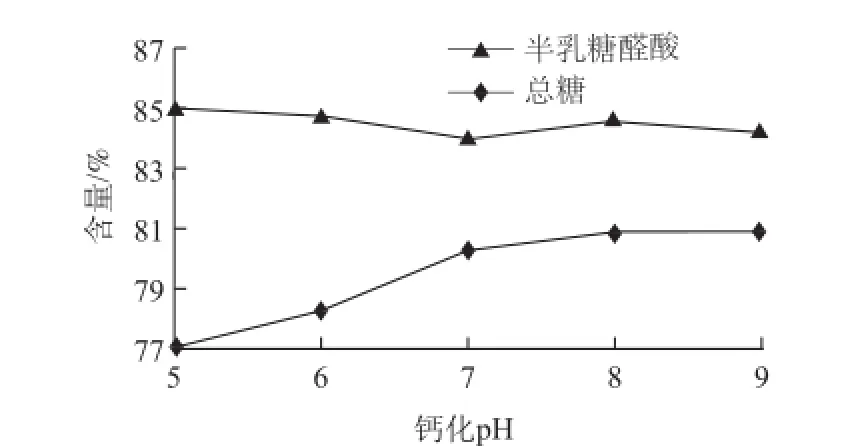
图 2 钙化pH值对果胶和中性糖纯度的影响Fig.2 Effect of calcification pH value on the purities of pectin and neutral sugars
由图2可知,从果胶纯度的走势推断,反应体系分别为酸性、中性和碱性的情况下,果胶与Ca2+的反应结合机理有差别,从而影响了中性糖组分的纯度。
当pH<7时,溶液呈酸性,果胶与Ca2+成胶的同时有微弱逆反应存在,使得少量果胶酸钙水解成果胶后残留在离心上清液中,所以果胶纯度较高而中性糖纯度偏低;当pH 7时,溶液呈中性,果胶与Ca2+结合不受其他离子干扰,反应速率最快。中性糖组分被包埋在果胶酸钙中的程度最大,导致果胶纯度最低;当pH>7时,果胶纯度先升高后略微下降,推测是由离子竞争反应和β-消去反应共同作用所致。当Ca2+加入到碱性多糖浓缩液中的瞬间,OH-暂时与部分Ca2+生成微溶于水的Ca(OH)2,降低了Ca2+浓度,使得果胶与Ca2+反应速率减慢;另外,在碱性环境下,果胶分子自身会不可避免的发生β-消去反应,对果胶性质有不良影响。碱性越大,该反应越剧烈[23]。
另外,果胶酸钙在不同酸碱环境中的存在形式也存在差异。在酸性和中性条件下,果胶与Ca2+形成的凝胶能够稳定存在;在碱性条件下,果胶与Ca2+形成的凝胶不稳定,其以沉淀形式存在,现象同已有研究[21-22]的描述一致。但果胶酸钙的存在形式并不影响后期处理效果。2.1.3 水洗次数对果胶和中性糖纯度的影响
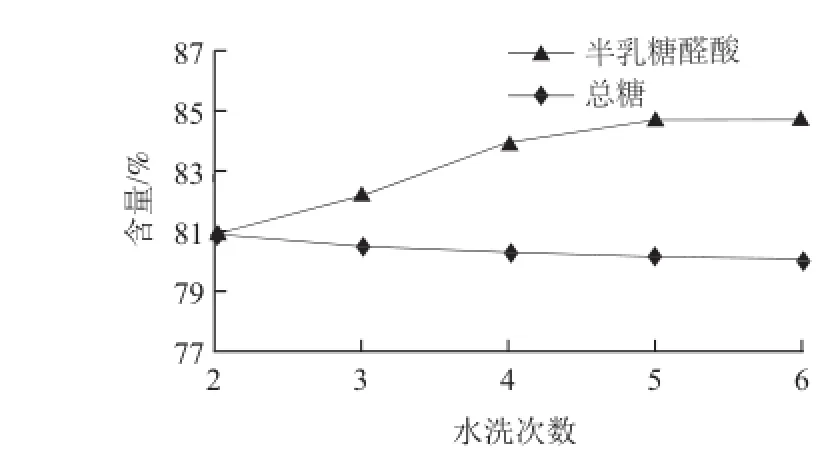
图 3 水洗次数对果胶和中性糖纯度的影响Fig.3 Effect of washing cycles on the purities of pectin and neutral sugars
由图3可知,随着水洗次数的增加,果胶纯度先逐渐上升后趋于平缓,这是由于附着于果胶酸钙表面未成胶的中性糖组分溶于热蒸馏水而被洗至了离心上清液中;另外,果胶酸钙在热蒸馏水中存在可逆反应[2],水洗次数越多损失越多,即离心上清液中果胶残留总量越多,致使中性糖组分纯度略微降低。
2.1.4 酸化pH值对果胶和中性糖纯度的影响
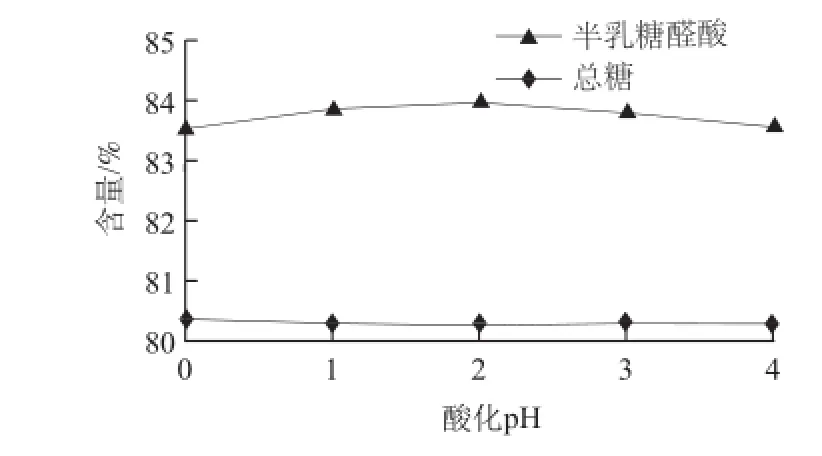
图 4 酸化pH值对果胶和中性糖纯度的影响Fig.4 Effect of acidification pH value on the purities of pectin and neutral sugars
由图4可知,随酸化pH值的升高,果胶纯度先升高后降低,中性糖组分纯度无显著变化。当pH值小于2时,果胶纯度随酸化pH值的升高有所升高,推测可能是过酸条件下果胶多糖比其他物质降解速率略快所致,其原因有待进一步探究;当pH值大于2时,由于果胶酸钙脱Ca2+不完全[2],果胶纯度随酸化pH值的升高有所降低。
2.2 果胶和中性糖分离正交试验优化
由表2中半乳糖醛酸含量极差分析可知,各因素对果胶纯度的影响次序为C>A>B>D,即影响因素由主到次依次为水洗次数、可溶性固形物含量、钙化pH值、酸化pH值,制得最高纯度果胶的分离条件参数为C3A1B2D2。
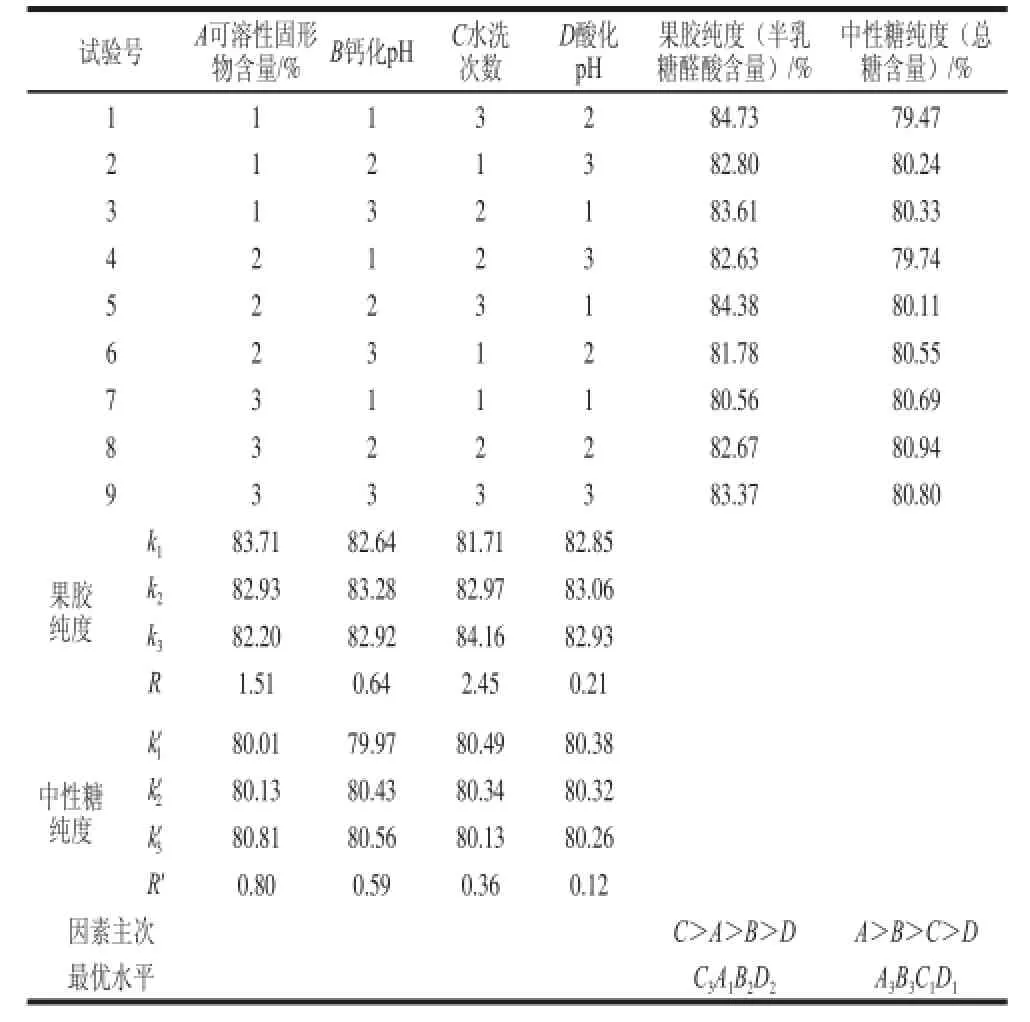
表 2 正交试验L9(34)结果Table 2 L9(34) Orthogonal array design and experimental results
由表2中总糖含量极差分析可知,各因素对中性糖纯度的影响次序为A>B>C>D,即影响因素由主到次依次为可溶性固形物含量、钙化pH值、水洗次数、酸化pH值,制得最高纯度中性糖组分的分离条件参数为A3B3C1D1。
表2数据中两者的R值显示各因素对果胶纯度的影响均大于对中性糖纯度的影响;本研究所制得的果胶和中性糖两者的纯度相互制约。综合考虑各因素对果胶和中性糖纯度的影响程度以及本研究目的,本着敏感指标优先考虑、主要因素优先满足的原则,保证果胶和中性糖两组分纯度较高的最优分离条件参数应为A1B2C3D2。
2.3 验证实验结果
由于得出的最优分离条件组合A1B2C3D2在正交试验中并没有包含,需要补充验证实验对比L9(34)中A1B1C3D2(方案1)与A1B2C3D2的分离效果,见表3。最终确定最优分离条件为A1B2C3D2。
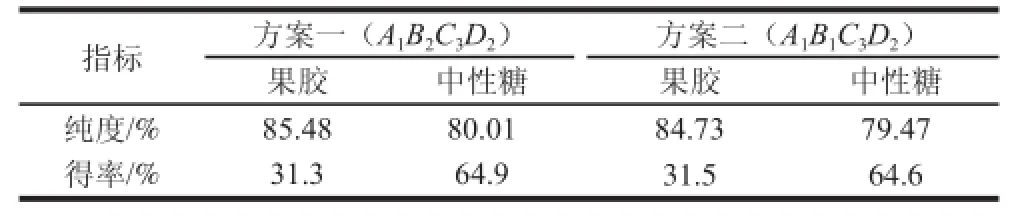
表 3 验证实验结果Table 3 Results of verification experiments
2.4 感官鉴别定性
2.4.1 感官评定结果
本研究从豆皮水溶性多糖中分离制得的果胶和中性糖两组分,均易溶于水,而两者的水溶液及干燥产物却有其各自的特点。如表4所示,当果胶溶液质量分数为2.5%时,溶液无色透明,干燥后的果胶呈透明片状,较脆易碎,须经粉碎后得微晶状粉末果胶;相比之下,同质量分数中性糖溶液为半透明乳白色,干燥后直接可得质地松散的纤维状粉末。这是由于果胶多糖富含羧酸基,在水溶液中易形成氢键等次级键以相互交联形成聚集体,更具柔性和伸展性,溶液透明度更好。中性糖在水溶液中不易聚集,呈多分散的杆状[9],干燥后即为松散的粉末。

表 4 感官评定结果Table 4 Sensory evaluation results
2.4.2 果胶鉴别定性结果
对果胶组分进行鉴别定性,质量分数为2.5%的果胶溶液经加热冷却后形成黏稠状液体;5 mL 1%的果胶溶液与1 mL 0.02 mol/L NaOH溶液混合后形成透明半凝胶沉淀,向其中加入1 mL盐酸溶液,加热后形成白色絮状沉淀。上述现象完全符合GB 25533—2010要求。
3 结 论
一般方法提取的豆皮水溶性多糖中半乳糖醛酸计含量仅约为40%,远远低于商品化果胶(半乳糖醛酸含量不小于65%)要求。本研究基于果胶遇Ca2+形成凝胶而中性糖不反应[2]的特点,通过单因素和正交试验探讨了可溶性固形物含量、钙化pH值、水洗次数以及酸化pH值对豆皮水溶性多糖分离效果的影响,结果表明:果胶和中性糖两组分的纯度相互制约,各因素对果胶纯度的影响均大于对中性糖纯度的影响;各因素对果胶纯度影响主次顺序为C>A>B>D,而对中性糖纯度的影响主次顺序为A>B>C>D。综合考虑最终确定的最优分离条件为A1B2C3D2,即:可溶性固形物含量2.5%、钙化pH 8、水洗5 次、酸化pH 2,实现了果胶和中性糖的有效分离。果胶纯度可高达85.48%,纯度和感官鉴别定性结果均符合国标要求,可作为商品果胶;中性糖纯度可达80.01%,为进一步探究豆皮中性糖的单糖组成、性质、功能以及应用价值鉴定了物质基础。
目前,尚无合适高效分离果胶与中性糖的方法一直是限制豆皮果胶工业化生产的问题所在,本研究证实了CaCl2法分离豆皮水溶性多糖中果胶与中性糖两组分的可行性,拓宽了豆皮多糖的应用领域,使豆皮高值化生产及利用成为可能。本法操作简便,成本低,绿色无污染,适合于工业化大生产,有望成为缓解高纯度果胶市场压力的有效途径。
[1] 刘贺, 高虹妮, 刘俊山, 等. Na+和Ca2+对大豆果胶类多糖黏度行为的影响[J]. 食品科学, 2013, 34(11): 10-12. doi: 10.7506/spkx1002-6630-201311003.
[2] 徐伟, 马力, 袁永俊, 等. 低甲氧基果胶的胶凝机理及防止预凝胶形成的措施[J]. 食品与发酵工业, 2004, 30(3): 90-93.
[3] 黄雪松, 郭秀君. 影响果胶钙凝胶形成的因素以及果胶钙凝胶应用[J].食品与发酵工业, 2013, 39(12): 145-151.
[4] STEPHEN A M, PHILLIPS G O. Food polysaccharides and their applications[M]. CRC Press, 2010: 354-397.
[5] TROMP R H, de KRUIF C G, van EIJK M, et al. On the mechanism of stabilisation of acidifi ed milk drinks by pectin[J]. Food Hydrocolloids, 2004, 18(4): 565-572.
[6] KATI T I, HIROKI K, TSUKASA M, et al. An immunomodulating pectic poiymer from Glinus oppositifolius[J]. Phytochemistry, 2007, 68: 1046-1058.
[7] 吴嘉怡, 张钧寿, 胡林森, 等. 果胶及果胶钙在缓、控释制剂中的应用[J]. 药学进展, 2001, 25(2): 90-92.
[8] NAHALKA J, LIU Z, GEMEINER P, et al. Nucleoside triphosphates production using recombinant Escherichia coli entrapped in calcium pectate gel[J]. Biotechnology Leters, 2002, 24: 925-930.
[9] 刘贺, 郭晓飞, 刘俊山, 等. 大豆果胶类多糖组成特性及空间结构的初步解析[J]. 中国粮油学报, 2010, 27(12): 12-16.
[10] 申利红, 王建森, 李雅, 等. 植物多糖的研究及应用进展[J]. 中国农学通报, 2011, 27(2): 349-352.
[11] 王菲菲, 郝利民, 贾士儒, 等. 云芝多糖研究进展[J]. 食品与发酵工业, 2012, 38(6): 148-152.
[12] 王章姐, 郁万杨, 张梦茹. 植物多糖研究进展[J]. 亚太传统医药, 2014, 10(6): 39-40.
[13] 罗绯, 林亲录, 陆玲, 等. 超声提取豆皮水溶性膳食纤维的工艺研究[J].食品与机械, 2008(6): 71-75; 151.
[14] 岳贤田. 国内果胶提取方法研究进展[J]. 安徽农业科学, 2010, 38(13): 6932-6933; 6960.
[15] 张亦澜. 可溶性大豆多糖在酸性蛋白饮料中的应用研究[D]. 上海:华东师范大学, 2013.
[16] 张世仙, 杨春梅, 吴金鸿, 等. 豆渣膳食纤维提取方法及功能研究进展[J]. 西南师范大学学报, 2009, 34(4): 93-97.
[17] 刘昊飞. 豆渣水溶性膳食纤维酶法制备及其应用[D]. 哈尔滨: 东北农业大学, 2008.
[18] 卫生部. GB 25533—2010 食品添加剂: 果胶[S]. 北京: 中国标准出版社, 2010.
[19] 许会生, 张铁军, 赵广荣, 等. 一种测定酸性多糖中糖醛酸和中性糖含量的改良方法[J]. 食品工业科技, 2007, 28(7): 197-199.
[20] 洪文生, 黄恺, 黄来发. 食品增稠剂[M]. 北京: 中国轻工业出版社, 2009.
[21] 汪海波. 低酯果胶的凝胶质构性能研究[J]. 食品科学, 2006, 27(12): 123-129.
[22] El-NAWAWI S A, HEIKAL Y A. Factors affecting the production of lowester pectin gels[J]. Garbohydrate Polymers, 1995, 26(3): 189-193.
[23] 赵静, 吴永娴, 高雪, 等. 减法脱脂制取低甲氧基果胶的研究[J]. 西南农业大学学报, 1995, 17(5): 428-430.
Optimization by Orthogonal Array Design of Pectin Separation from Soluble Soybean-Hull Polysaccharide
LI Qunfei, AN Ning, YU Dan, SUN Zizi, WEI Yuliang, CHI Yusen*
(College of Food Science and Engineering, Qingdao Agricultural University, Qingdao 266109, China)
Objective: To develop a suitable industrial method for effi cient separation of pectin from soluble soybean-hull polysaccharide. Methods: Based on single factor experiments, the effects of soluble solids content (A), calcification pH value (B), washing cycles (C) and acidifi cation pH value (D) on the purities of pectin and neutral sugar were investigated through L9(34) orthogonal experiments. Results: All the investigated factors affected more significantly the purity of pectin than that of neutral sugar. The infl uences of the four factors on the purity of pectin followed the descending order: C > A > B > D, while the order of their effects on the purity of neutral sugar was as follows: A > B > C > D. Based on comprehensive consideration the optimum separation conditions were determined as 2.5%, 8, 5, and 2 for soluble solids content, calcifi cation pH value, washing cycles, and acidifi cation pH value, respectively. Experiments conducted under these conditions resulted in a pectin purity of 85.48%, a pectin yield of 31.3%, a neutral sugar purity of 80.01% and a neutral sugar yield of 64.9%. Conclusion: The proposed separation method is effective, practical, easy to operate, low-cost, green pollution-free, and suitable for industrial production.
soluble soybean-hull polysaccharide; separation; pectin; neutral sugar
TS209
A
1002-6630(2015)08-0092-05
10.7506/spkx1002-6630-201508016
2014-09-10
李群飞(1988—),女,硕士研究生,研究方向为生物活性物质。E-mail:liqunfeixx@yeah.net
*通信作者:迟玉森(1962—),男,教授,博士,研究方向为生物活性物质及农产品高值化。E-mail:sd-chiyusen@163.com
